Ionizující záření v medicínské diagnostice, v
materiálové analýze a v radioterapii nádorových onemocnění
3.
Aplikace ionizujícího záření
-
jaderné a radiační metody -
3.1. Jaderné a radiační metody
3.2. Rentgenová diagnostika
3.3. Radiační měření
mechanických vlastností materiálů
3.4. Radiační analytické metody
materiálů
3.5. Radioisotopové stopovací
metody
3.6. Radioterapie
3.7. Technologické využití
záření
3.1.
Jaderné a radiační metody - obecné vlastnosti
V této kapitole se pokusíme podat
stručný přehled radioisotopových měřících metod a
aplikací ionizujícího záření v různých oblastech vědy a
techniky, zdravotnictví, průmyslu, ekologii a pod. Než si
budeme rozebírat konkrétní radiační metody, zmíníme se o
některých společných charakteristických aspektech těchto
metod.
Pozn.+omluva:
Aplikační metody ionizujícího záření jsou zde
rozebírány spíše z fyzikálního hlediska,
bez podrobností technických řešení, nikoli z hlediska
jednotlivých speciálních oborů použití; výjimkou jsou
metody rentgenové diagnostiky, radioterapie a zvláště
nukleární medicíny (kde je odkaz na podrobný a úplný
výklad - kapitola 4 "Radioisotopová
scintigrafie"). Prosím proto o shovívavost
odborníků na konkrétní metody, když zde nenaleznou
řadu důležitých technických nebo medicínských aspektů pro
praktické použití v jejich oboru; omlouvám se též za
případné nepřesnosti a přílišná zjednodušení v těchto
aspektech. Zaměřuji se zde především na výklad
fyzikální podstaty.
Radioisotopové a radiační metody mají některé důležité přednosti:
- Jaderné procesy jsou prakticky nezávislé
na obvyklých vnějších podmínkách (viz §1.2, část "Obecné zákonitosti přeměny atomových jader") jako je teplota,
tlak, vlhkost atd.
- Záření může proniknout i do míst
jinak nepřístupných. Metody založené na pronikavém
záření gama umožňují bezdotykové
měření "na dálku", bez nutnosti
odebírání vzorků, v jinak nepřístupných
místech, nedestruktivní a neinvazívní
měření dějů uvnitř organismu a pod. Podobně je
tomu u nedestruktivního radiačního ovlivňování
dějů v nepřístupných místech - např. radioterapie (§3.6).
- Některé radiační metody se vyznačují
velmi vysokou citlivostí (např.
neutronová aktivační analýza).
- Prakticky všechny jaderné a radiační
metody využívají elektronické detekce
záření. Měřené veličiny jsou při detekci
záření převáděny na elektrické signály,
které lze elektronickými metodami účinně a exaktně zpracovávat,
včetně digitálního počítačového vyhodnocení.
Vedle vyšší technické a cenové
náročnosti může být určitou nevýhodou
radiačních metod riziko škodlivých účinků
ionizujícího záření na materiály a na lidské zdraví; toto
riziko se však dá odstranit či minimalizovat
zajištěním příslušné radiační ochrany -
viz kapitola 5 "Biologické
účinky záření - radiační ochrana".
Září
či nezáří materiály po aplikaci záření ?
Toto je často diskutovaná otázka, zvláště v laické
veřejnosti. Argumentuje se zhruba tak, že "Při
ozáření daná látka (včetně příp. lidského těla)
absorbovala zářivou energii, která by se pak přece měla
vyzařovat !". V naprosté většině běžných
aplikací záření je tento, zdánlivě logický, argument chybný.
Fotonové záření, X, gama, proletí látkou rychlostí světla
(korpuskulární záření jen o něco pomaleji) a od okamžiku,
kdy látku opustí se v ní již nevyskytuje.
Mohou přetrvávat jen fyzikálně-chemické (příp. posléze
biologické) účinky záření :
¨ Při ozáření zářením X, g, b o energiích menších
než cca 10MeV dochází k excitacím a ionizacím atomů
ozařované látky, doprovázeným sekundárním zářením a
příp. chemickými radiačními účinky. Během expozice tedy
ozařovaný předmět vydává sekundární záření, jehož
intenzita představuje zlomek procenta intenzity primárního
svazku. Po ukončení toku záření dochází prakticky
okamžitě (během cca 10-8sec.) k deexcitacím a rekombinacím a látka pak již vůbec
nezáří. Toto záření se do určité míry chová
jako světlo: když ukončíme ozařování
("zhasneme"), záření okamžitě vymizí (je
"tma"). Nezáří tedy pacient po rtg
vyšetření ani po běžném radioterapeutickém ozařování
gama nebo X, nezáří předměty po rentgenfluorescenční
analýze nebo defektoskopii, nezáří materiály po radiační
sterilizaci.
¨ Složitější situace může nastat při ozařování
zářením neutronovým (i při nízkých
energiích - pomalé neutrony) a obecně vysokoenergetickým
zářením, jehož kvanta mají energii vyšší než
cca 10MeV. V takovém případě může záření vyvolávat jaderné
reakce, při nichž v původně neradioaktivních
materiálech mohou vznikat radionuklidy. Taková
látka může po skončení ozáření ještě nějakou dobu
"zářit". Ne proto, že by se snad vyzařovala
"naakumulovaná energie", ale protože došlo k
jaderné aktivaci materiálu. Září tedy
vzorky po neutronové aktivační analýze, silně září
terčíky ozařované v jaderných reaktorech a urychlovačích,
slabě a krátkodobě i pacienti po radioterapii zářením
vyšším než 10MeV, výrazněji po hadronové radioterapii (viz
§3.6 "Radioterapie", část
"Hadronová
radioterapie"). A
samozřejmě září pacienti po
aplikaci radioaktivní látky v nukleární medicíně
(intenzita tohoto záření exponenciálně klesá s rychlostí
danou poločasem rozpadu příslušného radionuklidu a mírou
jeho vylučování z těla).
Druhy
radiačních metod
Pro aplikace ionizujícího záření se využívají jednak uzavřené
zářiče - rentgenové, radioisotopové, urychlovače
částic, jednak otevřené zářiče -
radioaktivní kapaliny, plyny či aerosoly. Veškeré aplikace
ionizujícího záření lze rozdělit na dvě základní skupiny
:
1.
Radiační měřící, analytické a detekční metody
Tato velká skupina metod využívá
vlastností ionizujícího záření pro měření některých
fyzikálních a technických veličin, pro analýzu vlastností
látek a pro studování a detekci některých procesů v
přírodních a průmyslových soustavách nebo v živých
organismech (viz též níže pasáž
"Introskopie").
Z hlediska povahy
primárního a sekundárního záření, jakož i vzájemné
pozice zdroje záření, analyzovaného objektu a detektoru, lze
dále tyto metody rozdělit na tři skupiny:
- a) Absorbční
transmisní měření
Velká skupina aplikací ionizujícího záření je
založena na měření absorbce
záření v látkách, nejčastěji pronikavého
elektromagnetického záření X a gama, v některých
případech i záření korpuskulárního. Vyšetřovaný
objekt leží mezi zdrojem záření a
detektorem - je prozařován, přičemž
detektor měří zeslabení záření
nebo změnu jeho spektra při průchodu analyzovaným
objektem - obr.3.1.1a. Těmito metodami lze měřit a
sledovat tloušťku a hustotu materiálu, výšku hladiny
kapalin, složení směsi plynů, detekovat přítomnost
kouře, sledovat vlhkost atd. Nejdůležitějšími
metodami tohoto druhu je v oblasti medicíny rentgenová
diagnostika, v průmyslové oblasti pak defektoskopie.
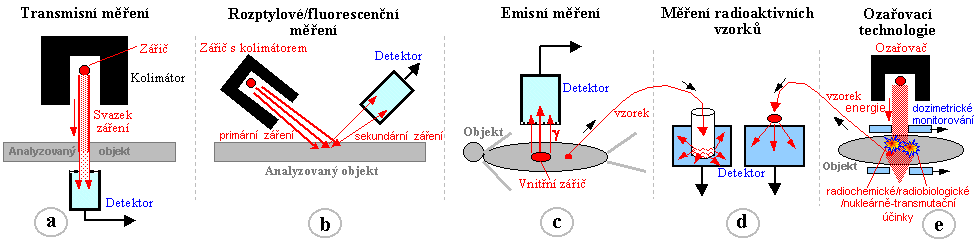
Obr.3.1.1. Geometrické uspořádání
zdroje záření, analyzovaného či ozařovaného předmětu a
detektoru při různých aplikacích ionizujícího záření.
a) Radiační měření transmisní. b)
Rozptylové a fluorescenční měření. c)
Emisní radiační měření. d) Měření
radioaktivních vzorků. e) Radiační
ozařování předmětů.
- b) Rozptylové a
fluorescenční měření
Při těchto metodách leží zdroj záření a detektor
ve stejném "poloprostoru" vzhledem k
měřenému vzorku - obr.3.1.1b. Primárním
zdrojem záření ozařujeme analyzovaný předmět a
detektorem měříme sekundární
záření vznikající ve vzorku příslušnými
fyzikálními mechanismy - Comptonovým rozptylem či
vznikem charakteristického X-záření v důsledku
fotoefektu. Kromě některých méně často
používaných metod rozptylového měření tloušťky
či hustoty sem patří především rentgen-fluorescenční
analýza a rentgenová difrakční
krystalografie.
Pozn.: Tento
způsob měření se někdy označuje jako "odrazový".
Je to však zavádějící, neboť při interakci
ionizujícího záření neplatí žádné zákony
geometrické optiky (jako je zákon odrazu nebo lomu).
Dochází pouze k rozptylu, absorbci a re-emisi
(fluorescenci) záření.
- c) Emisní
radiační měření
U emisních radiačních metod nemáme vnější
zářič, poněvadž zdrojem záření je samotný
vyšetřovaný objekt, který je radioaktivní
obr.3.1.1c. Radioaktivita je do vyšetřovaného objektu
buď zavedena (aplikována) ve formě radioindikátoru
(stopovací metody, nukleární medicína -
scintigrafie), nebo je uvnitř objektu indukována
ozařováním vhodným zářením, které
vyvolává v jádrech vzorku jaderné reakce, při nichž
se původně neaktivní jádra mění v radioaktivní
(tak je tomu u aktivační analýzy, především
neutronové).
- d) Měření
radioaktivních vzorků
odebraných z ozářených materiálů nebo látek s
aplikovanou radioaktivitou - obr.3.1.1d. Sem patří
stopovací metody v biologii a medicíně (nukleární
medicíně) či neutronová aktivační analýza.
Měření vzorků se někdy
kombinuje i s ostatními jadernými a radiačními
metodami, jak je naznačeno šipkami mezi obrázky
3.1.1c,d,e. Např. při dynamické scintigrafii
ledvin (což je emisní metoda podle obr.3.1.1c) se
odebírají a měří krevní vzorky pro
stanovení glomerulární filtrace ledvin (viz
§3.4 "Dynamická scintigrafie ledvin" v knize "OSTNUCLINE - matematická
analýza a vyhodnocování scintigrafických
studií").
Introskopie
Radiační měřící, analytické a detekční metody patří do
širšího oboru, zvaného někdy introskopie (lat. intro=uvnitř, řec. skopeo=pozorování;
doslovně tedy "dívání se dovnitř") - nedestruktivní zkoumání vnitřní
struktury objektů a v nich probíhajících procesů pomocí
fyzikálních metod: zvukových vln (včetně
ultrazvuku), elektromagnetického pole a elektromagnetických vln
(světla - např. klasická endoskopie v medicíně,
radiovln, UV, X a g-záření), toků elementárních částic
(urychlených elektronů, protonů, neutronů, těžších
iontů). Tyto metody jsou využívány především v medicíně
(od klasického fonendoskopu, přes optickou endoskopii až k
ultrazvukové sonografii, rentgenové diagnostice a gamagrafii),
ale i v řadě vědecko-technických a průmyslových aplikací
(defektoskopie, aktivační analýza, rentgen-fluorescenční
analýza a další). Všechny tyto metody, pokud používají ionizující
záření či metody jaderné fyziky,
budou níže podrobněji popsány.
2.
Radiační ozařovací a technologické metody
Zde je využívána především energie
předaná látce při ozařování - obr.3.1.1e, ionizace látek
a následné fyzikální, chemické a biologické účinky
ionizujícího záření v ozařovaném objektu. V oblasti
medicínských aplikací sem patří radioterapie,
při průmyslových aplikacích se jedná o některé radiačně
technologické procesy v chemii (jako je polymerace),
sterilizaci materiálů, výrobu radionuklidů.
V následujících
odstavcích (§3.2-§3.7) budou popsány jednotlivé konkrétní
metody aplikace ionizujícího záření, některé stručně
(průmyslové aplikace), jiné podrobně (rtg diagnostika,
radioterapie; ve zvláštním odkazu na samostatnou kapitolu 4
"Radionuklidová scintigrafie"
pak metody nukleární medicíny).
Kolimace
ionizujícího záření
V naprosté většině procesů vzniku ionizujícího záření
je toto záření emitováno téměř izotropně
do všech směrů *).
*) Výjimkou jsou interakce částic vysokých
energií, kdy vlivem relativistických zákonitostí
zachování hybnosti jsou vznikající částice a záření
kinematicky nasměrovány (kolimovány) ve
směru pohybu primárních vysokoenergetických částic.
Často však potřebujeme záření cíleně směrovat
do určitého úhlu, či ho soustředit do
určitého místa; záření do jiných směrů může být
nežádoucí - rušivé či dokonce škodlivé a nebezpečné.
Toto směrování, neboli kolimaci záření
můžeme provádět dvěma základními způsoby :
¨
Elektromagnetická
kolimace nabitých částic
U korpuskulárního záření nabitých částic se vhodné
směrování - kolimace - dá dosáhnout působením
elektrických a magnetických polí, která silově působí na
nabité částice. Dochází tím k vychylování směru pohybu
částic (papsrku), které můžeme cíleně nasměrovat
do požadovaného místa.
¨
Mechanická absorbční
kolimace záření
Jednodušším způsobem, který zároveň funguje jak pro
nabité částice, tak pro záření g a X, je však použití
kolimátorů. Kolimátor je takové mechanické a geometrické uspořádání
materiálů absorbujících daný druh
záření, které propouští jen záření z
určitých požadovaných směrů (úhlů),
zatímco záření z jiných směrů absorbuje a nepropouští
*).
*) Takové absolutně ostré kolimace však
v praxi nelze vždy dosáhnout. U pronikavého
vysokoenergetického záření g dochází v okrajových
hranách kolimátoru k částečnému prozařování,
což v okrajových částech kolimovaného svazku vytváří
jakýsi "polostín".
Kolimátory se používají prakticky ve všech aplikacích
ionizujícího záření. Většinou se jedná o jednoduché
kolimátory tvaru různých tubusů či clon
(jak je zjednodušeně znázorněno třebas na obr.3.1.1).
Složitě konfigurované kolimátory pak hrají klíčovou úlohu
především ve scintigrafii (zobrazovací kolimátory s velkým počtem otvorů -
§4.2 "Scintilační kamery", část "Kolimátory"), v RTG diagnostice (§3.2 "Rentgenová diagnostika") a v radioterapii (např.
mnoholamelové MLC kolimátory - §3.6 "Radioterapie",
pasáž "Modulace
ozařovacích svazků ").
Elektronická
kolimace záření
Vedle výše uvedené přímočaré "fyzické" kolimace
záření se v některých speciálních detekčních a
zobrazovacích systémech používá i jiný způsob směrové
selekce záření, tzv. elektronická kolimace,
bez použití mechanického kolimátoru. Je založena na
specifickém chování kvant ionizujícího záření v
detekčním systému - šíření dvojic (či více) kvant v
určitých přesně daných směrech, jejich koincidenční
detekce soustavou většího počtu detektorů a
následná poziční a úhlová rekonstrukce
směru šíření kvant. Tato analýza umožňuje vybírat k
dalšímu zpracování jen taková kvanta záření, která mají
požadovaný směr - provádět elektronickou
kolimaci a zobrazení distribuce záření v
daném poli. Metoda elektronické kolimace se používá v pozitronové
emisní tomografii PET (viz §4.3 "Tomografické
kamery, část "Kamery PET")
a v některých složitých detekčních systémech jako jsou prstencové
zobrazovací Čerenkovovy detektory RICH (viz....), trackery
a mionové detekční systémy u urychlovačů (viz §2.1,
pasáž "Uspořádání a
konfigurace detektorů záření").
Zobrazování
pomocí záření - radiografie
Samotný pojem zobrazování
vychází ze schopnosti našeho zraku vnímat světlo, jeho
intenzitu, vlnovou délku a prostorové rozložení, z čehož si
vytváříme základní představy o tvarech, velikosti a
rozmístění předmětů v prostoru. Když chceme získat
objektivní představu o nějakém objektu, jeho struktuře,
změnách a procesech v něm probíhajících,
nejpřehlednější je získání příslušných údajů v obrazové
formě. To platí pro neživý předmět, živý
organismus, lidské tělo, nebo třebas vzdálenou galaxii ve
vesmíru. Toto zobrazování se provádí zviditelňováním
fyzikálních polí, s nimiž vyšetřovaný objekt
interaguje, nebo která vysílá. Tedy pomocí různých druhů záření,
kterým daný objekt ozařujeme, nebo které samotný objekt
emituje. Prošlé, odražené, rozptýlené či emitované
záření detekujeme vhodnými polohově citlivými
detektory, které zobrazují prostorovou distribuci pole
záření (či jeho rovinné průměty) a příp. též jeho
další vlastnosti (především energii kvant záření) - viz §2.1 "Metodika detekce ionizujícího záření".
Radiografie je souhrnný název
pro měření množství a zobrazování distribuce
záření ze studovaných objektů, které emitují záření
buď primárně, nebo sekundárně při jejich ozařováním z
vnějších zdrojů záření. Toto zobrazení se provádí
pomocí fotochemických projevů ve fotografických emulzích,
světélkování luminiscencí stínitek a především
fyzikálních procesů v elektronických zobrazovacích
detektorech. Patří sem řada metod z oblastí rentgenové
diagnostiky, radiační defektoskopie, gamagrafie (scintigrafie)
s využitím radiofarmak.
O metodách zobrazování pomocí různých
druhů záření je pojednáváno níže. O rentgenovém
zobrazení hned v následujícím §3.2 "X-záření - rentgenová
diagnostika" (včetně
dodatku "Rentgenové teleskopy"). Autoradiografie - fotografické
zobrazení distribuce beta-radioindikátoru ve zkoumaných
preparátech při těsném kontaktu fotografické emulze
se vzorkem je popsáno v §2.2 "Fotografická detekce
ionizujícího záření", pasáži "Autoradiografie".
Zobrazování pomocí záření gama je
podrobně rozebíráno v celé kapitole 4 "Radionuklidová
scintigrafie" především pro
aplikace v nukleární medicíně (jsou tam
však stručně uvedeny i metody g-zobrazování z vesmíru - gama-teleskopy,
"Gamakamery pro vysoké energie").
Vedle vizuálního pozorování a
hodnocení takto získaných obrazů je často důležitá i matematická
analýza obrazů, ať již statická (filtrace,
porovnávání údajů z různých míst obrazu či mezi
různými obrazy), nebo dynamická (vyhodnocování a
kvantifikace časových změn v různých částech obrazu,
odrážejících dynamiku příslušných procesů ve
zobrazovaném objektu); tynto aspekty jsou podrobně rozebírány
pro oblast scintigrafie v §4.7 "Matematická analýza a počítačové
vyhodnocování v nukleární medicíně".
3.2.
X-záření - rentgenová diagnostika
Vůbec nejstarší, nejrozšířenější a dosud patrně
nejdůležitější aplikací ionizujícího záření, je rentgenová
diagnostika (rtg diagnostika, často nazývaná
též radiodiagnostika, lidově "rentgenování").
Z fyzikálního hlediska zde probereme přístrojovou techniku a
metody RTG diagnostiky :
Objev X-záření
V posledních desítiletích 19.stol. zkoumala řada badatelů elektrické
výboje pod vysokým napětím ve zředěných plynech.
Byly přitom objeveny tzv. katodové paprsky, o nichž
se později zjistilo, že jsou to rychle se pohybující
elektrony (viz též §1.1, část "Stavba atomů"). Tyto pokusy s výboji v katodové trubici
dělal v r.1895 i W.C.Röntgen v laboratoři ve Würtzburgu. V
temné komoře sledoval světélkování vyvolané katodovými
paprsky na luminiscenčních stínítkách. Zkusil zakrýt
katodovou trubici černým papírem a zjistil, že
luminiscenční stínítko při přiblížení i k takto zakryté
trubici světélkuje; a to i tehdy, když mezi trubici a
stínítko vložil tlustou knihu. Teprve když mezi trubici a
stínítko umístil kovový předmět, na stínítku se ukázal
stín. A když mezi katodovou trubici a stínítko náhodně
vložil svou ruku, objevily se na stínítku slabé obrysy
kostí. Bylo jasné, že z katodové trubice vycházejí neznámé
pronikavé paprsky - "paprsky X",
jak je nazval Roentgen (písmeno X
jako symbol pro něco neznámého - neznámá proměnná v
matematice, neznámá osoba v detektivce).
Toto záření dovede pronikat papírem a masitou tkání, avšak
kovové předměty a kosti jsou pro toto záření
"neprůhledné". Dále Roentgen zjistil, že toto
záření vyvolává zčernání fotografické desky.
 |
Objev X - záření.
Vlevo: Laboratoř W.C.Röntgena ve Würtzburgu.
Uprostřed: Röntgen předvádí své
X-záření. Vpravo:
X-záření ve stejné době nezávisle objevili
H.Jackson a A.A.Campbell-Swinton, nezabývali se však
tehdy medicínkou aplikací. |
Ihned po svém objevu
pronikavého záření vycházejícího z katodové trubice v
r.1895 pořídil sám Roentgen na fotografickou desku historicky
první rtg obrázek, a to ruky své manželky (obr.3.2.1 vpravo,
i s prstenem). Jak Roentgen, tak i další odborníci z řad
lékařů si byli od počátku vědomi velkého významu nově
objeveného záření pro medicínu. Roentgen se
tak stal prvním rentgenologem (radiologem)...
Roentgen
i další badatelé si zpočátku mysleli, že pronikavé
záření vzniká ve zředěném plynu katodové trubice. V
dalších experimentech se ukázalo, že zdrojem X-záření
není samotný výboj v plynu, ten pouze dodává elektrony,
které se urychlují a při svém dopadu na anodu vzbuzují brzdné
X-záření. Odstranění (vyčerpání) plynu a
použití žhavené katody emitující elektrony zvýší
účinnost vzniku rtg záření - během několika desítiletí
se tak vyvinuly vakuové rentgenky (podrobně
popsané níže).
Pozn.: Krátké
zamyšlení nad tím, nakolik objev X-záření byl dílem
náhody či metodického postupu, je uvedeno v §1.0 "Fyzika
- fundamentální přírodní věda", pasáž "Významné
přírodovědecké objevy - náhoda nebo metoda?".
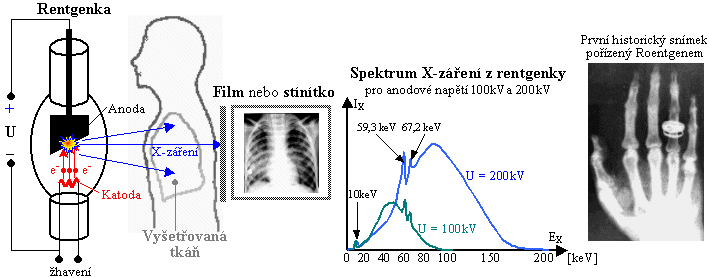
Obr.3.2.1. Princip rentgenové diagnostiky
.
Vlevo: Základní principiální
schéma rentgenového zobrazení. Uprostřed:
Spektrum X-záření rentgenky (filtrované).
Vpravo: První rtg snímek pořízený
samým Roentgenem - ruky jeho manželky i s prstenem (podle jiných pramenů se zde snad jednalo o ruku jeho
přítele prof. anatomie A.Koellikera..?..).
Vznik a vlastnosti
rentgenového obrazu
Při použití RTG záření k zobrazování (zvláště v
medicíně) se využívá jeho základní vlastnosti pronikat
i materiály neprůhlednými pro světlo.
Základní principiální schéma rentgenového transmisního
zobrazení je v levé části obr.3.2.1. Pronikavé
elektromagnetické X-záření o energii fotonů cca 20¸150keV (vlnové délky cca 5 až 50 pikometrů), vznikající v rentgenové elektronce,
prochází přes vyšetřovaný objekt (tkáň organismu),
přičemž část záření se absorbuje v
závislosti na tloušťce a hustotě tkáně,
zatímco zbylá část prochází tkání a je zobrazována
buď fotograficky, nebo na luminiscenčním stínítku, nověji
pak pomocí elektronických detektorů. V těle je X-záření
nejvíce pohlcováno kostmi, méně měkkými tkáněmi,
nejméně tělními dutinami a vzduchem. Při expozici
X-zářením vzniká tak rentgenový obraz
vyšetřované tkáně, který je projekčním stínovým
obrazem denzitním, zobrazujícím rozdíly v hustotě
tkání *). Jinak řečeno, rtg obraz vzniká projekcí
X-záření z ohniska anody, přes tkáňové struktury uvnitř
organismu s různými absorbčními koeficienty a různými
tloušťkami, na film či zobrazovací detektor. Různým
absorbcím X-záření v různých tkáních jsou na obraze
přiřazovány různé intenzity ve stupnici šedi; toto
přiřazení je realizováno buď analogovým způsobem
(zčernání filmu), nebo digitálně (elektronické zobrazovací
detektory + počítač, viz níže). Vzniká tak obraz
odrážející velikosti, tvary a uspořádání tkání a
orgánů v organismu, včetně případných změn vyvolaných
patologickými procesy.
*) Diferencovaná absorbce
X-záření je základem vzniku RTG obrazu. Tato absorbce
závisí na tloušťce vrstvy, hustotě a protonovém čísle
prozařované látky. Měkké tkáně mají menší hustotu a
nižší absorbci X-záření - těmito místy je propuštěno
více záření, dostaneme jasnější obraz či větší
zčernání fotografického materiálu. Kosti s obsahem vápníku
jsou hutnější a více absorbují rtg záření - méně ho zde
projde, obdržíme v těchto místech méně intenzivní obraz
či menší zčernání fotografického filmu. Na obr.3.2.1
vpravo je rtg obraz na fotografickém filmu.
X-záření interaguje s
atomy tkáně především dvěma procesy, podrobněji
rozebíranými v §1.6, část "Interakce záření gama a X": fotoefekt a Comptonův
rozptyl (tvorba elektron-pozitronových
párů zde nenastává vzhledem k nízké energii fotonů
používaných při rtg diagnostice; nevýznamnou výjimkou mohou
být portálové a tomo-terapeutické snímky na
radioterapeutických ozařovačích, viz §3.6 "Radioterapie"). Oba tyto procesy se
podílejí na rozdílné absorbci záření v
jednotlivých tkáních (a též na rozdílné absorbci v
normálních a patologických okrscích v rámci téže tkáně),
v závislosti na tloušťce, hustotě látky a protonovém
čísle atomů. Právě na této rozdílné absorbci X-záření
v různých tkáních, jakož i jejich fyziologických či
patologických stavech, je založena rtg diagnostika.
Chemické
(atomové-prvkové) složení tkání a orgánů ?
Různé tkáně a orgány se liší svým chemickým
složením, což se může, ale nemusí,
odrážet v jejich různých hustotách. Pokud mají dvě
sousední struktury v organismu stejný nebo blízký absorbční
koeficient (lineární součinitel
zeslabení) pro použité X-záření, na
RTG obrazech budou od sebe nerozlišitelné - budou se
jevit jako identické, i v případě když jejich
materiálové (chemické, prvkové) složení bude výrazně
odlišné. Diferenciace či klasifikace různých typů tkání
standardním RTG zobrazením je tedy velmi obtížná a často
nemožné.
Určitou možností aspoň částečného rozlišení
materiálového složení zobrazovaných struktur je
měření - zobrazení při různých energiích
X-záření - spektrometrie X-záření. Těmito
možnostmi se budeme zabývat níže v pasážích "Elektronické
zobrazovací detektory X-záření"
- "Photon-counting RTG zobrazení",
"Detektory
X-záření pro CT"
a "CT s 2 rentgenkami - DSCT : Dual Source a Dual
Energy CT".
Kvalita
rtg obrazu
Pro kvalitní rtg zobrazení a rozpoznání jemných struktur a
anomálií jsou důležité především tři parametry:
¨
Ostrost a rozlišovací schopnost
zobrazení
Pro ostrost projekčního obrazu je důležitý malý
rozměr dopadového ohniska, z něhož je X-záření
emitováno (viz níže "Konstrukční
provedení rentgenky"). Pro
klasickou rtg diagnostiku má ohnisko velikost cca 0,5¸2mm, pro rtg
mikroskopii je však požadováno téměř bodové ohnisko o
průměru řádově mikrometry. S ostrostí úzce souvisí prostorová
rozlišovací schopnost zobrazení *). Ostrost a
rozlišovací schopnost může být též ovlivněna vlastnostmi
zobrazovacího média - fotografického filmu, zesilovacích
fólií, elektronických zobrazovacích detektorů. Rozlišovací
schopnost rtg zobrazení se pohybuje kolem cca 0,5-2mm, v
závislosti na velikosti ohniska (u rtg
mikroskopie může být i tisíckrát lepší!).
*) Rozlišovací schopnost
je definována jako nejmenší vzdálenost dvou
"bodových" objektů, při níž se tyto ještě
zobrazí jako dvě oddělené struktury; nebo ekvivalentně jako
pološířka profilu obrazu bodového objektu. Při menší
vzdálenosti se již oba objekty zobrazí jako jeden, nejsou
rozlišeny. Podobně jako ve fotografii se rozlišení často
měří v maximálním počtu čar na milimetr [lp/mm],
které lze ještě rozlišit; v praxi se reálné rozlišení
pohybuje kolem 2-5 lp/mm. Kvalita RTG zobrazení z hlediska
reálného rozlišení se někdy podrobně kvantifikuje pomocí
tzv. modulační přenosové funkce MTF,
udávající pomocí Fourierovské harmonické analýzy,
jaké podrobnosti zkoumaného objektu lze s daným kontrastem
zobrazit. Problematika rozlišení, kontrastu a rozpoznatelnosti
lézí na rtg obraze je do značné míry podobná jako u
scintigrafického zobrazení - je podrobně rozebíráno v §4.2,
část "Kvalita scintigrafického obrazu a
detekovatelnost lézí".
K
podstatnému zhoršení ostrosti a rozlišovací schopnosti
dochází zvláště při rozmazání obrazu v
důsledku pohybu pacienta během expozice - pohybová
neostrost. Toto riziko se u moderních přístrojů
minimalizuje zkrácením expoziční doby, díky současnému
zvýšení intenzity X-záření. Rovněž pohyby určitých
struktur uvnitř těla - tepání srdce či dýchací pohyby -
vedou k rozmazání obrazu. Tento nepříznivý vliv se dá
eliminovat hradlováním (trigrováním) a
synchronizací obrazu v určitých fázích srdeční pulzace či
dýchání - EKG-gating, respiratory-gating.
¨
Kontrast zobrazení,
vyjadřující gradient zobrazení rozdílů v absorbci
X-záření pomocí stupnice šedi, je dán dvěma faktory. V
prvé řadě je to poměr absorbčních koeficientů pro různé
druhy zobrazované tkáně. Ten záleží především na rozdílnosti
v hustotě (denzitě) jednotlivých okrsků tkáně; tam,
kde je tento rozdíl nepatrný nebo žádný, si jej někdy
můžeme zvýšit aplikací kontrastních látek (viz
níže). Kontrast v absorbci dále závisí na energii
X-záření. Pro tenší vrstvy měkké tkáně je
vhodnější měkké X-záření (cca 20keV), které interaguje
především fotoefektem se strmějším rozdílem absorbce v
závislosti na denzitě (největší
kontrast se dosahuje pro energie X-záření blízké vazbové
energii elektronů na K nebo L slupkách atomů vyšetřovaného
materiálu). Pro zobrazení tlustších
vrstev a hutnějších materiálů (třebas struktury skeletu) je
zapotřebí tvrdšího X-záření (cca 80¸100keV). Kontrast je
negativně ovlivňován Comptonovsky rozptýleným zářením
(viz níže "sekundární clony"). Významným
geometricko-anatomickým faktorem, podstatně zhoršujícím
kontrast rtg obrazu a celkovou rozpoznatelnost lézí, je
prozařování a superpozice X-záření z jednotlivých vrstev
tkání a orgánů v různých hloubkách, obecně s různými
denzitami. Tento nepříznivý efekt je do značné míry
eliminován u tomografického
zobrazení CT.
U digitálních přístrojů
lze kontrast dodatečně zvýšit počítačovým zpracováním (post-processing)
- vhodnou jasovou modulací obrazu. Při takovém zpracování je
důležitá tzv. bitová hloubka - počet bitů,
v němž je obraz vytvářen v procesu analogově-digitální
konverze (ADC) z elektronického detektoru X-záření do
obrazové matice v počítači. Při zobrazení pak bitová
hloubka udává maximální počet odstínů šedi,
které jsme schopni na snímku zobrazit - čím větší je tento
počet stupňů šedi, tím prokreslenější se nám zobrazují
zvláště malé rozdíly denzity a jemné detaily. Vyšší
počet bitů v obraze umožňuje zdůraznit detaily v obrazu
pomocí vhodných zobrazovacích oken jasové modulace -
roztažení určitého malého rozmezí jasových hodnot v obraze
na celou škálu.
Vztah mezi nejčastěji používanou
bitovou hloubkou a maximálním počtem odstínů šedé je
následující (je dán mocninou 2b):
2 bity = 2 odstíny (jen bílá a černá); 4 bity = 16
odstínů; 8 bitů = 256 odstínů; 12 bitů = 4096 odstínů; 14
bitů = 16384 odstínů; 16 bitů = 65536 odstínů; 24 bitů =
16777216 odstínů.
Velký počet odstínů (desítky a stovky tisíc) sice již oko
přímo nerozliší, avšak umožňuje to použít úzká
zobrazovací okna pro zdůraznění gradientů denzity.
¨
Počet fotonů v obraze - statistický šum
Pro získání kvalitního dobře exponovaného obrazu
je třeba určitý optimální počet fotonů
X-záření. U filmů a luminiscenčních stínítek je tento
počet fotonů dán především citlivostí
použitého materiálu, aby obraz nebyl podexponovaný nebo
přeexponovaný. U digitálních zobrazovacích detektorů
můžeme sice jas obrazu dodatečně upravit, avšak kvalita
obrazu je přesto dána následujícím faktorem: Emise
X-záření, jeho interakce i zobrazovací detekce je podřízena
stochastickým kvantovým zákonitostem, vedoucím ke
kvantovým statistickým fluktuacím toku
fotonů. Při nedostatečném počtu fotonů X-záření je obraz
"zašuměný", složený z rušivých arteficielních
jasnějších a tmavších skvrnek a shluků bodů, v nichž
mohou jemné struktury a detaily zanikat. Máme-li v daném
elementu (pixelu) obrazu registrovaný počet N fotonů
X-záření, pak lokální statistické fluktuace - rozptyl,
relativní chyba - činí SD = 1/ÖN. Pro získání dobře
prokresleného obrazu se statistickými fluktuacemi menšími
než 3% je třeba v každém elementu obrazu zaznamenat více
než 1000 fotonů, pro 1% fluktuace musí být více než 10 000
impulsů/element. U digitálních zobrazovacích detektorů - flat
panelů (popsaných níže) - závisí kvalita rtg obrazu z
hlediska šumu na citlivosti senzoru: ta se udává pomocí detekční
kvantové účinnosti DQE (Detection Quantum
Efficiency), což je procentuální množství fotonů
X-záření dopadlých na detektor, které je skutečně
detektorem zaznamenáno a využito k tvorbě snímku (zbytek je neužitečně pohlcen vstupním okénkem či
materiálem detektoru bez scintilační či elektrické odezvy). U digitálních rtg obrazů, především CT, se
statistický šum obrazu vyjadřuje v Hounsfieldových
jednotkách HU (zavedených níže v
části "Rentgenová
tomografie -CT", pasáž
"Vznik denzitního obrazu"); v kvalitním obraze by šum SD neměl přesahovat cca
20-30 HU. Celkový počet fotonů pro expozici daného snímku se
nastavuje pomocí součinu proudu rentgenkou a expozičního
času (viz níže část "Rentgenka", pasáž "Brzdné X-záření") - "miliampér-sekundy" [mAs]; může
být též elektronicky regulován pomocí expoziční
automatiky - viz níže "Nastavení
parametrů X-záření",
pasáž "Expozice".
¨
Artefakty na rtg obrazu
Za určitých okolností se na rtg obrazech mohou
objevit některé struktury, které nemají svůj původ ve
zobrazovaném předmětu - jsou to falešné artefakty.
Mohou být způsobeny nehomogenitami, defekty nebo nečistotami
na fotografickém filmu či zesilovacích fóliích,
nehomogenitami v detektorech flat-panelu, nežádoucími
předměty (např. kovovými) ve svazku X-záření. U CT
zobrazení se mohou uplatnit i tzv. strukturní artefakty,
vznikající při rekonstrukci transverzálních řezů v
místech s ostrými rozdíly denzity, především na přechodu
kosti a měkké tkáně.
Rentgenka
Zdrojem X-záření pro rtg zobrazení je speciální vakuová
elektronka zvaná rentgenka, rentgenová lampa
či trubice (angl. X-ray tube). Z
elektronického hlediska je rentgenka prostě klasická dioda
zapojená v obvodu s vysokým napětím cca 20-200kV. Má tedy
dvě kovové elektrody :
-->
Katoda
tvořená tenkým kovovým drátkem, svinutým do úzké
spirálky. Pro žhavené vlákno katody je vhodný takový kov,
který je teplotně velmi odolný - má vysoký bod tání,
je pevný a mechanicky stabilní, má nízkou výstupní práci
emise elektronů. Nejčastěji se používá wolfram,
který má vysokou teplotu tání 3300 °C. Je to v zásadě
podobné jako u wolframových vláken klasických žárovek (kde však jde o emisi světla, nikoli elektronů).
Na tuto kovovou spirálku se přivádí
elektrický proud (několika Ampér), čímž se vlákno rozžhaví na
teplotu cca 2000 °C. Termoemisí pak dochází
k uvolňování elektronů z kovu - žhavená katoda emituje
elektrony. K uvolňování elektronů dochází tehdy,
když elektrony při svém termálním pohybu získají
kinetickou energii vyšší než je výstupní práce
elektronů z daného kovu. S rostoucí teplotou kovu pak
výrazně narůstá hustota termoemise elektronů. Závislost
intenzity termoemise J na teplotě kovu T je
popsána Richardsonovým vzorcem :
J = F . T2 . e-w/(k.T)
,
kde J je hustota proudu emitovaných
elektronů [A/cm2] - proud na jednotku plochy emitujícího povrchu kovu,
T je absolutní teplota kovu [°K], w je výstupní
práce elektronů [eV], k=8,62.10-5 eV/°K je
Boltzmanova konstanta. Emise elektronů má stochastický
charakter kvantového tunelového jevu (§1.1, pasáž "Tunelový
jev").
F je materiálově závislá konstanta
[A/(cm2.°K2)], pro wolfram má
hodnotu F~ 60 A/(cm2.°K2). Výstupní práce elektronů z wolframu je w=4,5 eV a
začíná emitovat elektrony při zahřátí na teplotu vyšší
než 2000 °C, k účinné emisi však dochází až při
teplotách 2300-2500 °C.
Pro katodu rentenky se místo čistého
wolframu někdy používá wolframové vlákno pokryté vrstvou thoria,
které má nižší výstupní práci elektronů jen 2,6
eV. Malé množství thoria, přimíchané do wolframu, v drátku
zahřátém na cca 2500°C driftuje do povrchové vrstvy, kde
způsobuje účinnější termoemisi elektronů. Katoda
z tohoto thoriovaného wolframu účinně emituje elektrony již
při teplotě 1700-1900 °C. Touto nižší pracovní teplotou se
asi trojnásobně prodlužuje životnost katody.
Pokud by na anodě nebylo kladné napětí,
emitované elektrony by utvořily elektronový oblak
kolem katody a jejich odpudivá síla by další termoemisi
zabránila (tak je tomu kolem vlákna
žárovky). Při dostatečně vysokém
kladném napětí (>60kV) na anodě jsou však termoemisní
elektrony průběžně odváděny od katody a urychleně se
pohybují směrem k anodě, elektronový oblak se nevytváří.
Pokud je ale anodové napětí poměrně nízké (<40kV),
část emitovaných elektronů již na anodu nedoletí a okolo
katody zůstává větší či menší elektronový oblak,
bránící silnější termoemisi elektronů. Silnější
žhavení katody již pak nevede k vyšší termoemisi a k
většímu elektronovému proudu rentgenkou.
Katoda
tvaru plochého emitoru
Některé nové rentgenky místo
klasického spirálového vlákna mají žhavenou katodu
řešenou technologií tzv. plochého emitoru
(flat emitter). Je tvořena obdélníčkem žhaveného tenkého
plechu, maskovaného několika otvory. Nastavením záporného
napětí mezi štěrbinou katody a emitorem lze přesněji
dosáhnout velmi ostře lokalizovaného dopadového ohniska na
anodě.
-->
Anoda
Elektrony emitované z katody jsou přitahovány k anodě
*) s vysokým kladným napětím, přičemž jsou silným
elektrickým polem urychlovány na kinetickou
energii E = U.e, danou vysokým napětím U mezi katodou a
anodou (tj. E = cca 20¸200keV) a nábojem elektronu e. Těsně před
dopadem na anodu získá elektron s nábojem e a
hmotností me značně vysokou rychlost v = Ö(2.e.U/me) (pro napětí U=60kV budou mít elektrony kinetickou
energii 60keV a dopadovou rychlost v přibližně
150000km/s, což je poloviční rychlost světla). Po dopadu na anodu se elektrony prudce
zabrzdí, přičemž část jejich kinetické energie se
přemění na tvrdé elektromagnetické záření -
X-záření dvojího druhu: brzdné záření a
charakteristické záření (vznik
a vlastnosti těchto dvou druhů záření jsou rozebírány
níže). Toto rtg záření opouští anodu
a vylétá z trubice ven (obr.3.2.1 vlevo).
*) Anoda, elektroda umístěná naproti katodě, se dříve
nazývala též antikatoda, zvláště u
katodových trubic.
Anoda je zhotovena z
těžkého materiálu (nejčastěji z wolframu), který má
vysokou elektronovou hustotu, takže dopadající elektrony jsou
velkou odpudivou silou prudce brzděny, čímž se podle
zákonitostí elektrodynamiky část jejich kinetické energie
mění v brzdné elektromagnetické záření - fotony
X-záření. Účinnost tohoto procesu je však poměrně malá -
jen asi 1% celkové kinetické energie elektronů je
transformováno na fotony X-záření, zbytek se mění v teplo.
Důvodem je, že jen asi 1% elektronů pronikne dostatečně
hluboko dovnitř atomů materiálu anody, až ke slupce L nebo K,
kde teprve působí velké Coulombovské elektrické síly
způsobující prudkou změnu rychlosti elektronů a tím
efektivní buzení tvrdého brzdného záření. Ostatní
elektrony předávají svou kinetickou energii elektronům a
atomům krystalové mřížky, což vyústí v teplo.
Pozn.: Rentgenku
lze považovat za nejjednodušší urychlovač částic
(§1.5 "Elementární částice", část "Urychlovače nabitých částic") - je to lineární elektrostatický urychlovač
elektronů, jejichž zdrojem je žhavená katoda, (vnitřním)
terčíkem je anoda, ven vychází brzdné (+charakteristické)
X-záření.
Volt-ampérová charakteristika
rentgenky
Pro elektronický provoz rentgenky je důležité, jak závisí
proud elektronů [mA] rentgenkou na anodovém napětí [kV] - volt-ampérová
charakteristika - a též na žhavicím proudu [A]
katody. Při daném žhavení katody (např. proudem cca 5A, na
teplotu cca 2300°C) se při zvyšování anodového napětí
elektronový proud rentenkou postupně zvyšuje (stále
další elektrony z oblaku kolem katody se dostávají na anodu)
a pak dosáhne nasycení - všechny termoemisí
uvolněné elektrony dopadají na anodu a již nejsou žádné
další volné elektrony, které by při vyšším anodovém
napětí mohly doletět na anodu.
Důležitá je též katodová proudová
charakteristika rentenky - závislost výsledného
elektronového anodového proudu na žhavicím proudu
katody. Tato charakteristika je různá při různém anodovém
napětí. Obecně s rostoucím žhavicím proudem zpočátku
roste i anodový proud, avšak pouze do určité hodnoty. Při
nízkém anodovém napětí (<40kV) dochází k saturaci
- zvyšování žhavicího proudu již nevede k růstu anodového
proudu: elektrický potenciál není
dostatečný, aby všechny termoemitované elektrony doletěly na
anodu, vzniká elektronový mrak kolem katody. Pouze
při vysokém anodovém napětí (>60kV) již všechny
termoemisí uvolněné elektrony dopadají na anodu a efekt
elektronovího oblaku a saturace nenastává.
-->
3.
elektroda - mřížka ?
Kromě katody a anody se ojediněle u některých typů rentgenek
můžeme setkat ještě s třetí elektrodou - drátěnou mřížkou,
umístěnou mezi katodou a anodou, v těsné blízkosti katody.
Elektrické napětí, přivedené na tuto mřížku, velmi
citlivě moduluje tok elektronů (tj. anodový proud) a
tím i intenzitu X-záření. Přivedením vyššího záporného
napětí na mřížku lze velmi rychle přerušit anodový proud
a tím emisi X-záření (využívá se někdy pro rychlou rtg
kinematografii).
Brzdné
X-záření
Brzdné záření je důsledkem zákonitostí Maxwellovy
elektrodynamiky, podle nichž při každém nerovnoměrném
("zrychleném") pohybu elektrického náboje dochází
k vyzařování elektromagnetických vln - viz
§1.5 "Elektromagnetické pole. Maxwellovy rovnice.", Larmorův vzorec (1.61'), monografie "Gravitace,
černé díry a fyzika prostoročasu". Proto i při zabrzdění elektronu po
dopadu na anodu vzniká elektromagnetické záření tím
intenzívnější a tvrdší, čím prudší je zabrzdění (čím větší je decelerace a ve
zmíněném vzorci) -
viz též §1.6, pasáž "Brzdné
záření".
Účinný průřez
pro produkci brzdného záření je obecně dán značně
komplikovaným Bethe-Heitlerovým vzorcem (odvozeným v rámci kvantové teorie záření, s
korekcí Sauterovým a Elwertovým faktorem
Coulombovského stínění elektronového obalu). Pro ne příliš široké rozmezí kinetických
energií Ee dopadajících elektromů (desítky až stovky keV) a
protonových čísel Z terčíkového materiálu
(středně těžké až těžké materiály) lze celkovou účinnost
produkce brzdného záření h aproximovat zjednodušeným
vzorcem:
h = Ee[kev] . Z . 10-6
[fotonů/elektron] .
Převedením počtu elektronů ne na proud I = ne.qe/t a dosazením hodnoty náboje elektronu qe=1,6.10-19C (=1,6.10-16mAs) z tohoto vztahu
plyne výsledný tok fotonů IX [počet fotonů/s.]
brzdného záření v závislosti na proudu rentgenkou I[mA] a anodovém napětí U[kV]:
IX = U . I . (Z/1,6) .
1010
[fotonů/s] ,
který bude použit níže v pasáži "Nastavení
parametrů X-záření". Jen
poměrně malá část (pouze cca 1%) původní
kinetické energie dopadající částice se při zabrzdění v
látce mění na brzdné záření. Většina energie se
mnohonásobným Coulombovským rozptylem nakonec přenáší na
kinetickou energii atomů látky anody - mění se na teplo.
Celkové energetické spektrum X-záření
(brzdného+charakteristického), emitovaného z anody rentgenky, je nakresleno níže
na obr.3.2.5 vpravo nahoře. Grafický tvar energetického
spektra I(E) spojitého brzdného X-záření se
přibližně aproximuje tzv. Kramersovým vzorcem
:
I(E) = K .
I . Z . (Emax - E) ,
kde I(E) je relativní intenzita fotonů energie E, Kje
konstanta, Z je protonové (atomové) číslo materiálu
anody, Emax
je maximální energie fotonů X-záření, daná kinetickou
energií dopadajících elektronů. Je jasné, že I(Emax) = 0 a vzorec
platí jen pro E<Emax .
Je
logické, že účinnost produkce brzdného záření je vyšší
pro vysoké Z - v okolí takových jader působí velké
elektrické Coulombovské síly, způsobující prudké změny
vektoru rychlosti dopadajících elektronů, které se dostanou
blízko k jádru. Účinnost vzniku brzdného záření [počet
fotonů/elektron] roste i s energií Ee dopadajících elektronů. Elektrony nízké energie
jsou většinou rozptylovány na vnějších slupkách atomů
materiálu anody a vysílají měkké záření, které často
ani nedosahuje rentgenového energetického oboru. Čím vyšší
je energie dopadajících elektronů, tím vyšší je
pravděpodobnost že proniknou hlouběji do atomů anody, až do
blízkosti jádra, kde působí největší elektrické síly
výrazně měnící vektor rychlosti elektronu, což vede k
vyšší energii i účinnosti produkce brzdného X-záření.
Celková energetická účinnost - poměr sumární energie
emitovaných fotonů ku energii dopadajících elektronů - je
však pro vyšší energie nižší (vzhledem k vyššímu
procentuálnímu zastoupení nízkoenergetických fotonů). A
tepelné ztráty v terčíku (anodě) jsou vyšší.
Brzdné X-záření produkované rentgenkou má spojité
spektrum od energií blízkých nule až k maximální
energii dané téměř hodnotou anodového napětí - obr.3.2.1
uprostřed (zde je spektrum po
částečném odfiltrování nejměkčí složky - viz níže). Energie brzdného záření závisí na rychlosti
(zrychlení), s jakou dochází k zabrzdění elektronů při
dopadu na povrch anody. Jednotlivé elektrony proniknou různě
hluboko do atomů materiálu anody, čímž vyzařují různé
vlnové délky, či energie fotonů. Ty elektrony, které se
opakovanými mnohonásobnými rozptyly na vnějších
elektronových slupkách atomů anody "měkce" brzdí,
vysílají řadu fotonů brzdného (i
charakteristického) záření o nízké
energii; některé z nich spadají do oblasti měkkého
X-záření, jiné do oblasti UV a viditelného světla (vznikající nízkoenergetické fotony se často
absorbují v materiálu anody a nevyletí ven). Čím hlouběji elektrony proniknou do nitra atomů
anody, blíže k jádru, tím rychleji se intenzívními
Coulombovskými silami mění vektor jejich rychlosti a tím
tvrdší brzdné X-záření je produkováno. Nejkratší vlnové
délky vznikají u elektronů, které pronikly na úroveň slupky
K a blíže k jádru, kde mohou být zabrzděny téměř
jednorázově. V závislosti na impaktním faktoru jednotlivých
elektronů vůči atomům anody, který je náhodný, se
průběžně realizují všechny možnosti - taková různá
míra brzdění elektronů vyvolává směs záření různých
vlnových délek či energií fotonů - výsledkem je spojité
spektrum brzdného záření. V tomto spojitém spektru
jsou nejvíce zastoupeny fotony X-záření o nízkých
energiích, jen velmi malé procento v koncové části spektra
odpovídá vysokým energiím, blízkým energii dopadajících
elektronů, danou vysokým napětím mezi katodou a anodou
rentgenky (viz níže obr.3.2.5 vpravo
nahoře).
Vlnová
délka a energie X-záření
Svou povahou je rentgenové záření elektromagnetické vlnění
krátké vlnové délky cca 10-9¸10-11m, které se však
vyzařuje jako kvanta - fotony - o energii cca
5keV¸200keV
("Korpuskulárně-vlnový dualismus"). Dříve (asi do 60.let) bylo zvykem
charakterizovat X-záření vlnovou délkou l a ve starší
literatuře se často uváděl tzv. Duanův-Huntův vztah
lmin[nm]
= h.c/e.U @ 1,234/U[kV] mezi
napětím U [v kilovoltech] na rentgence a minimální
vlnovou délkou lmin [v nanometrech] vznikajícího brzdného
X-záření *). A Kramerův vzorec pro spektrum se
uváděl ve tvaru I(l) = K.Z.I.[(l/lmin) - 1]/l2 (v tomto tvaru jej v r.1923
sestavil H.A.Kramers; tehdy se X-záření popisovalo pouze
vlnovou délkou).
Tento způsob byl značně nevýhodný
a zavádějící, zvláště ve vztahu k mechanismu vzniku tohoto
záření, kde vystupují hodnoty urychlujícího napětí v
[kV]. Nyní je již dávno opuštěný, spektrum
X-záření se vyjadřuje zásadně energií fotonů
EX[keV],
která se u rentgenky odvozuje přímo od napětí
U (maximální energie EXmax @ U, střední energie <EX> » U/3] a Duanův-Huntův vztah ztratil důležitost.
*) Je to vlastně jinak zapsaný vztah EX = h/l mezi energií
fotonu EX
v [keV] a vlnovou délkou l v [nm] pro situaci, kdy se veškerá kinetická energie
E = U.e elektronu o náboji e, urychlené napětím U,
přemění ve foton X-záření (odpovídá energii EXmax
a vlnové délce lmin).
Charakteristické
X-záření
Kromě brzdného X-záření se spojitým spektrem je
vyzařováno i určité menší množství charakteristického
X-záření s čárovým spektrem (charakteristická
dvojice píků Ka,Kb), jehož energie nezávisí na anodovém napětí, ale
je dána materiálem anody; pro nejčastěji
používaný wolfram jsou to píky 59,3+67,2keV (a též pík L
kolem 10keV), které se projevují jako "hrbolky" na
spojité křivce spektra (obr.3.2.1 uprostřed).
Charakteristické X-záření vzniká v
důsledku dvou procesů:
¨
Přímý proces impaktního fotoefektu na
vnitřních energetických hladinách elektronového obalu v
atomech materiálu anody - rychlé elektrony pronikají do nitra
atomů a vyrážejí vázané elektrony ze slupek K a L. Při
přeskoku elektronů ze slupky L na uprázdněnou slupku K
(K-série), popř. ze slupky M na L (L-série) se pak rozdíl
energií vyzařuje ve formě fotonů elektromagnetického
záření - chrakteristického X-záření (srov. též s
obr.1.1.3 v §1.1).
¨
Nepřímý proces fotoelektrické absobce brzdného
záření - brzdné X-záření, vznikající shora
zmíněným mechanismem při zabrzdění urychlených elektronů,
interaguje s dalšími atomy uvnitř látky anody m.j. fotonovým
fotoefektem (popsaným v §1.6,
část "Interakce záření gama a X", obr.1.6.3 vlevo),
vyrážejícím elektrony z vnitřních slupek, za následného
přeskoku elektronů a emise charakteristického X-záření,
podobně jako v předchozím případě.
Impaktní elektronový fotoefekt a vyzařování
fotonů nastává i při přeskocích elektronů ve vnějších
slupkách, avšak energie těchto fotonů je nízká a toto
záření je překryto spojitým brzdným zářením na začátku
spektra.
Pro vznik charakteristického X-záření je
potřeba určité minimální (prahové) anodové napětí,
vyšší než je vazbová energie elektronů na K-slupce atomů
materiálu anody (pro wolfram je to cca
70keV, pro molybden 20keV). Pokud je
anodové napětí nižší, vzniká v rentgence pouze spojité
brzdné záření, při překročení prahového napětí
obsahuje spektrum jak brzdné záření, tak píky
charakteristického X-záření.
Zastoupení charakteristického X záření v
celkovém spektru rentgenky závisí na materiálu anody a
anodovém napětí. Pro wolframovou anodu činí při napětí
100kV přibližně 30%, při napětí 200kV již jen cca 3%.
Konstrukční provedení rentgenky
Na rozdíl od běžných elektronek používaných ve
slaboproudé elektronice mají rentgenky poměrně robustní
konstrukci (velikostí se
podobají spíše obrazovkám či vysílacím elektronkám), danou dvěma okolnostmi. Jednak je to značně vysoké
napětí dosahující i stovek kilovoltů. Druhou
okolností je tepelný ohřev: elektrony
dopadající vysokou rychlostí na anodu přeměňují jen malou
část své energie v X-záření, převážná většina jejich
kinetické energie se přeměňuje na teplo -
anoda rentgenky se silně zahřívá. Pro odvod
tohoto tepla musí mít anoda poměrně masívní konstrukci;
navíc se používá rotace anody či jejího chlazení (je popsáno níže). Jedním z
technických parametrů je maximální výkon
rentgenky [kW] - špičkový elektrický příkon elektrického
proudu rentgenkou, který rentgenka ještě "snese"
aniž by se přehřála a tepelně poškodila.
Nejčastěji používaným materiálem
pro anodu rentgenky je wolfram (tungsten),
těžký a tepelně odolný kov. Pro zlepšení tepelných
vlastností anody, především tepelné kapacity, se často
používá wolfram legovaný rheniem (10%), popř. je anoda
složena z více vrstev - legovaného wolframu, molybdenu,
grafitu. U rentgenek pro X-záření kolem 20keV pro mamografii
je anoda z molybdenu.
Rentgenky můžeme rozdělit
do dvou hlavních skupin, kterými se řídí jejich
konstrukční provedení (+ třetí skupina
speciálních konstrukcí uvedených níže) :
¨
Rentgenky pro průmyslové ozařování a
radioterapeutické použití,
u nichž není zapotřebí fokusace elektronů do téměř
bodového ohniska a které mají pevnou (nerotující) anodu.
Častým požadavkem je zde vysoká energie a intenzita
X-záření; anoda bývá aktivně chlazena průtoken chlacího
média jejím vnitřkem.
¨
Rentgenky pro rtg diagnostiku
s fokusací elektronového svazku do ohniska a většinou s
rotující anodou (pro zabránění
lokálnímu přehřívání ohniska).
Níže se budeme zabývat především těmito rentgenkami pro
radiodiagnostiku. Terčíkovým materiálem anody je většinou
wolfram, pro nízké energie X-záření (kolem
20-40keV) se jako terčíkový materiál
anody používá molybden; rentgenka je navíc opatřena
beryliovým výstupním okénkem - viz níže "Rtg
mamografie".
¨
Speciální
druhy rentgenových trubic
Mikroohniskové rentgenky (microfocus X-ray
Tube) mají extrémně malé dopadové ohnisko elektronů na
anodu, řádově pouze mikrometry. Dosahuje se toho tím, že
mezi žhavenou katodou a anodou je umístěna speciální
soustava elektrod (elektronová optika - "objektiv"),
fokusujících elektrony z katody do velmi úzkého paprsku
dopadajícího téměř bodově na terčík-anodu. Poskytují
velmi vysokou ostrost a rozlišovací schopnost zobrazení,
avšak pouze omezený výkon (intenzitu, fluenci) X-záření.
Používají se pro rtg mikroskopii a CT
defektoskopii (viz níže §3.3, část "Radiační
defektoskopie").
Pro speciální účely (především spektrometrické a
mikrorentgenové) se konstruují rentgenky s čelní transmisní
anodou (Target Transmission X-ray Tube), kde
svazek urychlených elektronů dopadá na tenkou čelně
umístěnou anodu, přičemž vznikající X-záření prochází
přes materiál tenké anody na vnější stranu trubice, kde je
využíváno. Může být konstruována i jako shora zmíněná mikrofokusová.
Vedle obvyklých pevně uzavřených (zatavených)
evakuovaných rentgenových trubic se někdy konstruují i tzv. otevřené
rtg lampy. Mají kovový obal, který může uživatel
otevřít, vyměnit podle potřeby žhavicí vlákno katody i
materiál anody (wolfram, měď, molybden a pod.) a trubici opět
zavřít a evakuovat.
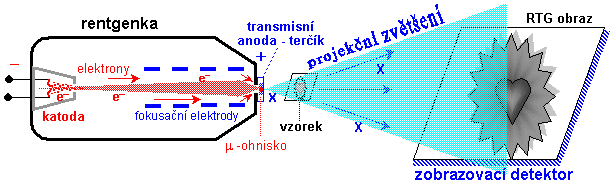
Obr.3.2.2. Speciální mikrofokusová rentgenka s transmisní
anodou pro rentgenovou mikroskopii
Historický
vývoj rentgenových trubic
Rentgenové trubice se prapůvodně vyvinuly z výbojek,
což jsou plynem plněné skleněné trubice s elektrodami, na
něž se přivádí napětí řádově stovky voltů. Další
etapou byly Crookesovy katodové trubice -
výbojky s velmi zředěným plynem, na jejichž elektrody se
přivádí vysoké napětí jednotky až desítky kilovoltů.
Klasický zářivý výboj zde již prakticky nenastává, ale
ionizace atomů zředěného plynu uvolňuje elektrony,
urychlované vysokým napětím směrem k anodě - katodové
záření. Kromě světélkování baňky či
vložených předmětů vzniká přitom i sekundární pronikavé
fotonové záření - X-záření (objevené Röntgenem a nezávisle i jinými badateli), brzdné a charakteristické. Katodové trubice
sehrály důležitou úlohu i v atomové fyzice, s jejich pomocí
objevil J.J.Thomson elektrony, což umožnilo proniknout do
stavby atomů.
První rentgenky se "studenou katodou"
byly vlastně Crookesovy katodové trubice se speciálně
upravenými elektrodami. Důležitým mezníkem bylo vytvoření vakuové
rentgenky se žhavenou katodou, kterou zkonstruoval
W.D.Coolidge v r.1913 (je znázorněna na obr.3.2.1 vlevo).
Později, při zvyšování výkonu, byla u rentgenek pro rtg
zobrazovací diagnostiku doplněna rotace anody
a též další technická zdokonalení a speciální konstrukce
(viz níže). V současné době jsou prováděny experimenty s laserovými
zdroji X-záření - ať již buzení
charakteristického X-záření ve vysokoteplotní plasmě
vytvořené laserovým paprskem, nebo brzdného X-záření při
dopadu urychlených elektronů na terčík. Na okraj můžeme
poznamenat, že za nejkomplikovanější speciální
"rentgenky" (zdroje X-záření) můžeme považovat wigglery
a undulátory elektronových synchrotronů (viz §1.5,
část "Urychlovače nabitých částic").
Fokusace elektronů,
ohnisko
Pro dosažení dobré ostrosti a rozlišení
projekčního stínového transmisního obrazu při rtg
diagnostice je zapotřebí, aby svazek X-záření vycházel z
téměř bodového zdroje. U rentgenek pro rtg
diagnostiku je žhavené vlákno - wolframová
spirálka - zapuštěno v prohlubni či fokusační
štěrbině katody, která má zápornou polaritu,
takže svým odpudivým účinkem shlukuje elektrony do úzkého
proužku *). Elektrony po urychlení vysokým napětím pak
dopadají do poměrně ostře lokalizovaného místa anody - dopadového
ohniska, které má vzhledem k protáhlému tvaru
žhaveného vlákna obdélníkový tvar. Skutečné, optické
ohnisko vznikajícího X-záření je geometrickým
průmětem zářící plošky na anodě, tj. dopadového ohniska,
do roviny kolmé ke svazku záření použitého pro zobrazení.
Původně obdélníkové dopadové ohnisko je v podélném směru
zmenšené vlivem šikmé, sklopené plochy anody; jeho projekce
do směru zobrazení má téměř čtvercový tvar velikosti
zpravidla 0,5-2mm.
*) Klasické rentgenky mají většinou
dvě katodová vlákna - kratší a delší. Přepínáním
žhavícího proudu lze žhavit jedno či druhé vlákno a měnit
tak velikost dopadového ohniska na anodě.
Některé nové rentgenky místo klasického žhaveného
vlákna mají žhavenou katodu řešenu technologií tzv. plochého
emitoru (flat emitter). Je tvořena obdélníčkem
žhaveného tenkého plechu, maskovaného několika otvory.
Nastavením záporného napětí mezi štěrbinou katody a
emitorem lze přesněji dosáhnout velmi ostře lokalizovaného
dopadového ohniska na anodě.
Asymetrie svazku
X-záření z ohniska, heel efekt
V prvním přiblížení je X-záření emitováno z dopadového
ohniska izotropně, se stejnou intenzitou do
všech směrů. Část dopadajících elektronů však pronikne
pod povrch anody a zde vznikající X-záření je částečně
absorbováno a zeslabováno při průchodu materiálem anody.
Vede to ke změně tvaru vyzařovací charakteristiky z terčíku
na anodě, k určité úhlové asymetrii svazku
X-záření vycházejícího ze zkosené anody: pro úhel cca
30° ve směru ke katodě je intenzita záření asi o 5%
vyšší než ve středu (0°), v opačném směru (k disku
anody) pak asi o 15% nižší. Toto tvarování vyzařovací
charakteristiky se někdy označuje jako anodový heel
efekt (anode heel effect), jakýsi "efekt
paty", "zešikmení". Tento jev se může projevit
určitou menší nehomogenitou rtg obrazu,
zvláště při expozicích velkých zobrazovaných polí, nebo
při rtg mamografii. Tato nehomogenita je plynulá a pozvolná,
takže při vizuálním hodnocení nepůsobí rušivě; přesto
však se u digitálního vyhodnocování někdy provádí její
počítačová korekce.
Chlazení a rotace anody
Jak bylo výše zmíněno, naprostá většina (téměř 99%) kinetické energie
elektronů dopadajících na anodu se přeměňuje na teplo.
Toto uvolňované teplo musí být účinně odváděno, aby
nedocházelo k přehřívání anody. Při malých výkonech
stačí pasivní infračervené sálání ze zahřáté anody do
okolí. Rentgenky pro vysoké výkony (bez
ohniska, např. v průmyslovém použití)
mají anodu aktivně chlazenou - uvnitř anody je
dutina, kterou protéká chladící kapalina.
U diagnostických rentgenek dopadají elektrony
do malého ostře lokalizovaného místa anody - dopadového ohniska
- velikosti kolem 1 mm. Při vyšších výkonech se toto
dopadové ohnisko na anodě může silně lokálně
zahřívat. Je nutno zajistit, aby teplota ohniska byla
nižší než bod tání materiálu anody (většinou wolframu).
Lokálnímu přehřívání ohniska, kam dopadají elektrony, lze
zabránit rotací anody*): katoda je v rtg
trubici excentricky umístěna, anoda ve tvaru kuželovitého
disku (o průměru asi 5-10cm) se otáčí kolem
podélné osy, takže elektronový svazek dopadá pokaždé do
jiného místa po obvodu anody, čímž zahřívání a
odvod tepla je rovnoměrnější (obr.3.2.3 vlevo). X-záření
vystupuje sice z téhož místa - ohniska, které je proti
nehybné katodě, avšak toto místo je díky rotaci anody
tvořeno neustále jinou fyzickou částí anodového disku;
teplo se tím lépe rozptyluje v materiálu anody.
*) Rotace
anody
Jelikož anoda se nachází uvnitř trubice s vysokým vakuem,
nelze její rotaci zajistit mechanickým převodem zvenčí.
Žádné ložisko není tak těsné, aby se časem do trubice
nedostal vzduch - došlo by k porušení vakua. Rotace anody je
buzena elektromagneticky: uvnitř anodového
hrdla rentgenky je na ložiscích upevněn kovový váleček
spojený hřídelí s anodou, který slouží jako rotor,
vně rentgenky jsou umístěny cívky napájené střídavým
proudem - ty tvoří stator, budící točivé
magnetické pole, které v důsledku elektromagnetické
indukce (v rotoru se indukují vířivé elektrické proudy)
otáčí válečkem a anodou uvnitř trubice (obr.3.2.3 vlevo). Z
elektro-mechanického hlediska je taková rentgenka vlastně
malý asynchronní elektromotor. Rychlost rotace anody
je zpravidla 50otáček/sekundu (3000ot./min.), u retgenek
vysokých výkonů se používá i 10-12 000 ot./min. Určitým
problémem je opotřebování ložisek, na
nichž je rotor anody ukotven. Tato ložiska jsou značně
mechanicky a tepelně namáhaná, jsou uvnitř evakuovaného
prostoru mimo možnosti údržby a mazání (je používáno jen
"suché" mazání kovovým přáškem stříbra či
olova) - jejich opotřebování bývá hlavním limitujícím
faktorem životnosti rentgenky.
U moderních rentgenek se někdy používá hydrodynamické mazání
ložisek tenkou vrstvičkou vhodného roztaveného
kovu (jakýsi "aqua-planing" hřídele v
tekutém kovu, s minimálním třením). Jedním z vhodných
kovů je galium, které má nízký bod tání cca
130°C a dostatečně vysoký bod varu 2204°C, takže i při
poměrně vysokých teplotách několika set °C nedochází ke
kontaminaci vakua jeho výpary. Takovou mazací kontaktní
plochou v ložisku se dále účinně odvádí teplo z anody.
Před vlastním provozem se po zapnutí přístroje ložisko
nejprve ohřeje a teprve po roztavení mazacího kovu začne
rotace anody, která se pak udržuje nepřetržitě i v době
mimo expozice, až do vypnutí přístroje. Zahřátí ložiska a
udržování potřebné teploty se děje účinkem vířivých
proudů indukovaných v rotoru (jsou to tytéž vířivé proudy,
které svou interakcí s točivým magnetickým polem statoru
pohánějí rotaci anody). K mazání ložiska anody se
používají i speciální tzv. eutektické slitiny
kovů, které jsou kapalné i za normální teploty (např.
galium, indium a cín ve slitině vhodného poměru, s teplotou
tání -10°C).
Rychle rotující masívní anoda se z
mechanického hlediska chová jako setrvačník,
zachovávající svůj vektor rotačního momentu hybnosti. Pokud
se rentgenku s rotující anodou snažíme naklonit (změnit
směr její osy), vlivem gyroskopického efektu
tomu rotující anoda klade odpor a její ložiska jsou
namáhána značnými silami. Dochází k tomu
zvláště u tomografických přístrojů CT, kde rentgenka
poměrně rychle obíhá kolem vyšetřovaného objektu. Proto se
zde někdy používají rentgenky s oboustranným
ukotvením osy anody. Hřídel rotující anody,
procházející skrz celou rentgenku, je uložena v ložiscích
na obou koncích. Katodová část rentgenky pak má dva
výstupky: jeden po straně pro uchycení a napájení
excentricky umístěné katody, druhý uprostřed pro upevnění
druhého ložiska anody. Při oboustranném ukotvení rotační
hřídele anody se gyroskopické síly rozdělí a ložiska jsou
namáhána podstatně méně.
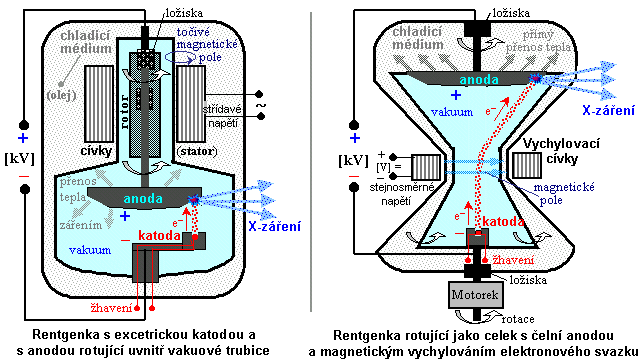
Obr.3.2.3. Konstrukční provedení rentgenových trubic
používaných v radiodiagnostice.
Vlevo: Klasická rentgenka s rotující anodou. Vpravo:
Rentgenka rotující jako celek, s čelní anodou v přímém
styku s olejovou chladicí lázní a s magnetickým
vychylováním elektronů z katody (typ STRATON).
Rotace anody sice zabraňuje lokálnímu
přehřívání dopadového ohniska na anodě, avšak při
delším provozu se anoda silně zahřívá jako celek a toto teplo
se jen pomalu přenáší infračerveným vyzařováním
přes vakuum ven z rentgenky do chladicího média. Mezi
jednotlivými expozicemi je proto třeba dodržet určité
časové prodlevy, aby anoda stačila vychladnout. Další
nevýhodou rotující anody je opotřebování ložiska uvnitř
vakuové baňky, které není možno zvenčí mazat ani jinak
udržovat. Při opotřebování ložiska se kromě toho do
vakuového prostoru rentgenky uvolňují nežádoucí zplodiny.
Rentgenka rotující jako celek
Pro vyšší výkony bylo proto vyvinuto nové konstrukční
uspořádání rentgenky rotující jako celek,
s přímým chlazením anody. Svazek urychlených elektronů z
axiálně umístěné katody, vychýlený magnetickým polem
vychylovacích cívek (umístěných vně trubice) *), dopadá
periferně na protilehlou čelně umístěnou anodu, která je z
vnější strany v přímém kontaktu s
chladicí olejovou lázní, do níž je rentgenka ponořena -
obr.3.2.3 vpravo. Vznikající teplo z dopadového ohniska je tak
tak ihned odváděno pryč. Rentgenka pomocí
motorku rotuje jako celek kolem své podélné
osy spojující katodu se středem anody, přičemž vznikající
X-záření odchází v bočném směru (podobně jako u
klasické trubice Coolidgeova typu). Žhavicí a anodové
napětí je na rentgenku přiváděno pomocí sběrných
prstenců, po nichž kloužou elektrické kartáčky (technologie slip-ring, podobná jako u
elektromotorů na stejnosměrný proud).
Hlavní výhodou této konstrukce je podstatně dokonalejší
chlazení anody, která je v přímém kontaktu s
chladicím médiem, přičemž uvnitř vakuového prostoru nejsou
žádné mechanicky pohyblivé díly. Ložiska, na nichž je
celá rentgenka uchycena, jsou dobře přístupná a mohou být
účinně mazána. Vede to k možnosti dosažení vyššího
výkonu a k podstatnému prodloužení životnosti
rentgenky.
*) Proud vychylovacími cívkami musí být
přesně nastaven v závislosti na urychlovacím anodovém
napětí: čím vyšší napětí [kV] na rentgence je nastaveno,
tím větší proud musí protékat vychylovacími cívkami, aby
elektronový paprsek byl patřičně ohnut a dopadal do
požadovaného místa na okraji anody. Elektronickým řízením
proudu ve vychylovacích cívkách lze tak nastavit požadovanou pozici
dopadového ohniska elektronů na anodě. Regulací
vychylovacího proudu lze definovat i více ohnisek,
které mohou pracovat současně v multiplexním provozu.
Efektivně tím vznikají další projekce ve směru osy
z, částečně se překrývající, ....... ......
Dále, rentgenky této
konstrukce mohou být při stejném nebo vyšším výkonu
podstatně menší a lehčí než klasické
rentgenky s rotující anodou. To je velmi výhodné u nových
technologií vysokorychlostních multi-slice CT
přístrojů, kde je rotační mechanika silně namáhána
odstředivými, gravitačními a gyroskopickými silami. Prvním
typem rentgenky rotující jako celek je Straton
(vyvinutý firmou Siemens v r.2004).
Vysoce výkonné rentgenky s
rotující anodou
Dalším novějším typem rentgenky je Vectron (od stejného výrobce), o
vysokém výkonu - max. anodový proud 1300mA při napětí do
90kV a 800mA při 150kV. Na rozdíl od Straton se vrací k
dřívějšímu Coolidgeovu klasickému provedení pevné
rentgenky s rotující anodou, s mazáním ložisek
pomocí roztavené kovové eutektické slitiny. Anoda
má vysokou tepelnou kapacitu a chladí se infračerveným
sáláním přes vakuum do chladicího média. Místo oleje se
jako chladicí médium používá voda (vodou chlazené jsou i zdroje - generátory - vysokého
napětí), která má vyšší specifickou
tepelnou kapacitou než olej. Katoda je tvořena technologií plochého
emitoru. Má velmi malé ohnisko na anodě 0,4×0,5
mm, nezávislé na nastavení kV, i při vysokém výkonu
rentgenky. Elektronový paprsek se velmi rychle elektronicky
vychyluje (4000-x za sekundu) a v multiplexním režimu vytváří dvě ohniska
(vznikají tím dvě překrývající se
projekce v z-ose).
Vysoce výkonné rentgenky s vysokým rozlišením
dodávají i další výrobci - GE (Performinx HDw), Philips
(iIMRC), Toshiba (Megacool Vi).
Elektrické
napájení rentgenky
Rentgenka, jakžto elektronický zdroj
záření, vyžaduje patřičné elektrické napájení,
dodávající elektrickou energii generující X-záření a
zajišťující další funkce nezbytné pro správný provoz
zařízení. Rentgenka má tři základní zdroje napájení :
¨
Zdroj
žhavicího proudu
pro katodu rentgenky. Je jím žhavicí transformátor,
dodávající na svém sekundárním vinutí nízké napětí
většinou 6-12V a proud v rozmezí cca 0,5-10A, s možností
plynulé regulace (viz níže "Nastavení parametrů
X-záření").
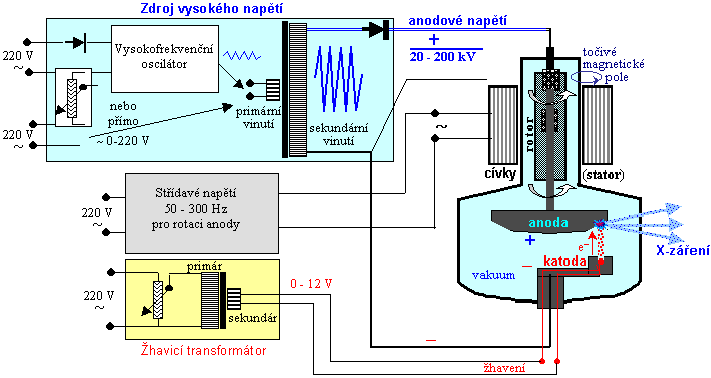
Obr.3.2.4. Elektrické napájení rentgenky
Nahoře: Zdroj vysokého anodového napětí. Uprostřed:
Střídavé napětí pro rotaci anody. Dole: Napětí pro
žhavení katody.
Pozn.: Toto uspořádání
rentgenky pod vysokým napětím, se žhavenou katodou,
rotující anodou a emisí X-záření na "pracovním
stole" předvádím jako experimentální demonstraci.
¨ Zdroj vysokého napětí
- anodového napětí pro urychlování
elektronů v rentgence. Jedná se o napětí v rozmezí
většinou cca 20kV-150kV; u speciálních rentgenek pro
spektrometrické použití může být i nižší, v
průmyslových aplikacích pak až 400kV. Základem tohoto zdroje
(zvaného též generátor) je vysokonapěťový
transformátor, který síťové napětí (220V/380V)
transformuje nahoru - buď přímo ze síťového napětí na
požadovanou hodnotu, nebo nověji přes elektronický
oscilační obvod. Vysokonapěťový transformátor má vysoký
převodový poměr (daný poměrem počtu závitů na
primárním a sekundárním vinutí) řádově 1000 i více.
U novějších přístrojů jsou používány vysokofrekvenční
zdroje vysokého napětí. Síťové napětí se nejprve
usměrní a vyhladí. Tímto stejnosměrným napětím je
napájen vysokofrekvenční oscilátor
(střídač), který pomocí tyristorů vytváří střídavé
napětí frekvence cca 10kHz s ostrými hranami. To je pak ve
vysokonapěťovém transformátoru přeměňováno na vysoké
střídavé napětí, které se dále usměrňuje a vyhlazuje
(viz níže). Výhodou tohoto řešení je, že
vysokofrekvenční transformátor může mít při stejném
výkonu podstatně menší rozměry a hmotnost, než klasický
transformátor s frekvencí 50Hz. Toto řešení
vysokofrekvenčního oscilátoru a transformátoru,
umožňující vysoce efektivní transformaci elektrické energie
- výkonu, proudu, napětí - se v elektronice nazývá invertor.
Hodnota
anodového napětí je regulovatelná buď
plynule, nebo skokově po vhodných krocích. Dosahuje se toho
pomocí autotransformátoru, který je předřazen před
vysokonapěťový transformátor. Autotransformátor reguluje
síťové napětí v rozmezí cca 20-220V, které pak
vysokonapěťová jednotka násobí konstantním poměrem (cca
1:1000). U elektronických vysokofrekvenčních zdrojů se
regulace vysokého napětí provádí pomocí frekvenčního
řízení.
Střídavé vysoké napětí je usměrněno pomocí
vakuových nebo polovodičových diod. Nejjednodušší
usměrnění je jednocestné ("jednopulzní")
pomocí jedné sériově zapojené diody (či
bez usměrnění, usměrňuje rentgenka *), kdy k emisi záření dochází
jen v kladné půlperiodě střídavého proudu.
*) Fakticky samotná rentgenka
je v podstatě dioda, která se sama může postarat o
usměrnění. U starších a jednodušších přístrojů se
proto rentgenka napájela střídavým napětím,
přičemž k emisi X-záření dochází pouze v půlperiodách,
kdy na anodě je kladné napětí. Nevýhodou tohoto řešení je
zvýšený podíl měkké složky záření (vznikajícího na
počátku a konci půlperiody, kdy je podstatně menší
okamžité napětí) a u větších výkonů též možnost
opačného proudu ("zpětný zápal") - v
závěrné půlperiodě se mohou urychlovat sekundární
elektrony, emitované ze zahřátého ohniska anody, směrem ke
katodě, kterou bombardují vysokou kinetickou energií a mohou
ji poškodit.
Dokonalejší bylo usměrnění dvoucestné
("dvoupulzní") pomocí 4 diod v můstkovém Graetzově
zapojení, nebo 2 diod u dvojitého sekundárního vinutí, kdy
na anodě je vždy kladné (pulzující) napětí a rentgenka
pracuje v obou půlperiodách střídavého napětí. Dříve se
někdy využívalo třífázové síťové napájení třífázového
vysokonapěťového transformátoru a k usměrnění se
používá 6 diod v můstkovém zapojení - vzniká jen mírně
pulzující stejnosměrné napětí (které neklesá nikdy k
nule, ale jen asi o 15% vrcholového napětí), pulzace mají
frekvenci 300Hz; označuje se někdy jako šestipulzní
vyhlazení. Třífázový vysokonapěťový transformátor
může mít dvě trojice sekundárních cívek, fázově proti
sobě posunutých o 60°; po usměrnění pomocí 12 diod v
můstkovém zapojení se obdrží již jen nepatrně pulzující
stejnosměrné napětí (s frekvencí 600Hz kolísá jen o asi 4%
- "12-pulzní vyhlazení"), blízké pravému
vyhlazenému stejnosměrnému napětí.
Všechna tato těžkopádná řešení silnoproudé
elektrotechniky jsou zde již opuštěná, používají
se zásadně vysokofrekvenční zdroje vysokého napětí. U
těchto vysokofrekvenčních zdrojů vysokého napětí se po
usměrnění dá velmi dobře provést vyhlazení pomocí
kondenzátorů, čímž se získá minimálně pulzující
stejnosměrné napětí s vysokou frekvencí drobných pulzů.
Hodnota vysokého napětí na rentgence se
vyjadřuje v tisících voltů - kilovoltech [kV].
Pokud se mezi anodu a katodu rentgenky přivádí pulzující
napětí, je maximální energie emitovaného X-záření dána
maximální kladnou hodnotou anodového napětí, která se
vyjadřuje jako [kVp] - "počet kilovoltů
v píku".
¨
Napájení
pro rotaci anody,
což je střídavé napětí (v
nejjdnodušším případě síťové 220/380V), přiváděné na
cívky statoru, vytvářející točivé
magnetické pole pro rotaci anody rentgenky. Při frekvenci
síťového napětí 50Hz je základní frekvence rotace anody
3000ot./sec.; segmentací cívek statoru lze dosáhnout
nižších otáček 1500, 1000, 750, 600 ot./sec. Pro dosažení vyšších
otáček je nutno stator rentgenky napájet z
elektronického oscilátoru, poskytujícího vyšší
frekvenci než 50Hz. Na stator se nejprve přivede vyšší rozběhové
napětí, které se po roztočení sníží asi na 1/3 pro
udržování synchronních otáček. Otáčky anody (rotoru)
mohou být elektronicky monitorovány na základě proudu
protékajícího při daném napětí cívkami statoru při
buzení točivého magnetického pole (po dosažení
synchronních otáček tento proud výrazně poklesne). Teprve po
roztočení anody na požadované otáčky může naběhnout
vysoké anodové napětí a začít expozice. Aby se anoda
rentgenky zbytečně dlouho netočila setrvačností, po
skončení expozice se na příslušné cívky statoru na chvíli
připojí opačná fáze střídavého napětí, čímž točivé
magnetické pole obrátí svůj směr a rotace anody se elektromagneticky
zabrzdí (u některých typů je pro brzdění
instalováno separátní vinutí ve statoru, používá se i
stejnosměrné napájení pro magnetické zabrzdění rotoru).
Výjimkou jsou anody s ložisky mazanými roztaveným kovem
(galiem), které rotují neustále, i v čase mezi expozicemi,
jak bylo popsáno výše.
U
současných rtg přístrojů jsou používány i další
elektronické obvody pro napájení elektromotorků
posuvných a rotačních pohybů, chlazení rentgenky, dále
řídící a regulační elektroniky, včetně detekčních a
vyhodnocovacích obvodů.
Kryt
rentgenky
Při vlastním provozu v rtg přístrojích je rentgenka
zapouzdřena ve speciálním kovovém krytu (z
hliníkových slitin) válcovitého tvaru*). Kryt je zevnitř stíněn
olověným plechem cca 3mm před nežádoucím pronikáním
X-záření do okolí. Na koncích krytu jsou průchodky,
kterými se pomocí dobře izolovaných vysokonapěťových
kabelů přivádí napětí mezi anodu a katodu, na
katodovém konci se pak přivádí nízké žhavicí napětí. Ve
střední části*) krytu je výstupní okénko
(samozřejmě nestíněné, k němuž musí být rentgenka
natočena svým dopadovým ohniskem) z lehkého materiálu,
většinou akrylátového skla, kterým paprsek X-záření
vychází ven k příslušnému použití. U výkonových
rentgenek je prostor mezi rentgenkou a stěnami obalu vyplněn chladicím
médiem - transformátorovým olejem. Olejové
prostředí též zvyšuje elektrickou pevnost obvodů -
zabraňuje elektrickým výbojům vysokého napětí. Pro
eliminaci mechanického namáhání krytu v důsledku teplotní
roztažnosti chladícího oleje je ve vhodném místě
stěny krytu rentgenky zabudovaná gumová dilatační
membrána (zabraňuje např.
prasknutí krytu při přehřátí rentgenky).
*) U rentgenek typu Straton má
pouzdro tvar dvojitého kuželu a výstupní okénko je poblíž
toho konce, kde je anoda. Příslušnou lokalizaci dopadového
ohniska na anodě naproti výstupnímu okénku v krytu
zajišťují vychylovací cívky (vč. úhlu jejich natočení),
umístěné z vnější strany ve zúžené části krytu -
obr.3.2.2 vpravo.
U menších rtg přístrojů
o malém výkonu se někdy používá kompaktní
konstrukce: do společného pouzdra je spolu s
rentgenkou vestavěn i vysokonapěťový transformátor (pro
anodu) s vinutím žhavicího proudu pro katodu. Do takového
kompaktního systému se pak přivádí jen síťové napájení
220V.
Kolimační
a lokalizační systém
Následuje kolimační systém,
sestávající z tubusu s nastavitelnými clonami vymezujícími
geometrický tvar svazku X-záření. Clony se nastavují tak,
aby svazek X-záření pokryl pouze zobrazovanou oblast a nebyly
zbytečně ozařovány další části těla. Pro vizuální
zaměření a nastavení zobrazovaného pole je v
kolimačním systému rentgenky instalován světelný
lokalizační systém - světlo z žárovečky je
optickou projekcí vedeno přes kolimační systém tak, aby bylo
dosaženo shody viditelného světelného pole a pole
X-záření. Před vyšetřením je možno nastavit polohu
zobrazovaného pole na kazetě filmu či zobrazovacím panelu,
jakož i na povrchu těla pacienta.
Mechanické provedení
RTG přístrojů
Kryt s rentgenkou a kolimačním systémem, spolu s protilehlou
filmovou kazetou či zobrazovacím panelem, jsou namontovány na
speciální stojany několika druhů a
konstrukčního provedení, podle požadované metodiky rtg
zobrazení - obr.3.2.5.
Pro skiagrafické snímkování
bývá rentgenka nejčastěji namontována nahoře na svislém
stojanu (sloupový stativ upevněný na podlaze, nebo
stropní závěs) s možností snadného mechanického posuvu.
Filmová kazeta nebo zobrazovací panel je upevněn v dolní
části stojanu, opět s možností posunu. Mezi nimi pak
posuvné lehátko s pacientem pro vyšetření vleže. Pro
snímkování vestoje (popř. vsedě) je rentgenka s kolimačním
systémem natočena horizontálně, protilehlá kazeta nebo
flat-panel je na samostatném vertikálním stojanu (tzv. vertigraf).
Horizontální posun (pojezd) rentgenky může být realizován
pomocí kolejniček, upevněných na stropu nebo
podlaze vyšetřovny. Posuny jednotlivých částí rtg systému
mohou být manuální nebo motorické,
pomocí elektronicky řízených elektromotorků. U nových
systémů bývá realizován tzv. autotracking -
automatické synchronní spřažení posunů zobrazovacího
panelu a rentgenky (opatřené kolimačním systémem). Některé
systémy pro skiagrafii i skiaskopii mají možnost stojan
rentgenky, zobrazovacího panelu, i lehátko pootočit či naklonit
do různých úhlů, od horizontální po svislou polohu
- takový systém se nazývá RTG sklopná stěna
a má široké možnosti využití.
Pro flexibilní skiaskopické
zobrazení bývá rentgenka a protilehlý
zobrazovací detekční systém často namontovány na
speciálním stojanu tvaru písmene "C" - tzv. C-rameno
(C-arm) - obr.3.2.3b., nebo tzv. U-rameno -
obr.3.2.3c. Tato ramena se dají pomocí elektromotorků natáčet
do různých úhlů kolem pacienta, což umožňuje flexibilní
zobrazení v různých projekcích. Tyto systémy (které
bývají někdy mobilní) se používají v širokém spektru
aplikací, jako je digitální subtrakční angiografie
(viz níže DSA - obr.3.2.3), rtg
navigace intervenčních výkonů, afterloading v
radioterapii (viz §3.6, část "Brachyradioterapie" - obr.3.6.7) a další.
Samostatnou kategorií konstrukčních řešení rtg
přístrojů je transmisní rentgenová tomografie CT,
kde rentgenka a protilehlý elektronický detekční systém jsou
upevněny na portálovém rotačním stojanu - gantry
- podrobněji je popsáno níže "Rentgenová tomografie - CT", obr.3.2.4. Sem náleží i speciální
konstrukce rtg zobrazovacích přístrojů, instalovaných
přímo na radioterapeutických ozařovačích
IGRT (viz §3.6, část "Izocentrická radioterapie", obr.3.6.1c) nebo tomoterapie (§3.6,
část "Modulace ozařovacích svazků",
obr.3.6.4a).
Další technické podrobnosti konstrukce RTG přístrojů a
jejich příslušenství již leží mimo rámec tohoto
fyzikálně zaměřeného pojednání.
Stárnutí a poškození
rentgenky
Jako téměř každý přístroj či elektronická součástka, i
rentenky mohou podléhat nepříznivým změnám v důsledku
"stárnutí", zatížení a provoznímu poškození. V
průběhu času dochází k degradaci materiálu, vakua,
optřebení rotačních ložisek. Může nastávat několik
druhů nepříznivých změn vlastností rentenky :
--> "Vypálení" katodového žhavicího
vlákna
Žhavená katoda, poskytující termoemisí elektrony, je
většinou tvořena wolframovým drátkem, který je značně
tepelně odolný (teplota tání je 3400 stupňů). Při
žhavení na vysoké teploty však dochází k pomalému
odpařování wolframu, často nerovnoměrnému, takže v
některých místech se spirálka může značně ztenčit. To
může omezovat životnost katodové spirálky.
--> Porušení
vakua rentenky
Může docházet k drobným netěsnostem mezi
skleněnými a kovovými částmi baňky rentenky, čímž se
během delších časových obdobích postupně může dostávat
vzduch do vakuového prostředí rentgenové trubice. Z kovových
částí, zvláště ze zahřívaných, a z namáhaných
rotačních ložisek anody, se do prostředí rentgenky též
odpařují a uvolňují nežádoucí zplodiny.
--> Lokální
přehřívání dopadového ohniska na anodě
Při vysokých výkonech se dopadové ohnisko může silně lokálně
zahřívat na teploty krátkodobě převyšující teplotu
tání materiálu anody. Vznikají tím drobná mikropoškození,
různé důlky a trhliny. Produkce X-záření pak již není
dokonale homogenní...
--> Opotřebování
rotačních ložisek anody
Vysoká teplota a frekvence otáčení vede k velkému
mechanickému zatížení těchto ložisek. Opotřebení ložisek
vede k větší hlučnosti při provozu rentenky a zhoršení
stability ohniska. Opotřebení může do značné míry
zabránit lubkikace ložisek, u výkonných rentenek se
používá lubrikace pomocí roztavené kovové eutektické
slitiny.
Nastavení parametrů X-záření
Pro optimalizaci rtg diagnostiky je potřeba nastavit vhodné
parametry X-záření. V elektrickém obvodu rentgenky se podle
potřeby regulují a nastavují dva základní elektrické
parametry (třetí je již jen
časový, čtvrtý je realizován mechanickým uspořádáním) :
¨
Anodové napětí U[kV],
což je vysoké napětí přiváděné mezi katodu a anodu,
určuje maximální i střední energii fotonů
výsledného X-záření, jeho "tvrdost". Maximální
energie X-záření v [keV] se číselně prakticky rovná
anodovému napětí U v [kV], střední energie je o něco
vyšší než 1/3 max. energie. Se zvyšujícím se anodovým
napětím se celé spektrum X-záření posunuje směrem k
vyšším energiím (kratším vlnovým
délkám) a zvyšuje se relativní podíl
vyšších energií (tvrdší krátkovlnné
složky).
V
praxi se anodové napětí pohybuje v širokém rozmezí od cca
20kV do 200kV (v závislosti na druhu zobrazovaných struktur), u
průmyslového využití X-záření pak i vyšší.
Pozn.: Energie
- tvrdost - emitovaného X-záření se v
rentgenologické hantýrce často označuje jako "kvalita"
X-záření.
¨
Anodový proud I[mA]
protékající rentgenkou určuje intenzitu
(fluenci) X-záření emitovaného rentgenkou IX. Lze jej nejsnadněji
regulovat změnou žhavení katody - žhavicího
proudu - a tím teploty vlákna katody.
Žhavicí proud lze regulovat jednoduše pomocí reostatu
ve žhavicím obvodu (v obvodu žhavicího
transformátoru), nověji speciálními
elektronickými obvody osazenými tranzistory a tyristory. Při
vyšším žhavení vlákna katody je emitováno více
elektronů, rentgenkou protéká větší proud elektronů a je
vyzařována vyšší intenzita X-záření (viz
však "Volt-ampérová
charakteristika rentenky"). Průměrný proud rentgenkou se pohybuje v rozmezí
jednotek mA až asi 200mA, špičkový proud může být i
podstatně vyšší (v pulzním režimu). Např. u rentgenky s
wolframovou anodou (Z=74) napájenou anodovým napětím U=120kV
při proudu rentgenkou 1mA je emitováno X-záření o intenzitě
IX
přibližně 6.1013 fotonů/s (plyne z přibližného
vztahu pro účinnost produkce brzdného záření, uvedeného
výše v části "Rentgenka",
pasáži "Brzdné X-záření").
¨
Expozice
je celkové množství fotonů X-záření, které určuje
kvalitu rtg snímků a též radiační zátěž pacienta. Je
dána součinem intenzity záření IX (fluence fotonů /s) a expozičního času T - je tedy
úměrná součinu anodového proudu rentgenkou
[mA] a expozičního času [s]:
"miliampér-sekundy" mA.s = Q,
což je celkový náboj Q elektronů neboli elektrické
množství, které při expozici projde rentgenkou (koeficient úměrnosti h je uveden výše v pasáži
"Brzdné X-záření"). Při
Q=1mAs je z anody vyzářeno cca 1013fotonů, z čehož je ovšem pro rtg zobrazení využita
jen malá část - z většiny fotonů letících různými
směry je kolimací vybrán jen poměrně úzký kuželový
svazek, fotony nízkých energií jsou dále odstraněny
filtrací (viz níže).
Pozn.: Energie
X-záření na velikosti proudu, čase, či elektrickém
množství nezávisí.
Pro pořizování běžných skiagrafických
snímků měkkých tkání se používá expozice na rentgence
asi 2¸6
mAs, u skeletu cca 20¸80 mAs, u CT i 200 mAs. U moderních rtg přístrojů,
schopných pracovat v pulzním režimu s vysokým okamžitým
výkonem, se pro dosažení požadované expozice [mAs] dává
přednost vysoké hodnotě proudu [mA] při krátkém
expozičním čase [s] - snižuje se tím riziko rozmazání
snímku pohybem pacienta.
Pro každý druh rtg vyšetření je na
základě empirických zkušeností stanovena doporučená
hodnota anodového napětí [kV] a expozice [mAs], poskytující
kvalitní zobrazení požadovaných struktur, při relativně
nízké radiační zátěži. U některých přístrojů se
používá i expoziční automatika, která po
dosažení určitého předvoleného "množství"
X-záření elektronicky vypne anodové napětí v generátoru -
a tím i expozici. Pro účely automatické expozice je tok
prošlého X-záření monitorován pomocí ionizačních
komůrek umístěných za kazetou s filmem nebo za flat
panelem . U digitálních zobrazovacích detektorů lze k
přerušení expozice použít i předvolbu celkového počtu
impulsů, nastřádaných v digitálním obraze. Podobně funguje
optimalizace expozice u CT přístrojů, kde podle úrovně
signálu z detektorů při předběžném plánovacím
radiografickém zobrazení SPR (topogramu) se mohou automaticky
upravovat optimální hodnoty proudu [mA] při vlastním
diagnostickém skenování - ATCM (Automatic
Tube Current Modulation), viz níže "CT".
Již vzniklé X-záření se následně upravuje filtrací:
¨
Filtrace, kolimace
Měkké X-záření delších vlnových délek a nízké energie
fotonů na začátku spojitého spektra záření z rentgenky
nemá pro diagnostiku žádný význam, absorbuje se většinou
již v kůži a mělkých vrstvách tkáně - způsobuje jen
nežádoucí radiační zátěž pacienta. Proto se odstraňuje
pomocí filtrace - do cesty záření se
vkládá hliníková nebo měděná destička tloušťky cca
1,5-4mm, která měkkou složku X-záření do značné míry
pohltí, zatímco tvrdší složku propouští - viz tvar spekter
na obrázku 3.2.5. Prvotní částečná filtrace vznikajícího
X-záření vzniká již průchodem skrz materiál anody,
skleněnou baňku rentgenky, chladicí olej, materiál krytu a
výstupního okénka (tedy i samotná
skleněná baňka rentgenky působí inherentně jako
částečný filtr, ekvivalentní cca 0,5mm Al; podobně
chladicí olej a okénko krytu rentgenky).
V
některých speciálních případech, kdy potřebujeme
ostřejší a selektivnější filtraci určitých oblastí
energie, se používá tzv. filtrace K-hranou (K-edge
filter). Je založena na výrazně zvýšené ("rezonanční")
absorbci fotonového záření při energii rovné nebo mírně
vyšší než je vazbová energie elektronů na K-slupce atomů
použitého materiálu (viz §1.6, část "Interakce
záření gama a X", obr.1.64).
Kombinací standardního filtru (Al, Cu) a filtru z vhodného
těžšího materiálu s využitím efektu K-hrany
výsledně obdržíme pásmový filtr, vybírající
určitý úsek energií ze spojitého spektra X-záření.
Používá se to zvláště u mamografie, kde
molybdenový nebo rhodiový filtr odřezává fotony vyšších
energií než cca 20-23keV pro dosažení lepšího kontrastu
(viz níže "RTG mamografie"). Dále u metod DEXA
- analýzy absobce s použitím dvou energií X-záření (viz
níže "CT
s 2 rentgenkami - DSCT : Dual Source a Dual Energy CT").
Geometrické vymezení svazku X-záření
se provádí pomocí kolimace (bylo zmíněno výše).

Obr. 3.2.5. Základní schéma RTG vyšetření.
Vlevo: Uspořádání rentgenky, filtru,
DAP-metru, primární a sekundární clony, filmu či detektoru. Vpravo:
Energetická spektra X-záření z rentgenky, po filtraci a po
průchodu pacientem.
Rozptýlené
X-záření
Při interakci X-záření s látkou dochází m.j. k Comptonovu rozptylu
fotonů na volných nebo slabě vázaných elektronech.
Tyto rozptýlené fotony vyletují z tkáně s nižší energií
a v různých směrech. Zastoupení
rozptýleného záření je tím větší, čím je pacient
objemnější (a je rovněž vyšší pro tvrdší X-záření z
rentgenky - vyšší napětí [kV]). Rozptýlené záření zhoršuje
kvalitu rtg obrazu - snižuje jeho kontrast. O možnosti
potlačení rozptýleného záření je zmínka v následujícím
odstavci. Toto Comptonovsky rozptýlené X-záření dále
způsobuje určitou menší radiační zátěž
i mimo vlastní svazek X-záření z rentgenky. Tato radiační
zátěž není vysoká, rozptylové albedo lidského
těla pro X-záření je necelé 1% (albedo
bylo diskutováno v §1.6, část "Interakce
záření při průchodu hmotou"). Ve vzdálenosti 1m činí radiační dávka cca 0,1mGy/1mAs, ve
2metrech již jen cca 0,005mGy/1mAs. Přesto by se radiační pracovníci při RTG
vyšetření neměli při expozici zdržovat ve vyšetřovně,
pokud to není nutné, ale ve stíněné ovládací místnosti -
výjimkou jsou např. intervenční radiologické výkony.
Filtry
a clony u rtg zobrazení
Při praktické diagnostické aplikaci rtg záření je
důležité použití filtrů a kolimačních clon - obr.3.2.5.
Vhodnými primárními clonami se zajišťuje geometrické
vymezení svazku X-záření, zasahujícího jen
potřebnou vyšetřovanou oblast (ostrý obraz s vysokým
prostorovým rozlišením je zajištěn tím, že záření
vychází z téměř bodového ohniska na anodě rentgeny, jak
bylo výše popsáno). Hned za rentgenkou se umísťuje filtr,
zhotovený nejčastěji z hliníkového plechu, který pohlcuje
nízkoenergetické fotony (ze začátku spojitého spektra
X-záření), které nejsou použitelné pro zobrazení (pronikly
by pouze do podkoží), ale zvyšovaly by radiační zátěž
pacienta (bylo zmíněno výše). Následuje tubus s nastavitelnými clonami
pro geometrické vymezení svazku X-záření (velikosti
zníkovaního pole). Na výstupním okénku tubusu bývá
namontována tenká planparalelní ionizační komůrka
pro monitorování expozice X-záření, tzv. DAP metr
(viz níže "Radiační
zátěž při TRG vyšetření"), umožňující stanovit radiační dávku pacienta
při RTG vyšetření - obr.3.2.5 vlevo nahoře.
Mezi
pacientem a filmem (či stínítkem nebo zobrazovacím
detekčním systémem, flat-panelem) se pak umísťuje sekundární
clona. Je to mřížka tvořená
rovnoběžnými či rozbíhavými absorbčními lamelami
(olověnými pásky), které svými mezerami propouštějí pouze
primární X-záření prošlé ve směru původního svazku,
zatímco sekundární Comptonovsky rozptýlené fotony
(pohybující se jinými směry) se pohlcují v přepážkách.
Jedná se tedy o kolimátor, který záření v
primárním směru zeslabuje jen minimálně, zatímco zeslabení
šikmo procházejícího rozptýleného záření je značné.
Kvalita sekundární clony je určena hustotou mřížky
(počet lamel na centimetr) a mřížkovým poměrem
(poměr mezi vzdáleností absorbčních proužků a jejich
výškou). Potlačení sekundárního rozptýleného záření
výrazně zlepšuje kontrast rentgenového
obrazu. Na druhé straně však sekundární clona pohlcuje i
část užitečného X-záření (např. u
Bucky clony zeslabení činí cca 1,8-krát),
takže je třeba zvýšit expozici. Používají se tři typy
sekundárních clon (mřížek):
- Sbíhavá fokusovaná Bucky-Potterova
clona (cca 10 lamel/cm). Bucky
clona má poměrně tlusté přepážky (cca 1mm), které by se
promítaly do rtg obrazu a působily rušivě. Tento rušivý
rastr se eliminuje tím, že během expozice se clona pohybuje,
čímž se její obraz rozmaže a zanikne v celkovém pozadí.
- Paralelní jemná Lysholmova clona
(40-60 lamel/cm).
- Ultrajemná Smithova clona (hustota >100
lamel/cm). Vzhledem k příliš vysoké
absorbci se v praxi nepoužívá.
Terminologická poznámka: V
radiodiagnostice je častým zvykem používat ne příliš
přesný obecný název "clony".
Přesněji se však jedná o kolimátory a o filtry.
Vizualizace a záznam rentgenových obrazů
X-záření, nesoucí po průchodu zobrazovanou
tkání denzitní informace, je pro nás neviditelné,
takže je třeba jej "zviditelnit" či
registrovat pomocí vhodných materiálových a
elektronických metod. Zobrazit toto X-záření lze v zásadě
třemi způsoby :
- Vizuální
pozorování obrazu na luminiscenčním stínítku
Luminiscenční stínítko je destička či fólie, na které je
nanesen vhodný materiál (jako je sirník
zinečnatý, .......), ve kterém při
interakci s ionizujícím X-zářením vzniká světélkování.
Na luminiscenčním stínítku tak můžeme přes X-záření
vidět projekční denzitní obraz. Výhodou tohoto
nejjednoduššího způsobu byla možnost průběžného
dynamického pozorování - skiaskopie. Zásadní
nevýhodou je však nízká citliviost a vysoká
radiační zátěž pacienta i rentgenologa. .......
- Zobrazení na
fotografický film
Ionizující X-záření vyvolává fotochemickou reakci
ve vhodných fotografických materiálech, obsahujících
většinou bromid stříbrný Tato fotografická emulze,
nanesená na povrchu plastové fólie, tvoří fotografický
film, ve kterém dopadající X-záření vytváří
latentní fotografický obraz - je podrobněji popsáno v §2.2
"Fotografická detekce
ionizujícího záření". Po
vyvolání dostáváme negativní denzitní fotografický
obraz v X-záření.
- Snímání
elektronickým zobrazovacím detektorem,
který registruje dopadající X-záření, převádí jej na
elektrické impulsy a po úpravě složitými elektronickými
obvody vytváří v paměti počítače digitální
denzitní obrazy - je podrobněji popsáno níže "Elektronické
zobrazovací detektory X-záření". .........
Zesilovače
a digitální snímače rtg obrazu; nepřímá a přímá
digitalizace
Přímé fotografické zobrazení na rtg film již patří
minulosti a je postupně nahrazováno dokonalejšími
technologiemi. Pro zvýšení citlivosti
snímání rtg obrazu se požívají vhodné metody zesílení
obrazu, nověji pak metody elektronického snímání
obrazu. Je tím umožněno výrazné snížení potřebné
intenzity X-záření a tím radiační dávky pro pacienta,
jakož i snížení nežádoucí expozice pro radiační
pracovníky.
- Zesilovací fólie
Při fotografické skiagrafii jsou k filmu přiloženy zesilovací
luminiscenční fólie, jejichž úkolem je převést
X-záření na světlo, které exponuje fotografický film. Je
tvořena vrstvou luminoforu, rozptýleného v emulzi želatiny
nebo nitrocelulózy. Používá se kalcium-wolframát
(emituje modré světlo), lanthanoxid-bromid (modré
světlo), gadolinium-oxisulfid (zelené světlo), barium-chlorid
(modré světlo)... Film musí být senzibilován na
barvu světla z luminoforu. Je již opuštěné.
- Xeroradiografie,
kdy místo filmu je použita kladně nabitá polovodičová
(selenová) deska. Dopadající fotony X-záření tam
vyvolávají fotoefekt, při němž fotoelektrony lokálně
kompenzují původní kladný náboj - vzniká latentní elektrostatický
obraz; v kopírce jsou pak na různě nabitá místa
desky různě přitahovány práškové částečky barviva,
které se nakonec otiskují na papír kde vzniká viditelný
obraz. Je též opuštěné.
- Paměťové fólie
nahrazují v RTG kazetě film a po expozici zářením
uchovávají latentní elektronový obraz. Citlivá vrstva
většinou obsahuje atomy europia (BaFCl:Eu2+, místo Cl může být jód nebo
brom). Dopadem fotonů X-záření dochází v
citlivé vrstvě fólie k excitaci, z atomů europia se
uvolňují elektrony, které jsou zachyceny v halogenidových
metastabilních hladinách tzv. "elektronových pastí"
- vzniká latentní elektronový obraz. Ke
zviditelnění tohoto latentního obrazu po expozici pak
dochází fotostimulací pomocí laserového
infračerveného paprsku: nastane uvolnění
"uvězněného" elektronu do vodivostního pásma,
načež je elektron zachycen na vzbuzenou hladinu v luminiscenčním
centru, s následnou deexcitací na základní hladinu,
doprovázenou emisí fotonu světla. Toto světlo je
registrováno citlivým fotonásobičem, vzniklé elektrické
impulsy jsou vzorkovány a převáděny analogově-digitálním
převodníkem na digitální obrazovou informaci. Zařízení,
které provádí čtení a digitalizaci latentního obrazu, se
nazývá digitizér - jedná se o nepřímou
digitalizaci RTG obrazu.
- Zesilovače obrazu
Při skiaskopii se obraz na fluorescenčním stínítku ("štítu")
zesiluje speciální obrazovou elektronkou - zesilovačem
obrazu. Světelný obraz, vytvářený dopadem fotonů
X-záření na fluorescenční stínítko vstupního okénka
elektronky, způsobuje svými emitovanými fotony viditelného
světla fotoelektrický jev na přiložené fotokatodě.
Emitované fotoelektrony jsou napětím mezi fotokatodou a anodou
(cca 10-20kV) urychlovány a elektronovou optikou směrovány na
luminiscenční stínítko, kde vytvářejí zmenšený
převrácený obraz, jehož jas je však více než 1000-krát
větší než u obrazu původního. Tento obraz je pak opticky
snímán videokamerou a zobrazován na TV obrazovku či na
monitor počítače. U starších přístrojů se ještě
používá, nové přístroje se již dodávají s digitálními flat-panely.
- Elektronické
zobrazovací detektory - flat panely
Všechny výše uvedené zesilovače obrazu či televizní
snímače jsou jen přechodným technickým řešením. Nové
systémy jsou vybaveny elektronickým digitálním
snímačem obrazu na plochém tzv. flat
panelu, sestávajícím ze scintilátoru
(např. cesium jodid CsI:Tl, nebo na bázi gadolinia Gd2O2S:Tb - GOS; o scintilátorech viz §2.4, část "Scintilátory a jejich vlastnosti") a polovodičového opto-elektronického amorfního
křemíku (a-Si). Detekční panel sestává z velkého
počtu elementů - buněk, pixelů, sestavených
do obrazové matice cca 2000´2000 elementů, i
více. Nejdokonalejšími zobrazovacími detektory jsou polovodičové
pixelové detektory (SPD), viz §2.5 "Polovodičové detektory". Impulsy z jednotlivých elementů detektoru jsou
v multiplexním režimu s pomocí analogově-digitálního
konvertoru (ADC) střádány přímo do paměti počítače -
vytvářejí digitální rtg obraz. Jedině
této technologii tzv. přímé digitalizace
patří budoucnost... - podrobněji bylo popsáno níže v
pasáži "Elektronické zobrazovací
detektory X-záření".
Pozn.: Terminologie "přímá" a "nepřímá"
digitalizace je dočasná a bude brzy
opuštěna: všechny RTG obrazy automaticky budou primárně
digitální (technologií které
se nyní říká "přímá digitalizace").
Elektronické zobrazovací detektory
X-záření
Dřívější zobrazení X-záření pomocí fotografického
filmu nebo luminiscenčního stínítka je nyní nahrazováno elektronickými
zobrazovacími detektory - obr.3.2.6. Výhodou je
podstatně vyšší detekční citlivost a široké možnosti
elektronického a počítačového zpracování obrazů
(digitalizace). Všechny tyto zobrazovací detektory jsou
založeny na moderních technologiích tzv. kvantové
optoelektroniky (fotoniky), využívající
vnitřního či vnějšího fotoefektu k převodu fotonů na
elektrické signály.
¨
Zesilovač
obrazu
V 60.-80.letech se hojně používalo elektronického zobrazení
se zesilovačem obrazu - obr.3.2.6a. Zesilovač
obrazu je speciální vakuová elektronka se dvěma okénky -
vstupním a výstupním. Na vnitřní straně vstupního okénka
je vrstva scintilátoru (většinou cesium-iodidu) a pod ním
teničká kovová vrstva fotokatody. Dopadající X-záření
vyvolává ve vstupní scintilační vrstvě záblesky světla,
které fotoefektem vyrážejí elektrony z fotokatody. Takto
vzniklé elektrony jsou pak přitahovány prstencovými
urychlujícími a fokusačními elektrodami, na něž je
připojeno vysoké kladné napětí (postupně rostoucí až asi
do 30kV na anodě u výstupního scintilátoru). Tento
elektro-optický systém, fungující jako spojná
"elektrická čočka", vrhá elektrony na výstupní
scintilátor (většinou ZnS:Ag), kde urychlené elektrony
vytvářejí intenzívní záblesky. Takto vzniklý zmenšený,
převrácený avšak velmi jasný ("zesílený",
intenzívní) obraz je pak snímám optickou TV videokamerou a
(analogově) zobrazován na TV obrazovce. Nověji pak bylo
používáno snímání digitální CCD kamerou s počítačovým
záznamem obrazu. Zesilovače obrazu či televizní snímače
byly jen přechodným technickým řešením,
budoucnost patří plně digitální snámačům RTG obrazu - flat
panelům.
Obr.3.2.6 Elektronické zobrazovací detektory v RTG diagnostice.
Vlevo: Snímání X-záření pomocí
zesilovače obrazu. Uprostřed: Flat-panel s
nepřímou (scintilační) a přímou (polovodičovou) konverzí
X-záření na elektrický signál. Vpravo:
Prstencově uspořádané detektory CT s rychlými keramickými
scintilátory a fotodiodami.
¨ Flat - panely
Moderními a dokonalejšími elektronickými zobrazovacími
detektory X-záření jsou tzv. flat panely (angl. flat = plochý, plošný), které poskytují signály pro přímý digitální
rtg obraz. Detekční panel sestává z velkého počtu
elementů - buněk, pixelů, sestavených do obrazové
matice cca 2000´2000 obrazových elementů, i více. Úroveň
elektrického signálu z každého obrazového elementu je
úměrná intenzitě, resp. počtu fotonů X-záření,
dopadajících do daného místa flat-panelu. Z elektronických
multiplexních registračních obvodů (multiple
read-out) se obrazový signál přes
ADC vede do obrazové matice počítače, v jejíž jednotlivých
elementech (pixelech) se střádá informace o
intenzitě X-záření z odpovídajícího místa prozařovaného
objektu. Z hlediska způsobu detekce a převodu X-záření na
elektrický signál se konstruují flat-panely dvojího druhu :
- Scintilační
detekce (nepřímá
konverze) ,
kdy fotony X-záření dopadají nejprve na vrstvu scintilační
látky (nejčastěji se používá cesium-jodid CsI:Tl) *), v
níž vzbuzují záblesky viditelného světla (o scintilátorech a jejich použití pro detekci a
spektrometrii ionizujícího záření je podrobně pojednáno v
§2.4 "Scintilační
detekce a spektrometrie záření gama"). Toto scintilační
světlo pak vstupuje do polovodičových fotodiod (jako
polovodičový materiál se používá většinou křemík - a-Si
- amorfní křemík), v nichž se vnitřním fotoefektem
uvolňuje elektrický náboj (elekrony a "díry") a
světlo je takto převáděno na elektrický signál -
obr.3.2.6b. Název "nepřímá konverze" zde
znamená, že X-záření se nejprve ve scintilační vrstvě
přemění na viditelné světlo, které se následně ve
fotodiodách přemění na elektrický signál. Tato konstrukce
flat-panelů je v současné době nejpoužívanější.
*) Scintilační krystaly některých flat
panelů mají "fibrované" provedení. Jsou složeny z
hustě rozložených tenkých kolmých jehliček. Toto provedení
snižuje boční rozptyl světelných scintilací, což vede k
ostřejšímu zobrazení.
ISS technologie
Některé nové typy flat panelů se scintilační konverzí
mají poněkud kuriózní provedení s "opačnou
orientací" vzhledem k obr.3.2.6b: zobrazované X-záření
přichází ze strany vrstvy fotodiod a
odečítacích TFT tranzistorů, touto vrstvou prochází a
dopadá na CsI scintilační krystal. Ke scintilačním
interakcím pak dochází většinou ve vrstvě v blízkosti
fotodiod, čímž se snižuje boční rozptyl scintilací a
zlepšuje rozlišovací schopnost. Toto řešení, označované
jako technologie ISS (Irradiated Side Sampling), je
umožněno elektronickou miniaturizací vrstvy fotodiod a
čtecích obvodů, která je tenká a prakticky
neovlivňuje procházející X-záření.
- Polovodičová detekce (přímá konverze) ,
kde fotony X-záření dopadají rovnou do polovodičových
detektorů (vhodným materiálem je CdTe, CdZnTe - CZT,
příp. křemík pro nižší energie).
Absorbované X-záření vytváří páry elektron-díra,
elektrony v silném elektrickém poli driftují k anodám, kde
vytvářejí krátké elektrické impulsy (cca 10-9 s). Amplituda
těchto impulsů je úměrná energii absorbovaných
rentgenových fotonů. Fotony X tedy svou interakcí uvolňují
elektrické náboje a jsou tak přímo
převáděny na elektrický signál (obecný
princip polovodičových detektorů je uveden v §2.5 "Polovodičové detektory") - obr.3.2.6c. Konstruují
se též v menších rozměrech (řádově
centimetrů - MEDIPIX) s velmi
vysokou hustotou miniaturních obrazových elementů (vysokým
obrazovým rozlišením) a používají se ve speciálních
laboratorních metodách jako je rentgenová mikroskopie
(zmíněná výše) nabo animální RTG zobrazení. Flat panely s
přímou polovodičovou detekcí se v klinické RTG diagnostice
zatím používají jen zřídka, avšak určitě jim patří
budoucnost. Oproti scintilační konverzi mají totiž výrazné
výhody a poskytují nové možnosti v RTG
zobrazování :
Spektrální -
Photon-counting RTG
zobrazení
Během RTG diagnostiky jsou vyšetřovaní tkáně a orgány
prozařovány X-zářením se spojitým spektrem širokého
rozsahu energií - téměř od nuly až do maximální energie,
dané hodnotou vysokého napětí na rentgence. Při scintilační
konverzi se všechny signály z fotodiod
registrují integrálně, bez ohledu na
energii X-fotonů z nichž pocházejí. Včetně elektronického
šumu detekčního systému, který při nízkém toku
X-záření může být dominantní. Přímá polovodičová
detekce však umožňuje nezávislou
registraci jednotlivých fotonů X-záření:
"počítání fotonů" - photon couting.
A následně elektronickou analýzu amplitud těchto
impulsů - provádění spektrometrie
detekovaného X-záření.
Teminologická poznámka:
Místo názvu "photon-counting
imaging", který se vžil v oblasti radiodiagnostiky,
by z fyzikálního hlediska byl výstižnější název "photon-spectrometry
imaging", neboť důležitá je zde
energetická (spektrometrická) analýza fotonů detekovaného
X-záření (spíše než prosté "počítání
fotonů").
Vhodným nastavením dolní diskriminační
hladiny amplitudového analyzátoru (na
hodnotu odpovídající cca 20 keV) lze
úplně odřezat elektronické šumy detektoru.
Získáme tak kontrastní obrazy se sníženým šumem, daným
jen statistickými fluktuacemi detekovaného X-záření.
Umožňuje to snížit dávku záření při zachování dobré
kvality obrazů.
Použitím dvou či několika různých
amplitudových - energetických oken analyzátoru
lze získat obrazy pro různé energie
procházejícího X-záření. Můžeme pak využít materiálově
specifický rozdíl v absorbci X záření různých
energií pro materiálovou - tkáňovou diferenciaci
zobrazovaných struktur, které jinak na konvenčním RTG obrazu
vykazují stejné denzitní zeslabení. Může to být např.
materiálové odlišení složení ledvinových kamenů. Tato
možnost materiálové analýzy v RTG obrazech je podrobněji
diskutována níže v pasáži "Dvou- a
multi-energetické RTG zobrazení. Analýza materiálového
složení.".
Nepříznivé vlivy u spektrometrické photon-counting
detekce
Za optimálních podmínek detektory pro photon-counting mohou
poskytovat lepší separaci energie s menším
překrýváním než u techniky dual energie rentgenky.
Projevují se zde však některé nepříznivé
fyzikálně-elektronické vlivy, které tuto energetickou
separaci snižují. Rentgenové fotony absorbované v okolí
hranic detekčních pixelů mohou být rozděleny - sdíleny -
sousedními buňkami v detektoru. V materiálu detektoru díle
dochází k excitaci a deexcitaci elektronů na K-slupce za emise
fluorescenčních fotonů, které mohou uniknout a být
detekovány v sousednách buňkách. Při vysokých intenzitách
(toku) X-záření se zde dále můlže nepříznivě projevovat mrtvá
doba a pile-up efekt polovodičových detektorů, čímž se
některé signálové impulsy překrývají a nejsou
registrovány samostatně, ale jako jeden impuls. Toto
"sdílení" signálu mezi buňkami, mrtvá doba a
pile-up efekt polovodičových detektorů může zhoršovat
spektrální separaci, prostorové rozlišení a detekční
účinnost.
--------------------------------------------------
Terminologická poznámka: Nepřímou a přímou konverzi X-záření ve flat
panelech nezaměňovat prosím s nepřímou a
přímou digitalizací RTG obrazů! Nemá to s tím nic
společného, jedná se vždy o přímou digitalizaci,
jen s jiným fyzikálně-technologickým provedením.
V obou
případech flat panelů je elektrický signál z fotodiod nebo
polovodičových detektorů snímán speciální maticí
tranzistorů TFT (Thin Film Transistors
- "tenký film tranzistorů"),
implantovaných technologií integrovaných obvodů v tenké
vrstvě na skleněném nosiči. Snímání, tzv. read-out,
probíhá v multiplexním režimu ve směru X a Y - poskytuje souřadnicové
impulsy o poloze místa detekce fotonu rtg záření ve
flat-panelu. Tyto souřadnicové impulsy jsou
analogově-digitálním konvertorem (ADC) převedeny do
digitální formy a střádány do odpovídajících adres
paměti v obrazové matici počítače - vzniká digitální
rentgenový obraz. Přenos obrazových dat do
akvizičního počítače z moderních flat panelů je řešen bezdrátově
pomocí modemů (WiFi).
Elektronické zobrazovací flat-panely se
používají i ve verifikačních a dozimetrických systémech
tzv. obrazem navigované radioterapie s modulovanými svazky
- v izocentrických ozařovačích s lineárním urychlovačem a
v kybernetickém gama-noži (§3.6, část "Isocentrická
radioterapie" a "Stereotaktická
radioterapie SBRT"); označují se někdy
zkratkou EPID (Electronic Portal Image Device).
¨
Detektory
X-záření pro CT
Na podobném principu jako
flat-panely s nepřímou konverzí fungují i nynější
detektory X-záření u CT. Jsou tvořeny velkým počtem
půlkruhově uspořádaných elementů, z nichž každý je
tvořen drobným scintilačním krystalem (nyní
se používají scintilátory na bázi oxidů křemíku
legovaných vzácnými zeminami, např. luteciem a ytriem - LYSO,
nebo oxisulfidem gadolinia, s velmi krátkým trváním
záblesku), opticky spojeným s fotodiodou; viz níže "Rentgenová tomografie - CT", pasáž "Detektory X-záření pro CT".
Místo
scintilačních detektorů se postupně zavádějí polovodičové
detektory, které fotony X-záření převádějí přímo
na elektrické signály. Tato metoda, zvaná photon-couting
CT, poskytuje kvalitnější obrazy s nižším šumem a
možností spektrometrické analýzy....
Vlastnosti
elektronických detektorů X-záření
Důležitou charakteristikou elektronických zobrazovacích
detektorů je rozlišovací schopnost, což je
nejmenší vzdálenost dvou "bodových" objektů, při
níž se tyto ještě zobrazí jako dvě oddělené struktury;
nebo ekvivalentně jako pološířka profilu obrazu bodového
objektu. Při menší vzdálenosti se již oba objekty zobrazí
jako jeden, nejsou rozlišeny. Rozlišovací schopnost je dána
především velikostí jednotlivého pixelu detektoru (tím je
limitován nejmenší možný bod, který je možno zobrazit),
dále je ovlivněna rozptylem X-záření a světla v detektoru a
procesy přeměny X-záření na elektrický signál. Podobně
jako ve fotografii se rozlišení často měří v maximálním počtu
čar na milimetr [lp/mm], které lze ještě rozlišit.
Moderní flat-panely dosahují teoreticky až 10 lp/mm, což
odpovídá rozlišení 0,1mm; v praxi se však reálné
rozlišení pohybuje kolem 2-5 lp/mm. Kvalita RTG zobrazení z
hlediska reálného rozlišení se někdy podrobně kvantifikuje
pomocí tzv. modulační přenosové funkce MTF,
udávající pomocí Fourierovské harmonické analýzy,
jaké podrobnosti zkoumaného objektu lze s daným kontrastem
zobrazit.
Dalším důležitým parametrem elektronických
detektorů X-záření je citlivost senzoru.
Udává se číselně pomocí detekční kvantové
účinnosti DQE (Detection Quantum Efficiency),
což je procentuální množství fotonů X-záření dopadlých
na detektor, které je skutečně detektorem zaznamenáno a
využito k tvorbě snímku (zbytek je neužitečně pohlcen
vstupním okénkem či materiálem detektoru bez scintilační
či elektrické odezvy).
Elektronické zobrazovací detektory umožňují
detailnější analýzu jemných struktur pomocí zvětšených
výřezů obrazu - tzv. "zoom" či
"magnification". U zesilovačů obrazu se
jedná o analogový zoom (dosažený změnou napětí),
kdy se na celý obraz na výstupu "roztáhne" menší
část vstupní plochy. U flat panelu se jedná o digitální
zoom - dodatečné softwarové přiblížení vybrané
části obrazu, beze změny rozlišení. Pokud chceme na
zvětšeném obrazu zachovat vysokou kvalitu zobrazení (dodržet
stejný poměr signál/šum jako na základním obraze), je
třeba zvýšit množství dopadajících fotonů, čímž se
zvýší i dávka. Digitální RTG systémy, především CT,
jsou vybaveny softwarem poskytujícím řadu dalších možností
počítačových úprav obrazů - post-processing.
Dvou-
a multi-energetické RTG zobrazení. Analýza materiálového
složení.
Různé tkáně a orgány se liší svým chemickým
složením, což se může, ale nemusí,
odrážet v jejich různých hustotách. Pokud mají dvě
sousední struktury v organismu stejný nebo blízký absorbční
koeficient (lineární součinitel
zeslabení) pro použité X-záření, na
RTG obrazech budou od sebe nerozlišitelné - budou se
jevit jako identické, i v případě když jejich
materiálové (chemické, prvkové) složení bude výrazně
odlišné. Diferenciace či klasifikace různých typů tkání
standardním RTG zobrazením je zde tedy velmi obtížná a
často nemožná. Standardní RTG diagnostika, pomocí
X-záření z rentgenky se spojitým spektrem, je v zásadě jen
anatomicko-morfologická, denzitní, nikoli
funkčně-fyziologická.
Určitou možností aspoň částečného rozlišení
materiálového složení zobrazovaných struktur je
měření - zobrazení při různých energiích
X-záření - spektrometrie X-záření. Použitím
dvou či několika různých energetických oken
lze získat obrazy pro různé energie
procházejícího X-záření. Můžeme pak využít materiálově
specifický rozdíl v absorbci X záření různých
energií pro materiálovou - tkáňovou diferenciaci
zobrazovaných struktur, které jinak na konvenčním RTG obrazu
vykazují stejné denzitní zeslabení. Toto by
mohlo do určité míry, v některých případech, překonávat
tradiční omezení RTG diagnostiky na pouhou denzitní
morfologii..?..
Různé druhy látek (a tkání) se liší nejen
konkrétními hodnotami lineárních součinitelů zeslabení m pro záření X
určité energie, ale i poněkud rozdílnou závislostí
m(EX) absorbce pro různé
energie EX záření X. Je to v důsledku rozdílné konfigurace
elektronové hustoty u různého atomovího a molekulárního
složení analyzované látky. Pro X-záření energií
používaných v RTG diagnostice (cca
20-150 keV) probíhá interakce s tkání fotoeektem
a Comptonovým rozptylem - §1.6 "Ionizující
záření", část "Interakce záření gama a X",
obr.1.6.3. Pro účinný průřez fotoefektu platí přibližná
závislost s(EX) ~ Z5/EX 3, kde EX je energie fotonů
X-záření a Z je protonové - atomové -
číslo atomu látky (absorpce Comptonovým
rozptylem je jen málo závislá na energii EX). Pro průchod
X-záření látkou hustoty r bude lineární absorpční koeficient m(EX,r) ~ r. Zef
4 /EX
3, kde Zef je průměrné - "efektivní
atomové číslo" této prozařované látky.
Matematickou analýzou exponenciálních zákonů
absorpce I = Io.e-m(Ex).d
pro jednotlivé energie EX a druhy tkání s absorbčními koeficienty m(EX) (logaritmováním se příslušné exponenciální
rovnice převádějí na lineární) lze
stanovit podíl absorpce v různých tkáních s různým
efektivním atomovým číslem. Tuto schopnost dvou- a
více-energetického RTG zobrazení rozlišovat materiály
různých efektivních atomových čísel lze v principu využít
pro dodatečné rozlišení různých druhů a složení
tkání na základě diferencí v denzitních obrazech
téhož místa, získaných s různými energiemi záření EX. Tato metoda diferenciální
densitní analýzy DEXA (Dual Energy X-ray
Absorptiometry) je podobná jako se používá densitních
obrazů v "Kostní
densitometrii" (viz níže obr.3.2.11).
Poskytuje to nejen detailnější snímky anatomie, ale v
některých případech to umožní rozlišovat různé
druhy tkáně (odlišit např. kosti, cévy, tkáň
tukovou), různé druhy ledvinových kamenů, usazování
krystalků urátu sodného v kloubech (dna), či kvantifikovat
podrobněji distribuci kontrastní látky v myokardu .
Virtuální RTG obrazy
Pozoruhodným přínosem dvou- a více-energetického RTG
zobrazení je možnost cíleně z obrazů odečítat
- potlačovat, odstraňovat - struktury
určitého materiálového složení: vytvářet
virtuální obrazy, na nichž jsou odstraněny
určité význačné struktury, které mohou působit rušivě a
překrývat některé jiné důležité detaily. Rozdíly v
atomovém čísle umožňují vápník a jód odlišit
pomocí techniky duálně energetického zobrazení. Je to např.
identifikace a odstraňování obrazu kostí, což zlepšuje
přímou vizualizaci cév s jódovou kontrastní látkou.
Podobným způsobem lze identifikovat a odstranit obrazy
kalcifikovaných plaků (které zakrývají
lumen cévy) uvnitř cév z obrazů v CT v
angiografii s kontrastní látkou, což umožňuje jasnější
vizualizaci průchodnosti cév a oblastí stenóz. Nebo
vytvářet virtuální obrazy s odstraněním jódu, aby
se daly jasněji posuzovat pod ním ležící měkké tkáně,
nebo lépe vizualizovat drobnější ledvinové konkrementy (které by přítomnost jódové kontrastní látky
mohla přehlušit).
 |
Angiografický snímek úseku aorty Nahoře:
Kalcifikované plaky v několika místech stenózy
zakrývají lumen cévy.
Dole: V
2-energetické analýze lze identifikovat a odečíst
zvápenatělé plaky, což poskytuje jasnější
vizualizaci průchodnosti cév v oblasti stenóz
(vyznačeno šipkami).
! nahradit naším
obrázkem !(angiografické snímky
pořídil MUDr. .... z Radiodiagnostického ústavu FN
Ostrava)
|
Realizace dvou- a více-energetického
RTG zobrazení
Duální nebo multi-energetické RTG zobrazení lze technicky
uskutečnit v zásadě čtyřmi alternativními metodami :
Na úrovni zdrojů :
-> Použití dvou rentgenových trubic
s různými anodovými napětími. To je popsáno níže v
pasáži "CT s 2 rentgenkami - DSCT : Dual
Source a Dual Energy CT", obr.3.2.9.
-> Použití jedné
rentgenky, jejíž anodové napětí se elektronicky přepíná
mezi nízkou hodnotou (cca 50 kV) a vysokou hodnotou (cca 120
kV). Je žádoucí aby toto přepínání bylo dostatečně
rychlé, aby při zobrazování mezi jednotlivými energiemi
nedocházelo k pohybovým změnám (při
použití v CT se doporučuje v řádu milisekund).
Na úrovni detektorů :
-> 2-vrstvový detektor s jednou
rentgenkou s vyšším napětím, cca 120 kV, při použití dvou
vrstev detektorů selektivně detekujících nízko- a
vysokoenergetickou složku X-záření (je zmíněno v odstavci
"Detektory X-záření pro CT", pasáži "Dvouvrstvové
detektory CT".
-> Spektrometrické
Photon-couting RTG zobrazení s jednou rentgenkou a polovodičovými
detektory, umožňujícími flexibilní energetickou
spektrometrii detekovaného X-záření (je popsáno v
pasáži "Elektronické zobrazovací detektory
X-záření", odstavci "Polovodičová detekce (přímá konverze)"
a "Detektory X-záření pro CT"). Tento způsob je z fyzikálního hlediska nejdokonalejší,
poskytuje multienergetické zobrazení.
Fyzikálně-technickými
aspekty těchto metod se zabýváme v pasážích "Elektronické
zobrazovací detektory X-záření"
- "Spektrometrické
Photon-counting RTG zobrazení",
"Detektory
X-záření pro CT"
a "CT s 2 rentgenkami - DSCT : Dual Source a Dual
Energy CT".
Rtg
zobrazení planární - skiagrafie, skiaskopie
Projekce
u rtg zobrazení
Lidský organismus je složitou soustavou velkého počtu různě
uspořádaných tkání, orgánů, kostí, tělesných dutin atd.
Při rtg prozařování se tyto jednotlivé struktury mohou
vzájemně "zastiňovat" a překrývat
- to může bránit jejich dobrému zobrazení a rozpoznání
případných anomálií. Tato interference a překrývání
zobrazovaných struktur podstatně závisí na úhlu
prozařovacího paprsku. Zpravidla je možno najít takový úhel
projekce, pro který je daná léze zobrazena nejlépe,
bez rušení okolními strukturami. Na základě dlouholetých
zkušeností rentgenologů jsou pro planární rtg vyšetření
každého orgánu či oblasti předepsány určité
projekce, které zajišťují nejlepší zobrazení -
např. projekce předozadní AP (anterior-posterior),
zadopřední PA, bočné projekce levé LL (latero-laterální,
též SIN-sinister) či pravé RL (right-lateral, též
DX-dextrum), šikmé projekce levé LAO (left anterior oblique),
LPO (left posterior oblique), nebo pravé RPO, RAO a další projekce a speciální polohy. Problém
překrývajících se struktur je do značné míry odstraněn u
rtg tomografie CT - viz níže "Rentgenová tomografie - CT", která poskytuje zobrazení z různých úhlů a
projekcí.
Z hlediska
provedení a zpracování rtg obrazů se planární rentgenová
diagnostika dělí na dvě skupiny :
¨
Skiagrafie
Při prostém rtg snímkování, zvaném skiagrafie,
dopadá X-záření, prošlé vyšetřovanou tkání, na fotografický
film obsahující halogenidy stříbra (bromid
stříbrný), v němž fotochemickou reakcí
dochází k uvolňování stříbra z jeho vazby ve sloučenině
- vzniká latentní obraz, který je při vyvolání
ve vývojce zviditelněn pomocí hustoty zrníček koloidního
stříbra; zbylý bromid stříbra se rozpustí v ustalovači.
Hustota zčernání filmu je úměrná množství prošlého
X-záření. Vzniklý rtg fotografický obraz
představuje negativní zobrazení hustoty tkáně:
místa s nízkou hustotou (měkké tkáně) mají nižší
absorbci a proto vysoké zčernání, místa s vysokou densitou
(např. kosti) více absorbují X-záření a jsou proto na filmu
zobrazena světle (s nízkým zčernáním).
Pro rtg snímkování se používají speciální filmy,
jejichž emulze je tlustší a obsahuje zvýšený obsah
halogenidů stříbra ve srovnání s běžnými fotografickými
materiály *). Filmy se vyrábějí v různých velikostech -
nejmenší políčka cca 2x2cm se používají při zubní rtg
diagnostice, největší formáty cca 43x43cm při snímkování
plic, popř. 96x20cm na páteř. Při vlastním snímkování
jsou filmy uloženy ve speciální světlotěsné kazetě,
opatřené při okraji kovovými značkami a písmeny, které se
při expozici promítají na film, po vyvolání jsou viditelné
a zajišťují geometrickou orientaci a identifikaci snímku. V
temné komoře se pak vyjímají z kazet, k vyvolání se
používá speciálních koncentrovaných vývojek,
poskytujících vysoký kontrast a sytost
zčernání filmu; proces vyvolávání, ustalování a sušení
se provádí ve vyvolávacích automatech. Celkově však je
použití filmů a "mokrého procesu" na ústupu,
budoucnost patří elektronickému snímání a digitalizaci
rtg obrazů (viz níže). V souvislosti s tím se u moderních
digitálních přístrojů rozdíl mezi skiagrafií a skiaskopií
do značné míry stírá - v počítačovém systému lze volit,
zda záznam digitálního obrazu bude statický či dynamický.
*) Fotochemická citlivost filmů je pro
X-záření poměrně nízká. Pro zvýšení citlivosti (a tím
snížení potřebného množství fotonů X-záření -
snížení radiační zátěže pacienta) jsou k filmu
předřazeny zesilovací luminiscenční fólie, viz
níže.
¨
Skiaskopie
Jako skiaskopie či fluoroskopie
se označuje průběžné vizuální pozorování
obrazu prošlého rtg záření, původně na fluorescenčním stínítku
("štítě"). Přímá skiaskopie se
dříve využívala velmi často, avšak vzhledem k vysoké
radiační zátěži vyšetřujícího rentgenologa (a též
pacienta) se od ní již ustoupilo. Nepřímá skiaskopie
se provádí na přístrojích vybavených zesilovačem obrazu a
elektronickým snímáním obrazu, nověji přímým
elektronickým digitálním snímáním obrazu (viz níže). Tato
nepřímá skiaskopie se nyní používá k vyšetřování dynamických
dějů (koronární arteriografie, transhepatální
cholangiografie, ...) a při intervenčních výkonech,
kde je potřebná vizuální kontrola - RTG navigace precizních
prací prováděných uvnitř organismu *) - zavádění
různých sond a katetrů, implantace kardiostimulátorů,
koronární angioplastika, zavádění stentů cévních či
uterorenálních,... atd. - viz níže "Subtrakční
angiografie", obr.3.2.7. V radioterapii je to zavádění
radioforů afterloadingem při brachyterapii (viz §3.6, část "Brachyradioterapie").
*) Pro snížení radiační
zátěže se při skiaskopickém zobrazování nyní
používá pulsní režim: rentgenka nezáří
kontinuálně, ale periodicky se zapíná jen na krátké
okamžiky (cca 0,1 sec. s opakovací frekvencí cca 4
snímky/sec.)., během nichž se vytváří obraz. Pro vizuální
zlepšení kvality takto vytvářených sekvenčních snímků se
někdy používá tzv. rekurzívní filtrace,
spočívající ve váženém sčítání několika po sobě
jdoucích obrazů. . ....
Rentgenka a protilehlý
zobrazovací detekční systém bývají často namontovány na
speciálním stojanu tvaru písmene "C" - tzv. C-rameno
(C-arm) - obr.3.2.7b. Toto rameno se dá pomocí
elektromotorků natáčet do různých úhlů,
což umožňuje kvalitní zobrazení v různých projekcích.
Ještě flexibilnější možnosti pohybů rentgenky a
zobrazovacího detektoru kolem pacienta poskytuje tzv. U-rameno
(nezávislý posun rentgenky a detektoru na
stojanu) - obr.3.2.7c. Případně lze
využít tzv. sklopné stěny; tyto
možnosti byly zmíněny výše, pasáž "Mechanické
provedení RTG přístrojů".
Kontrastní
látky. Subtrakční radiografie.
Jednou z hlavních obtíží při rtg zobrazování měkkých
tkání jsou malé rozdíly v absorbci X-záření jednotlivými
tkáněmi *), vedoucí k nízkému kontrastu
zobrazení a obtížnosti rozlišení některých struktur.
*) Tkáně lidského těla jsou tvořeny
především atomy lehkých prvků (vodík,
uhlík, kyslík, dusík, sodík, ...) a mají podobnou hustotu
něco přes 1g/cm3. Proto se valně neliší ani absorbční koeficienty
pro X-záření v jednotlivých tkáních (výjimkou jsou
masívnější kosti a lehčí provzdušněné plíce).
V určitých případech lze přirozené absorbční rozdíly
mezi tkáněmi zvýšit a zlepšit tak výsledný kontrast RTG
obrazu aplikací vhodných kontrastních látek.
Kontrastní látky uměle zvyšují kontrast zobrazení tkání
tím, že vyvolávají větší rozdíly v absorbci X-záření
vyšetřované tkáně vůči okolí. Většinou se snažíme
zvýšit absorbci X-záření použitím látek obsahující
atomy těžkých prvků jako je baryum (dutiny, např. žaludek) nebo
jód (cévy, orgány).
X-záření je těmito látkami silně pohlcováno,
čímž se zvýrazní dutiny, které jsou jimi
zaplněny (žaludek, trávicí trakt,
cévy). Vpravíme-li takovou látku do
vyšetřovaného místa - zažívacího traktu, cév,
žlučových či močových cest, vykazuje takto naplněná
struktura výrazně zvýšenou absorbci
X-záření a na rtg obraze je zřetelně a kontrastně
zobrazena, včetně případných defektů a anomálií.
Po aplikaci se kontrastní látky mohou dostat do
vyšetřovaného orgánu buď přímo (přímá
aplikace do trávicí trubice nebo do cév), nebo nepřímo
přes metabolismus (zobrazení struktur v
játrech nebo levinách).
Kontrastní látky se třídí podle
různých kritérií. Podle rozpustnosti ve vodě: nerozpustné
(baryová suspenze, jódové látky olejové a suspenzní) a rozpustné
(hydrosolubilní). Podle jejich ionizace (disociace) v
roztoku: ionické (disociují v roztoku na anion
nesoucí kontrastní jód a kation) a neionické.
Podle farmakokinetiky, metabolismu v organismu a způsobu
vylučování: nefrotropní (vylučované
ledvinami) používané pro angiografii, urografii, kontrastní
CT; hepatotropní (vylučované játry a
žlučí) pro cholangiografii. Z hlediska dosažené změny absorbce X-záření
dělíme kontrastní látky do dvou základních typů:
¨
Pozitivní
kontrastní látky, které
zvyšují absorbci X-záření. Nejčastěji jsou používané
kontrastní látky na bázi barya a jódu.
Síran barnatý (BaSO4) je ve vodě nerozpustná sloučenina, jejíž suspenze
("baryová kaše") se používá při vyšetření
trávicího traktu.
V současné době jsou nejčastěji používané kontrastní
látky na bázi jódu, který má dvě
výhodné vlastnosti:
1. 127I
vykazuje vysokou absorbci pro X-záření o energiích
používaných v RTG diagnostice - poskytuje dobrý pozitivní
kontrast struktur, do nichž se dostane.
2. Jód může vytvářet sloučeniny s řadou organických
látek, které se v organismu chovají potřebným dobře
definovaným způsobem. V takové organické látce jsou
absorbční vlastnosti pro X-záření dány navázanými atomy
jódu, zatímco ostatní organická část molekuly určuje
farmakokinetiku a distribuci látky v organismu - kam se látka
"dostane" či kde se vychytá, jakým způsobem se bude
z organismu vylučovat.
Jódové kontrastní látky se používají ve formě
organických sloučenin, v nichž je jód pevně vázán,
většinou v benzenových jádrech cyklických (aromatických)
uhlovodíků. Je to především kyselina
trijódaminobenzoová, kde jsou na benzenové jádro
navázány 3 atomy jódu (deriváty
1,3,5-trijód-2-aminobenzoové kyseliny, bývají ionické
i neionické). Dále se
používají deriváty pyridinu s jedním nebo dvěma
navázanými atomy jódu v molekule (většinou
mají charakter ionických látek).
Ve vodě
rozpustné (hydrosolubilní) kontrastní látky, zvláště
ionické, mohou v organismu vyvolávat některé nežádoucí
vedlejší účinky, nebezpečné mohou být alergické
reakce.
¨
Negativní
kontrastní látky snižující
absorbci X-záření. Jsou to především plyny (vzduch, oxid
uhličitý), které se aplikují do dutin (např. páteřní
kanálek). Dnes se již prakticky nepoužívají.
V některých případech, zvláště u zažívacího traktu, se
používá tzv. dvojitý kontrast: nejprve se
aplikuje pozitivní kontrastní látka (baryová suspenze) a
potom negativní kontrastní látka - vzduch (z šumivého
prášku), který roztáhne pozitivní kontrastní látku ke
stěnám vyšetřovaného objemu.
Rtg subtrakční radiografie. DSA
Speciální metodou zvýšení kontrastu je tzv. subtrakční
radiografie, spočívající v odečtení
dvou snímků téže oblasti, lišících se přítomností a
nepřítomností, či rozložením, kontrastní látky. Cílem
subtrakce je zvýraznit anatomické struktury,
které by na konvenčních rtg snímcích byly málo zřetelné,
nevýrazné a těžko rozpoznatelné.
V prvopočátcích metody (50. a 60. léta) se používala filmová
(fotografická) subtrakce, při níž se rtg
snímek s kontrastní látkou zkombinoval a překryl s negativně
přefotografovaným snímkem bez kontrastní látky. Touto
kombinací (maskováním) vznikl výsledný subtrakční obraz,
na němž jsou vidět jen struktury naplněné kontrastní
látkou. Další technický vývoj, vedoucí přes analogovou televizní
subtrakci, vyústil v metodu digitální subtrakce,
která je nejdokonalejší a nyní výhradně používaná. Tato
metoda se používá především pro selektivní zobrazení cévního
řečiště arteriálního i venózního - kontrastní
látka se tam ve vhodném okamžiku vstřikuje pomocí
speciálně zavedeného katetru. Označuje se názvem digitální
subtrakční angiografie (DSA) pro arteriální
řečiště, či flebografie pro venózní
zobrazení.
Obr.3.2.7. a) Principiální schéma činnosti
digitální subtrakční radiografie. b) Rtg
přístroj s elektronickým snímačem obrazu upevněný na
C-rameně . c) Rtg přístroj v uspořádání
U-ramena.
Zjednodušené schéma principu digitální
subtrakční radiografie je nakresleno na obr.3.2.7a. Svazek
X-záření z rentgenky prozařuje tělo pacienta a prošlé
záření je detekováno digitálním snímačem obrazu
(flat-panel), složeným ze scintilátoru a citlivého
CCD snímače obrazu. Nejdokonalejšími zobrazovacími detektory
jsou polovodičové pixelové detektory SPD (viz §2.5 "Polovodičové detektory"), montované do tzv. flat
panelů popsaných výše v pasáži "Elektronické
zobrazovací detektory X-záření",
obr.3.2.6 uprostřed. Rentgenka a detektor jsou umístěny
naproti sobě na tzv. C-rameni (obr.3.2.7b). Do paměti
počítače je snímán nejprve nativní rtg obraz
vyšetřovaného místa bez kontrastní látky (dříve nazývaný maska),
a pak rtg obraz po aplikaci kontrastní látky. Numerickým digitálním
odečtením nativního obrazu od obrazu s kontrastní
látkou se odečtou a vyruší všechny struktury které se
nezměnily (např. skelet) a zůstává pouze to, čím se oba
snímky liší: kontrastní látkou naplněné
dutiny a cévy. Vzniká tak výsledný subtrakční obraz,
na němž je selektivně zobrazena jen struktura naplněná
kontrastní látkou, zatímco všechny ostatní anatomické
struktury se víceméně vyruší.
Správnou subtrakci mohou nepříznivě
ovlivnit či znehodnotit pohyby tkáně během
vyšetření (v časovém intervalu mezi oběma obrazy), jako
jsou dýchací pohyby, srdeční pulzace, pohnutí pacienta. Pro
eliminaci těchto nepříznivých vlivů se zaznamenává řada
obrazů v krátkých časových intervalech, z nichž se
vybírají obrazy vhodné pro subtrakci. Pro sledování kinetiky
srdeční činnosti se sekvence snímaných obrazů navíc
synchronizuje se signálem EKG a subtrahují se obrazy
odpovídající end-diastole a end-systole; lze tak m.j. získat
obraz ejekční frakce a odhalit příp. poruchy motility
srdečních stěn.
Tomografická 3D
digitální rotační angiografie
Pokud se angiografie provádí na C-rameni, pak
otáčením systému rentgenka-detektor kolem pacienta lze
pořídit a zrekonstruovat con-beam CT zobrazení -
tomografickou 3D digitální rotační angiografii,
s možností flexibilního prostorového posuzování
průchodnosti cév v různých místech vyšetřované oblasti.
Historický název "angiolinka"
Často používaný náze "angiolinka"
pochází z doby, kdy se angiografie prováděla na rentgenové
filmy (60.-70. léta). Tehdy se musela u skiagrafického
přístroje připravit série - linka - kazet s
RTG filmy v řadě za sebou, které se po nástřiku kontrastní
látky v rychlém sledu vyměňovaly a exponovaly. Pak se
vyvolaly a prohlíželo se, kam se kontrastní látka postupně
dostala - či nedostala v důsledku uzávěru cévy.
RTG navigované
intervenční výkony
Subtrakční angiografie původně vznikla jako diagnostická
metoda. S pomocí moderních angiografických zařízení a
pokročilých metod cévní medicíny lze kromě diagnostiky
ihned po zjištění patologických poměrů v cévním
řečišti následně provést potřebný intervenční
výkon pod detailní kontrolou rtg zobrazení. Jedná se
např. o koronární angioplastiku (PTCA) -
rozšíření zúžené koronární (věnčité) tepny myokardu
pomocí speciálního katetru opatřeného na konci balónkem, s
příp. instalací tzv. stentu, který
zůstává rozepjat uvnitř věnčité cévy a brání jejímu
opětovnému smrštění.
Rentgenová
tomografie - CT
Klasické rtg-zobrazení je planární - je to dvojrozměrná
projekce density tkáně do určité roviny. Skutečná
tkáň je však objekt trojrozměrný, takže
planární obraz, který je dvojrozměrnou projekcí
skutečnosti, může zachycovat jen část reality. O
uspořádání tkáně v "hloubkovém třetím
rozměru", kolmém k zobrazované rovině, nemůžeme z
planárního obrazu nic zjistit. Planární obrazy mají z tohoto
hlediska závažné úskalí - možnost překrývání a
superpozice struktur uložených v různých hloubkách.
Pomáháme si zde sice zobrazováním ve více různých
projekcích, avšak riziko falešného nálezu či neodhalení
anomálie v hloubi organismu, překryté jinou strukturou, nelze
nikdy vyloučit. U planárního zobrazení dochází k prozařování
X-záření z různých hloubek, k superpozici a
sumování informace o rozložení denzity ze všech
hloubkovývh vrstev tkání a orgánů do společného obrazu.
Výsledná odezva v obraze je součtem
příspěvků z jednotlivých vrstev tkáně - nejen z míst
vyšetřované léze, ale i z vrstev, které se nacházejí nad
lézí a pod lézí. Tím se detaily struktury vyšetřovaného
orgánu v určité hloubce zastírají
obrazovými informacemi ze vzdálenějších a bližších
vrstev. Jednotlivé tkáně a orgány jsou na planárním snímku
zobrazeny sumárně, překrývají se. Nejsme vždy
schopni jednoznačně určit, kterými orgány a strukturami
rentgenové paprsky prošly a byly jimi zeslabeny. Superpozice
záření z různých hloubek zobrazovaného objektu dále vede
ke snížení kontrastu zobrazení struktur a
lézí.
Pro odstranění těchto nevýhod planární rtg
diagnostiky a pro získání komplexního zobrazení struktur v
různých hloubkách byla vyvinuta transmisní rentgenová
tomografie *) poskytující trojrozměrné
zobrazení density tkání v organismu. Jednou z
hlavních předností tomografického zobrazení je podstatně vyšší
kontrast zobrazení lézí, které na transverzálních
řezech nejsou překrývány zářením z okolních vrstev.
*) Řecky tomos
= řez - tomografické zobrazení je tvořeno určitými řezy
(angl. řez = slice), primárně transverzálními,
jejichž větší počet vytváří trojrozměrný obraz.
Vyšetřovaná oblast je rozdělena na větší počet tenkých
vrstev (řezů), které se každá zvlášť snímají pod mnoha
různými úhly a z lokálního zeslabení rtg paprsků se v
počítači matematicky zrekonstruuje denzitní obraz dané
vrstvy. Vyšetřovanou oblast si pak můžeme na obrazovce
počítače prohlédnout po jednotlivých tenkých vrstvách -
jako kdybychom pacienta příčně "rozřezali",
podívali se dovnitř na každý řez a pak ho zase (bez
poškození) složili.
Předchůdkyní nynější
počítačové tomografie CT byla pohybová tomografie:
rentgenka a vyšetřovací stůl s pacientem se vůči sobě
protisměrně posunovaly takovým způsobem, že pro vrstvu v
určité hloubce se oba pohyby vykompenzovaly a získal se ostrý
obraz, zatímco v ostatních vrstvách byl obraz pohybově
rozmazán a tím méně zřetelný. Kvalita a kontrast takového
zobrazení však nebyly valné (s CT naprosto nesrovnatelné),
metoda je již dávno opuštěná.
Tomografické rtg zobrazení se dosahuje tím, že
vyšetřovaná oblast se prozařuje X-zářením pod řadou
různých úhlů (v rozsahu 0-180-360°): rentgenka a
naproti ní umístěný detektor X-záření rotují
kolem těla pacienta *), přičemž úzký svazek X-záření prozařuje
vyšetřovanou tkáň a jeho intenzita je detekována a
převáděna na elektrický signál (obr.3.2.8a); vyhodnocuje se
zeslabení paprsku v důsledku absorbce tkání. Z množství
integrálních hodnot získaných prozařováním pod řadou
úhlů 0-360° se pak metodou zpětné projekce provede rekonstrukce
absorbční mapy, čímž vznikne denzitní obraz
příčného řezu vyšetřovanou oblastí v rovině
kolmé k ose rotace rentgenky a protilehlého detektoru - viz níže "Vznik denzitního obrazu". Na tomto obraze jsou citlivě a s vysokým
rozlišením zobrazeny struktury uložené v různých hloubkách
v organismu - jedná se o obraz tomografický.
Na takovém obraze máme nepřeberné možnosti prohlížení
snímaného objektu ze všech úhlů pohledu a v různých
vrstvách (řezech).
*) Rentgenka a protilehlý detekční
systém jsou upevněny na speciálním prstencovém stojanu
zvaném gantry (angl. gantry = portál,
průchozí nosná konstrukce), umožňujícím pomocí
elektromotorku rotaci systému
rentgenka-detektor kolem vyšetřovacího lehátka.
Postupným podélným
lineárním posunem pacienta vzhledem k systému
rentgenka-detektor můžeme vytvořit řadu obrazů příčného
řezu (jednotlivých vrstev), které umístěny vedle sebe
vytvářejí trojrozměrný tomografický obraz
vyšetřované oblasti. Vzhledem k výpočetní náročnosti
rekonstrukční procedury lze toto provést pouze s pomocí
počítače - proto se tato metoda nazývá počítačová
tomografie CT (Computerized Tomography)
či výpočetní tomografie. Přesný název "rentgenová transmisní
počítačová tomografie" (X-ray Trasmission Computerized
Tomography) se pro svou zdlouhavost neujal.
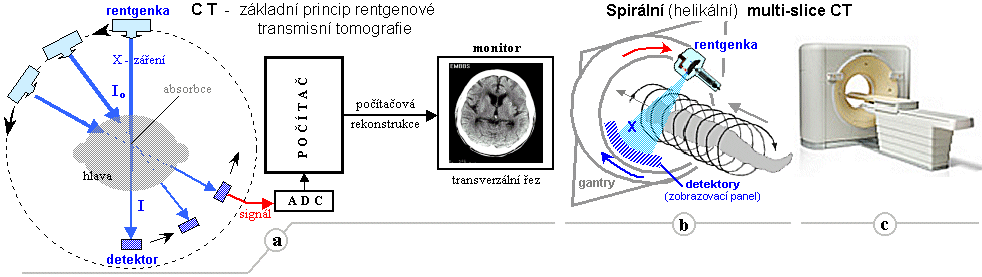
Obr.3.2.8. Rentgenová počítačová
tomografie CT.
a) Základní principiální schéma CT. b)
Princip spirální CT. c) Přístroj 64-slice
CT.
Kromě prostorového tomografického zobrazení
je hlavní předností CT v porovnání s konvenčním rtg
zobrazením podstatně vyšší kontrast - je
schopna rozpoznat a zobrazit i nepatrné rozdíly v lineárních
součinitelích zeslabení X-záření, které proniká
vyšetřovanou tkání. Je to dáno v prvé řadě principem
zobrazení transverzálního řezu pomocí úzkého paprsku bez
ovlivnění sousedními vrstvami a elektronickou detekcí
X-záření, která je schopna zachytit jemnější rozdíly a
širší rozsah dynamiky, než klasický rtg film. K výbornému
denzitnímu rozlišení dále přispívají i metody
počítačové rekonstrukce a filtrace obrazu, jakož i možnosti
flexibilního nastavení optimální modulace obrazu (jas,
kontrast). Počítačový software pro CT má dále řadu
nástrojů pro konstrukční úpravy obrazů, vytváření
trojrozměrných obrazů určitých orgánů, rekonstrukci řezů
i v jiných rovinách, než výchozí transverzální, v níž
byl pacient snímán.
Výsledkem CT jsou skutečné "anatomické
řezy" tělem pacienta, na nichž je možné vidět
orgány a tkáně samostatně, na rozdíl od
planární RTG, kde jsou zobrazeny sumárně a navzájem se
překrývají.
Před započetím vlastní
diagnostické akvizice CT se obvykle provádí zkušební,
"průzkumové" či "plánovací" radiografické
zobrazení, označované zkratkou SPR (Scan
Projection Radiograph); je známé též pod názvy Scanogram
nebo Topogram. Snímá se stacionárním (nerotujícím)
systémem rentgenky a detektorů, většinou v projekci AP nebo
PA, při němž se lehátko s pacientem posunuje přes gantry.
Vzniká tím planární obraz podobný jako u klasické
skiagrafie. Tento obraz pak slouží pro stanovení počátku a
konce zobrazované oblasti těla. Dále může být obraz SPR
použit pro expoziční automatiku - získání
absorbčních (atenuačních) údajů pro automatickou
regulaci anodového proudu [mA] rentgenkou ATCM (Automatic Tube
Current Modulation), aby bylo dosaženo optimalizace
vztahu kvalitního obrazu a radiační zátěže pacienta. Tato
technologie anatomické dávkové modulace v reálném
čase podstatně snižuje radiační dávku při zachování
kvality obrazů.
Vývoj
tomografické metody zobrazení. 5 generací CT
přístrojů.
Obecné snahy o rekonstrukci trojrozměrného zobrazení
na základě zobrazení dvourozměrného (či množiny
jednorozměrných projekcí) sahají již do r.1917, kdy J.Radon
odvodil integrální transformaci (nyní nazývanou Radonova
transformace) mezi množinou integrálů přímek a
množinou bodů transverzálního řezu vyšetřovaného
prostoru. V r.1963 A.Cormack tyto výsledky aplikoval a
rozšířil na případ X-záření, procházejícího s
částečnou absorbcí trojrozměrným objektem. A v r.1972 G.N.Hounsfield
dokončil vývoj prvního přístroje CT.
V dalších letech se prokázaly velké
přednosti CT a tyto přístroje se velice rozšířily. V
průběhu technického vývoje zároveň docházelo k výrazným
změnám v konstrukčním uspořádání jednotlivých
elektronických i mechanických dílů přístrojů CT. Z
hlediska tohoto technického vývoje se přístroje CT
rozdělují obvykle do pěti generací:
¨ 1.generace:
X-záření z rentgenky bylo kolimováno do tenkého
svazku (válcového "tužkového" tvaru) a po
prozáření pacientem detekováno protilehlým jedním
detektorem (jak je na obr.3.2.4a), rotujícím spolu s
rentgenkou.
¨ 2.generace:
X-záření z rentgenky je kolimováno do tvaru vějíře
a po průchodu pacientem je detekováno větším počtem
detektorů, umístěných v jedné řadě
na kružnicové výseči naproti rentgence, rotující spolu s
rentgenkou.
¨ 3.generace:
X-záření z rentgenky je kolimováno do tvaru širšího
vějíře podobně jako u 2.generace, avšak prošlé záření
je detekováno velkým množstvím detektorů umístěných na
kruhovém oblouku ve více řadách (obr.3.2.8b)
- snímá se současně více řezů - multi-slice CT.
Pokračováním přístrojů 3.generace jsou níže popsané spirální vysokorychlostní
multidetektorové systémy MDCT.
¨
4.generace: detektory jsou uspořádány stacionárně
do úplného kruhu (prstence, resp. několik prstenců
ležících vedle sebe) kolem pacienta, přičemž rotuje jen
rentgenka.
¨ 5.generace:
kardio-tomograf s elektronovým svazkem - EBT - Electron Beam CT,
popsaný níže, obr.3.2.10.
Přístroje 4. a 5. generace nejsou
příliš rozšířeny, protože při vyšší ceně
nepřinášejí zásadní výhody pro klinickou praxi ve
srovnání s moderními konstrukčními řešeními přístrojů
generace třetí (vysokorychlostní
multidetektorové systémy MDCT, viz níže).
Spolu s technickým zdokonalováním
rentgenové CT byl tomografický princip použit i u dalších
zobrazovacích modalit. Vedle optické CT byly vyvinuty tomografické
metody scintigrafické - jednofotonová emisní
tomografie SPECT a pozitronová emisní tomografie PET (kap.4
"Scintigrafie", §4.3 "Tomografické kamery").
A též nejsložitější tomografická zobrazovací metoda nukleární
magnetická rezonance NMRI (§3.4, část "Nukleární magnetická rezonance").
Pozn.: Pro
speciální technické účely zobrazování struktury drobných
předmětů se používá i tzv. rentgenová mikro-tomografie
(mCT)
zmíněná níže (§3.3, část "Radiační
defektoskopie").
Vznik
denzitního obrazu
Má-li podle obr.3.2.4 vlevo svazek X-záření, emitovaný
rentgenkou a dopadající na vyšetřovanou oblast, počáteční
intenzitu (tok fotonů za 1s) Io, pak jeho intenzita I po průchodu tkání bude
I = Io.e-Sm(i,j).Dx,
kde m(i,j)
je lineární součinitel zeslabení X-záření pronikajícího
místem tkáně o souřadnicích i,j a Dx je velikost (délka ve
směru paprsku) elementu tkáně. Hodnoty koeficientů m(i,j) závisí na
lokální hustotě a protonovém čísle jednotlivých míst
(i,j) tkáně. Logaritmováním se tento vztah dá upravit na
tvar: ln(I/Io) = Sm(i,j).Dx, který říká, že logaritmus poměru intenzit
X-záření vstupujícího do vyšetřované tkáně a z ní
vystupujícího, se rovná součtu součinů lineárních
koeficientů zeslabení m a drah Dx, které fotony X-záření v jednotlivých místech
tkáně překonávají.
Měřením při různých polohách (úhlech) rentgenky a
detektoru se získá řada hodnot zeslabovacího poměru ln(I/Io). Počítač pak v
zásadě řeší soustavu lineárních rovnic shora uvedeného
tvaru, čímž se získají hodnoty lineárních součinitelů
zeslabení X-záření tkáňových elementů v jednotlivých
místech (i,j) tkáně - vzniká obraz denzity tkáně
v transverzálním řezu.
V praxi se nepostupuje výše uvedeným
přímočarým způsobem. Výsledný transverzální CT obraz se
získává počítačovou rekonstrukcí z
jednorozměrných profilů distribuce intenzity prošlého
paprsku X-záření při otáčení rentgenky a protilehlých
detektorů kolem vyšetřovaného objektu. Pro tuto rekonstrukci
se používá většinou metoda filtrované zpětné
projekce, někdy i dokonalejší (avšak výpočetně
náročnější) metoda iterativní rekonstrukce
*).
*) Iterativní rekonstrukce
je matematický algoritmus pro hledání nejvěrnějšího obrazu
postupnými aproximacemi a zpřesňováním výchozího
"hrubého" obrazu. Vychází z obrazu získaného
zpětnou projekcí a spočívá v několikanásobném
opakování čtyř po sobě následujících kroků -
"rekonstrukční smyčky": 1.
V prvním kroku se z obrazu vytvořeného zpětnou projekcí
vypočítají opačným postupem znovu jakoby původní data. 2.
Ta se pak porovnají s "hrubými" daty skutečně
nasnímanými při detekci. 3. Podle
zjištěných odlišností se upraví nová data pro zpětnou
projekci. 4. Znovu se vypočítá obraz a celá
operace se opakuje. Po několika opakováních těchto iterací
získáme čistý a kvalitní obraz. Počet iterací lze
nastavovat a optimalizovat. Do procedury se zařazují korekční
algoritmy a metody filtrace šumu. Tato metoda
poskytuje kvalitnější snímky s redukcí šumu a artefaktů
vznikajících při rekonstrukci. Dále, u některých
vyšetření můžeme výrazně snížit expozici a radiační
dávku pacienta, při zachování dostatečně kvalitních
obrazů.
Tyto rekonstrukční metody,
které jsou anologické jako u SPECT, jsou stručně popsány v
§4.3 "Tomografická scintigrafie", pasáž "Počítačová rekonstrukce SPECT" *). Ústřední a řídící softwarový
algoritmus rekonstrukce se někdy nazývá kernel
(jádro, zrno).
*) Omlouvám se profesionálním rentgenologům, že to není
zařazeno v této kapitole. Naše odborné materiály jsou totiž
primárně orientovány na jadernou fyziku a
radionuklidovou scintigrafii. Tento úhel pohledu může být
snad inspirativní i pro kolegy z oblasati RTG diagnostiky..?..
Denzita
vyšetřované tkáně se většinou porovnává s densitou
vody a v obraze CT je číselně prezentována v tzv. Hounsfieldových
jednotkách HU = 1000.(mtkáň - mvoda)/mvoda , zavedených předním průkopníkem v oblasti CT G.N.Hounstfieldem (spolu s A.L.Cormackem).
Použití faktoru 1000 (místo obvyklého 100 u %, kde bychom
dostávali desetinné hodnoty) odráží vysoké
denzitní rozlišení CT. Nulové denzitě (vakuum,
vzduch) odpovídá hodnota HU=-1000, pro vodu je HU=0, kosti
mají denzitu řádově HU=100¸1000, někdy i vyšší. Provzdušněné plíce mají HU
cca -800, tuk HU=-40¸-120, denzita měkkých tkání je HU=20¸80. Tak velký
rozsah denzit není obrazovka počítače schopna lineárně
jasově zobrazit; rovněž lidské oko je schopno rozlišit jen
několik desítek stupňů šedi. Pro optimální prezentaci
obrazu si proto pomáháme vhodnou modulací jasu a
kontrastu obrazu. Pokud nás zajímají rozdíly v
tkáních s podobnou denzitou (tak tomu bývá v měkkých
tkáních), vybíráme pomocí této modulace z celé škály
denzit jen úzkou část - tzv. okénko, jehož
škálu denzit zobrazíme v celém jasovém rozsahu obrazovky.
Dostáváme tak dobře prokreslené obrazy požadovaných
struktur a posunováním okének můžeme postupně získávat
detailní informace o tkáních s různými denzitami.
Detektory X-záření pro CT
Úkolem těchto detektorů je zachytit fotony X-záření
procházejícího vyšetřovanou tkání a přeměnit je na
elektrické signály pro další elektronické zpracování za
účelem počítačové rekonstrukce denzitních řezů. Pro tuto
oblast obecně platí zásady uvedené v kapitole 2 "Detekce
a spektrometrie ionizujícího záření" s tím, že se zde
uplatňuje většimou jen detekce, jen zřídka spektrometrie.
Základním požadavkem je zde vysoká citlivost
detekce fotonů X-záření a vysoká rychlost
detekce, tj. krátká mrtvá doba.
Pro detekci X-záření v CT lze v zásadě použít tři druhy
detektorů :
- Ionizační komory
plněné stlačeným plynným xenonem (více anod a katod
v jedné trubici tvoří řadu detektorů). Používaly
se do konce 80.let, nyní jsou opuštěny.
- Scintilační
detektory
se scintilačními
krystaly NaI(Tl), CsI(Tl), Bi4Ge3O12 (BGO), Lu2SiO5(Ce) (LSO), Lu1,9Y0,1SiO5 (LYSO), CdWO4 ;
čtyři posledně uvedené mají výhodu ve vysoké
detekční účinnosti při malých rozměrech (vlastnosti scintilátorů jsou podrobně
rozebírány v §2.4, pasáž "Scintilátory a jejich
vlastnosti"). Scintilátory založené na keramických
materiálech (kysličníky křemíku), dopovaných
vzácnými zeminami (jako je lutetium, gadolinium nebo
ytrium) a příp. i dalšími prvky, se někdy označují
jako UFC (Ultra Fast Ceramic) -
ultrarychlé keramické detektory. Detekční elementy
mají aktivní velikost cca 0,8x0,8 - 1x1 mm2.
Absorbované X-záření produkuje ve
scintilátoru viditelné světlo. Scintilační
záblesky jsou snímány fotodiodami
nebo fototranzistory, přitmelenými na zadní straně
každého detekčního elementu; jedná
se zde jen o prostou detekci, nikoli spektrometrii. Takto
vzniklé elektrické impulsy, registrované během doby
měření dané projekce, se pro každý element integrují,
zapisují do počitače a provádí se výsledná rekonstrukce
obrazů příčných řezů.
Dvouvrstvové detektory CT
Pro simultánní CT detekci X-záření nižší a
vyšší energie v metodě DECT (Dual Energy CT) s jednou
rentgenkou s vyšším napětím (cca 140 kV) byly
vyvinuty prstencové detektory skládající se ze dvou
vrstev scintilačních detektorů. Horní
"lehká" vrstva je tvořena
scintilačními detektory s nízkou hustotou (na
bázi ytria). Spodní "těžká" vrstva
sestává ze scintilačních krystalů s vysokou hustotou
(na bázi gadolinium-oxysulfidu). X-záření po
průchodu pacientem dopadá nejprve na horní vrstvu, ve
které se selektivně absorbuje, a tudíž detekuje,
pouze nízkoenergetické X-záření, zatímco
vysokoenergetické fotony touto vrstvou pronikají do
spodní vrstvy, ve které se účinně absorbují a
scintilačně detekují.
Ke všem scintilačním elementům horní
i spodní vrstvy jsou přitmeleny fotodiody. Impulsy z
fotodiod obou vrstev se zpracovánají separátně,
jejich rekonstrukcí vznikají dva CT obrazy příčných
řezů, denzitně modulované absorbcí X-záření
nižší a vyšší energie. Pomocí DEXA analýzy z nich
lze provádět přibližnou materiálovou specifikaci
zobrazovaných struktur (bylo podrobněji diskutováno v
pasáži "Dvou- a multi-energetické RTG
zobrazení. Analýza materiálového složení.").
- Polovodičové
detektory
Fotony X-záření dopadají přímo do polovodičových
detektorů (vhodným materiálem je
CdTe, CdZnTe - CZT), kde svou
interakcí uvolňují elektrické náboje a jsou tak přímo
převáděny na elektrický signál (obecný
princip polovodičových detektorů je uveden v §2.5
"Polovodičové
detektory"). Metoda polovodičové detekce v RTG
diagnostice je obecně popsána výše v pasáži "Elektronické zobrazovací detektory X-záření", odstavci "Polovodičová
detekce (přímá
konverze)".
Oproti scintilační konverzi má výrazné výhody a
poskytuje nové možnosti v CT
zobrazování :
Spektrometrická photon-counting CT
Přímá polovodičová detekce umožňuje nezávislou
registraci jednotlivých fotonů
X-záření: "počítání
fotonů" - photon couting. A
následně elektronickou analýzu amplitud
těchto impulsů - provádění spektrometrie
detekovaného X-záření *). Použitím dvou či
několika různých amplitudových - energetických
oken analyzátoru lze získat CT obrazy pro různé
energie procházejícího X-záření. Můžeme
pak využít materiálově specifický rozdíl v
absorbci X záření různých energií pro materiálovou
- tkáňovou diferenciaci zobrazovaných
struktur, které jinak na konvenčním CT obrazu
vykazují stejné denzitní zeslabení. Tato možnost
materiálové analýzy v RTG obrazech byla podrobněji
diskutována v pasáži "Dvou-
a multi-energetické RTG zobrazení. Analýza
materiálového složení.".
*) Teminologická
poznámka: Místo
názvu "photon-counting CT", který se
vžil v oblasti radiodiagnostiky, by z fyzikálního
hlediska byl výstižnější název "photon-spectrometry
CT", neboť důležitá je zde
energetická (spektrometrická) analýza fotonů
detekovaného X-záření (spíše než prosté
"počítání fotonů").
Polovodičový prstencový detekční
systém v CT by se (v přímé
analogii se obvyklými scintilačními detektory) mohl skládat z velkého počtu drobných
detektorů CZT. Bylo však vyvinuto i jednodušší a
výhodnější uspořádání: Detektor tvořený
delšími polovodičové vrstvami (tloušťky 1,5-3 mm)
se společnou katodou a pixelovanými anodovými
elektrodami na protilehlé straně. Mezi elektrodami je
aplikováno napětí cca 800-1000 V. Absorbované
X-záření vytváří v polovodičové vrstvě páry
elektron-díra, elektrony v silném elektrickém poli
rychle driftují k anodám, kde vytvářejí krátké
elektrické impulsy (cca 10-9 s). Amplituda těchto impulsů je úměrná
energii absorbovaných rentgenových fotonů. Výhodou
tohoto uspořádání je, kromě kompaktnější
konstrukce, i poněkud zvýšená geometrická detekční
účinnost (o cca 20%), neboť mezi jednotlývými
elementy detektoru nejsou oddělovací přepážky (u scintilačních buněk jsou optické
přepážky šířky cca 0,1-0,2 mm).
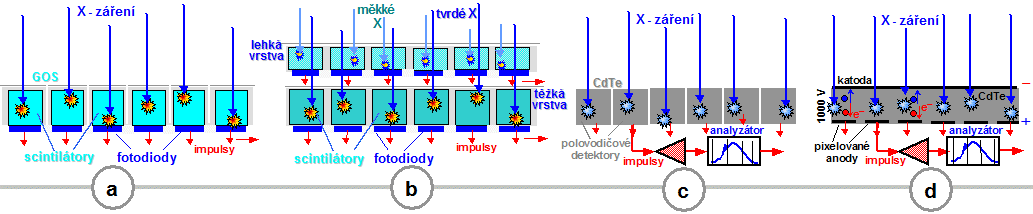
Detektory X-záření pro CT (jsou to jen
základní schématické nákresy, není zde zakresleno
zakřivení obloukového uspořádání ani lamely proti
rozptýlenému záření).
a) Scintilační detekce X-záření,
nejpoužívanější metoda. b) 2-vrstvový
detektor registrující odděleně nizkou a vysokou energii
X-záření. c) Systém polovodičových
pixelových detektorů X-záření - photon-couting CT,
umožňující spektrometrickou analýzu X-záření; zde jsou to
jednotlivé detektory. d) Spektrometrický
photon-coutinng CT v technologii páskových polovodičových
detektorů se společnou katodou a pixelovanými anodami.
Mnohodetektorové,
multi-slice a spirální CT; Cone-Beam CT
Postupné snímání CT obrazů systémem jedné rentgenky a
jednoho detektoru, jak jsme jej zde zatím podle obr.3.2.4a pro
snadnější vysvětlení metody popsali, se používalo u
prvních generací CT zařízení v 70. a 80.letech. Jeho
nevýhodou byla značná zdlouhavost (jeden řez
trval několik minut). U novějších generací přístrojů CT
se již používá většího počtu detektorů
(cca 1000). Krouží rentgenka, jejíž svazek primárního
záření je pomocí kolimátorů vycloněn do tvaru vějíře (s
úhlem cca 40°), a naproti ní odpovídající kruhová výseč
se soustavou 300-1000 detektorů (obr.3.2.8b). Doba snímání
jednoho řezu se zkracuje pod 1 sekundu.
První typy CT přístrojů měly
rotující část - rentgenku a detektory - se statickou
napájecí a vyhodnocovací částí propojeny kabelem,
což neumožňovalo kontinuální rotaci (po jedné otáčce se
rentgenka s detektorem musely vrátit do výchozí polohy, resp.
musela nastat změna směru rotace, aby se kabel nepřekroutil).
Novější typy (od 80.let) používají k napájení a přenosu
signálu technologii "klouzavých prstenců" (slip-ring)
se snímáním elektrickými kartáčky, umožňující rychlou a
kontinuální rotaci (s neomezeným počtem otáček v jednom
směru).
Původní generace CT přístrojů během jedné rotace
snímala jen jeden příčný řez vyšetřovanou oblastí. Pro
zvýšení rychlosti CT vyšetření rozsáhlejších oblastí je
u novějších generací přístrojů použito vždy několika
detektorů, resp. několika prstenců detektorů,
umístěných vedle sebe v axiálním (podélném) směru - MDCT
(Multi Detector CT). To umožňuje (při vhodném tvarování
svazku X-záření z rentgenky) současné snímání
několika transverzálních řezů vedle sebe,
vyšetření několika tenkých vrstev současně. Hovoříme o
"více-řezových", tzv. multi-slice
CT přístrojích (angl. slice = řez) - 4, 6, 8, 16, 64 - slice-ových. Technická konstrukce
přístrojů CT se neustále vylepšuje. Zvyšuje se počet
detektorů a rychlost otáčet rotoru gantry (nyní cca
0,3s/otáčku) - jedná se o vysokorychlostní
multidetektorové systémy MDCT. Jednotlivé
transverzální řezy můžeme snímat dvojím způsobem:
- Sekvenční skenování, kde se
rotačně pohybuje jen systém rentgenka-detektory a lehátko s
pacientem se nepohybuje. Jednotlivé vrstvy se snímají
postupně - nezávisle jednotlivými prstenci detektorů.
- U tzv. spirálních CT (helikálních)
pak navíc během otáčení rentgenky probíhá pomalý
automatický posun lehátka s pacientem (dráha
rentgenky se efektivně jeví jako spirála) - obr.3.2.8b,c, s
následnou trojrozměrnou rekonstrukcí; zde je v principu možno
dosáhnout celotělového CT zobrazení.
Vodorovná vzdálenost, o kterou se lehátko posune mezi dvěma
sousedními oběhy rentgenky - "stoupání" spirály -
se nazývá pitch-faktor [mm].
EKG-synchroizovaná CT
angiografie
Významným technickým pokrokem v oblasti zobrazení
srdce je neinvazívní elektrokardiograficky
synchronizovaná angiografie multidetektorovou počítačovou
tomografií - MSCTA. Hlavní
využití této metody je dvojí:
1. MSCT
nativní kalciové score - detekce a kvantifikace
kalcifikátů v koronárních tepnách (obsahu kalcia v placích
koronárních arterií). Obvykle se hodnotí rizikové skupiny
podle Agastonova kalciového skóre (do 5 skupin).
2. MSCT koronarografie
- kontrastní zobrazení epikardiálních koronárních arterií
k diagnostice rozsahu a závažnosti koronárního postižení u
ischemické choroby srdeční.
Kombinací obou metod můžeme zobrazit měkkou i
kalcifikovanou část plaku, zjistit charakter, rozsah a
závažnost postižení, s příp. indikací na invazivní
vyšetření se stanovením způsobu revaskularizace.
Cone-Beam CT
Pro některé účely se používá CT zobrazení s
široce kolimovaným kónickým svazkem X-záření (cone-beam
CT - CBCT), který prozařuje pacienta a dopadá na
protilehlý zobrazovací flat-panel (jeho
princip je popsán v §3.2, pasáž "Elektronické
zobrazení X-záření"). Rentgenka a protilehlý flat-panel rotují kolem
vyšetřovaného objektu na společném gantry. Takový systém
CBCT se instaluje na radioterapeutické ozařovače (lineární
urychlovače) používající techniku radioterapie řízené
obrazem - IGRT (§3.6, část "Modulace
ozařovacích svazků"), nebo je
naopak používán u malých dentálních CT
přístrojů (uvedených níže).
CT
s 2 rentgenkami - DSCT : Dual Source a Dual Energy CT
Další technické zdokonalení CT spočívá v konstrukci
přístrojů, které mají 2 rentgenky - dva
systémy rentgenka/detektor (uložené kolmo k sobě), které
mohou snímat současně (obr.3.2.9).
Zařízení se označuje jako Dual Source CT
(DSCT). Může pracovat ve dvou základních režimech,
poskytujících dvě výhody :
¨
1. Obě rentgenky
pracují při stejném napětí
Ţ "zdvojený systém" -
zvýšení rychlosti a zkrácení akvizičního
času se snížením časového rozlišení na cca 80ms. To má
význam zvláště u CT srdce (s vyšší tepovou frekvencí).
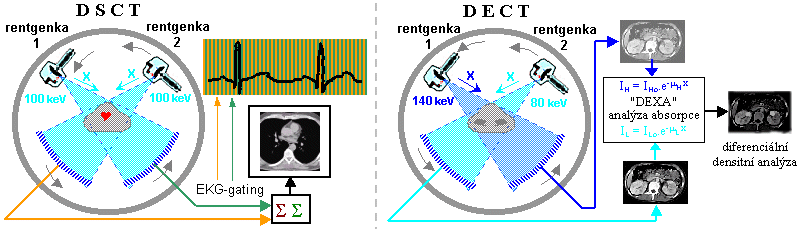
Obr.3.2.9. CT přístroj se dvěma rentgenkami - Dual Source CT a
Dual Energy CT.
¨ 2. Obě rentgenky pracují při různém
anodovém napětí (např. 140kV a 80kV **)
Ţ možnost snímání s dvojí
energií (DECT - Dual
Energy CT): každá z obou rentgenek
vytváří X-záření o rozdílné efektivné energii. Získáme
tak dva různé denzitní obrazy téhož místa.
Různé druhy látek (a tkání) se liší nejen konkrétními
hodnotami lineárních součinitelů zeslabení m pro záření X
určité energie, ale i poněkud rozdílnou závislostí
m(EX) absorbce pro různé
energie EX záření X. Toho lze v principu využít pro
dodatečné rozlišení různých druhů a složení
tkání na základě diferencí v denzitních obrazech
téhož místa, získaných s různými energiemi záření X. Umožňuje to tedy nejen lépe
kvantifikovat distribuci density, ale navíc stanovovat složení
tkání pomocí metody diferenciální densitní
analýzy DEXA (Dual Energy X-ray
Absorptiometry) *) - podobné analýzy
densitních obrazů, jako u "Kostní densitometrie"
(viz níže obr.3.2.11). Poskytuje to nejen
detailní snímky anatomie, ale přibližně to umožňuje rozlišovat
různé druhy tkáně (odlišit např. kosti, cévy,
tkáň tukovou), různé druhy ledvinových kamenů, usazování
krystalků urátu sodného v kloubech (dna), či lépe
kvantifikovat distribuci kontrastní látky v myokardu (a
posoudit funkční ovlivnění při morfologickém postižení
věnčitých tepen).
Tato možnost materiálové analýzy v
RTG obrazech byla podrobněji diskutována v pasáži: "Dvou- a
multi-energetické RTG zobrazení. Analýza materiálového
složení.".
Multiplexní DECT
Alternativní možností tomografie DECT je použití jednoho
systému rentgenka-detetor, v němž dochází k multiplexnímu
přepínání napětí na rentgence během spirálního
skenování.
2-vrstvový detektor
CT
Další alternativní možností tomografie DECT s jednou
rentgenkou je použití dvou vrstev detektorů selektivně
detekujících nízko- a vysokoenergetickou složku X-záření
(bylo zmíněno výše v odstavci "Detektory
X-záření pro CT",
pasáži "Dvouvrstvové detektory CT".
Spektrometrická
Photon-couting CT
Dále je pravděpodobné, že celá technologie DECT se dvěma
rentgenkami bude v budoucnu nahrazena systémem photon-couting
CT s jednou rentgenkou a polovodičovými detektory,
umožňujícími flexibilní energetickou spektrometrii
detekovaného X-záření (bylo popsáno výše v pasáži "Elektronické
zobrazovací detektory X-záření",
odstavci "Polovodičová
detekce (přímá
konverze)" a "Detektory X-záření pro CT").
Kontrola kvality a
zobrazovacích vlastností přístrojů CT
Testování zobrazovacích vlastností CT přístrojů se
provádí pomocí speciálních fantomů
válcových tvarů - viz "Fantomy a
fantomová měření", pasáž
"Tomografické fantomy pro CT".
Tomografie s elektronovým svazkem -
Electron Beam CT (EBT)
Vedle popsaného konstrukčního řešení
CT, nyní již "klasického" s rotující rentgenkou,
bylo vyvinuto zcela odlišné, fyzikálně zajímavé řešení,
které vůbec neobsahuje rentgenku. X-záření
zde vzniká dopadem rychlých elektronů, vystřelovaných "elektronovým
dělem", na kovový terčíkový prstenec
- anodu, uvnitř něhož je umístěn vyšetřovaný objekt
(obr.3.2.10). Elektronový paprsek z elektronového děla je do
požadovaného místa terčíkového prstence směrován magnetickým
vychylováním pomocí vychylovacích cívek,
napájených vhodným elektrickým signálem. Napájením
vychylovacích cívek střídavým elektrickým proudem vhodného
periodického průběhu elektronový svazek rotuje
úhlovou frekvencí w a při tomto kruhovém pohybu postupně zasahuje
jednotlivá místa na obvodu terčíkového prstence. V každém
takto zasaženém místě vzniká brzdné X-záření,
jehož paprsek pod odpovídajícím úhlem prozařuje
vyšetřovaný objekt (tělo pacienta). Rotující elektronový
svazek tedy generuje rotující zdroj X-záření
po obvodu terčíkového prstence, podobně jako kdyby zde
rotovala rentgenka. Brzdné X-záření prochází prstencovým kolimátorem
s radiálně orientovanými septy, který jej tvaruje do vějířovitého
svazku.
Toto X-záření, prošlé vyšetřovaným objektem (tkání
pacienta), je detekováno elektronicky (stejně
jako u klasické CT) pomocí prstencově uspořádaného pole
detektorů, zevnitř překrývajících kolimátor. Při vhodném
geometrickém uspořádání septa kolimátoru odstiňují
X-záření, jež by přicházelo přímo od terčíkového
prstence k zadní straně jednotlivých detektorů. Novější
typy EBT přístrojů mají několik vedle sebe řazených
terčíkových prstenců a několik prstencových polí
detektorů.

Obr.3.2.10. Základní principiální
schéma RTG tomografie pomocí elektronových svazků
Toto konstrukční řešení má dvě výhody:
¨
Neobsahuje žádné mechanicky pohyblivé díly - rotace
paprsku je elektromagnetická.
¨
Umožňuje velmi rychlou tomografii -
elektromagneticky vychylovaný paprsek může rotovat podstatně
rychleji, než je dosažitelné při rotaci mechanické. Toto je
výhodné pro sledování rychlých dějů jako je hradlovaná
(gatovaná) CT srdce - na obr.3.2.5 jsou do akvizičního
počítače spolu s impulsy z detektorů X-záření vedeny i EKG
trigrovací impulsy.
Nevýhodou je zde
ovšem značná složitost a nákladnost (cena) zařízení,
vzhledem k čemuž se tento typ zařízení zatím do praxe
příliš nerozšířil. Ani v budoucnu asi nelze očekávat
větší rozšíření těchto systémů, neboť rychlý
technický pokrok v konstrukci klasických CT -
vysokorychlostních multidetektorových systémů MDCT (popř. se
dvěma rentgenkami) řeší většinu výhod EBT, a to levněji a
pro běžnou praxi výhodněji.
Rtg
kostní densitometrie
Radiografické vyšetření skeletu patří mezi
nejčastější a nejdůležitější výkony rtg diagnostiky.
Speciální metodou v této oblasti je kostní
densitometrie - metoda pro zjišťování hustoty
(denzity) kostní tkáně na základě míry
absorbce X-záření, stanovené pomocí rtg absorpční
fotometrie (Radiographic Absorptiometry - RA).
Nejjednodušší metoda spočívá v prozařování úzkým
svazkem záření o jedné energii (SPA - Single
Photon Absorptiometry). Nevýhodou této metody je, že z
celkové absorpce X-záření nelze zjistit, jaká část je
způsobena kostí a jaká část měkkou tkání.
Dokonalejší denzitometrickou metodou je rtg absorbční
fotometrie využívající dvou energií svazku
X-záření (DEXA - Dual Energy X-ray Absorptiometry), např.
dvojice efektivních energií 50keV + 100keV, či 35keV + 75keV.
Využívá se zde rozdílných poměrů absorpce X-záření v
měkké tkáni a v kostech při nízké energii a při vysoké
energii záření - různých hodnot lineárních součinitelů
zeslabení m. Matematickou analýzou exponenciálních zákonů
absorpce I = Io.e-m.x pro jednotlivé energie a druhy tkání
(logaritmováním se příslušné exponenciální rovnice
převádějí na lineární) se stanoví podíl absorpce v
měkké tkáni a v samotné kosti, z čehož je po vhodné
kalibraci možno stanovit denzitu kosti.
Kalibruje se vhodným fantomem kosti
(či hydroxyapatitem), přístroje mají své vnitřní
kalibrační fantomy. Obsah minerálů v kosti se kvantifikuje
pomocí parametrů BMC (Bone Mineral Content) v
[g/cm] a plošné hustoty minerálů BMD (Bone
Mineral Density) v [g/cm2]. Tyto parametry se porovnávají se soubory referenčních
(normálových) hodnot a stanovují se relativní indexy
(poměry) zvané skóre: T-skóre srovnává
naměřené hodnoty BMD s průměrnou hodnotou BMD mladých
zdravých dospělých téhož pohlaví; Z-skóre srovnává BMD s
průměrnými normálovými hodnotami pro daný věk a pohlaví .
Někdy se též sleduje rovnoměrnost density kosti BHI (Bone
Homogenity Index).
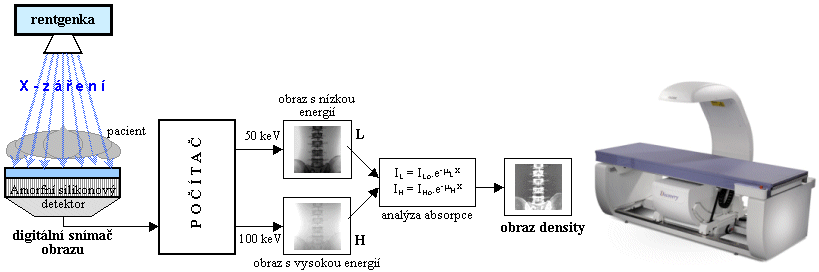
Obr.3.2.11. Principiální schéma DEXA zobrazovacího
digitálního rtg denzitometru (vpravo ukázka přístroje DEXA
pro celotělové zobrazení).
Moderní rtg densitometrické přístroje
používají prozařování vyšetřovaného místa rozbíhavým
("jehlanovitým") svazkem X-záření s následnou
detekcí prošlého záření digitálním snímačem
obrazu do paměti počítače - obr.3.2.11. Zde se
provedou příslušné výpočty absorpce mezi snímkem s nízkou
(L) a vysokou (H) energií X-záření a získá se výsledný obraz
density skeletu, který podává jak informace o obsahu
a hustotě minerálů v kosti, tak i morfologické informace o
stavbě skeletu. Nejdokonalejší přístroje tohoto druhu
umožňují provádět celotělovou obrazovou
diagnostiku kostní tkáně, stanovit obsah svalové hmoty,
tukové tkáně, vody a minerálů v jednotlivých částech
těla.
Detektory pro rtg
densitometrii
Pro detekci prošlého X-záření se používají buď scintilační
detektory NaI(Tl) či CaWO4, nebo polovodičové detektory
většinou na bázi CdZnTe (kadmium-zinek-tellurid - CZT), které mají vysokou detekční účinnost. V
moderních zobrazovacích denzitometrech jsou detektory
uspořádány do 2-rozměrné mozaikové konfigurace s vysokým
prostorovým rozlišením - tvoří digitální snímač
rtg obrazu, např. plochý panel o rozměru 20×20cm a
matici 512×512 elementů, který snímá celou skenovanou oblast
během jedné expozice.
Kostní denzitometrie hraje
klíčovou úlohu při diagnostice osteoporózy
- patologické redukce minerální a organické kostní hmoty,
vedoucí k zeslabení pevnosti kostí. Osteoporóza patří mezi
nejrozšířenější poruchy metabolismu kostí a je jednou z
nejčastějších příčin fraktur u starších lidí, zejména
u žen po menopauze. Včasná diagnostika počínající
osteoporózy (osteopénie) je důležitá pro nasazení účinné
léčby pro zpomalení či zastavení osteoporózy, než dojde k
nevratným poruchám ve struktuře kostí.
Pozn.: Používají se i neradiační
metody kostní densitometrie. Ultrazvuková densitometrie
stanovuje denzitu kosti na základě zeslabení zvukového
signálu a rychlosti jeho šíření tkání.
................
RTG
mamografie
Další důležitou specializovanou metodou rtg zobrazení je mamografie
- zobrazení případných nehomogenit a okrsků zvýšené
hustoty tkáně v ženském prsu, které by mohly svědčit pro nádorový
proces. Pro dosažení co nejlepšího kontrastu
zobrazení a rozlišení co nejmenších lézí je třeba
provést stlačení prsu pomocí kompresní
desky *) a tkáň takto tvarovanou do vrstvy o tloušťce cca 7cm
prozářit měkkým X-zářením o energii cca
20 keV. Fotony nízké energie X-záření interagují s atomy
tkáně především fotoefektem, což poskytuje vyší
kontrast absorbce mezi tkáněmi i s malými rozdíly
denzity. Vzhledem k této nízké energii se v mamografu
používá speciální rentgenka většinou s molybdenovou
anodou a beryliovým výstupním okénkem, velikost ohniska
0,1-0,3mm. K filtraci svazku X-záření se používá
molybdenový nebo rhodiový filtr, který odřezává fotony
vyšších energií než cca 20keV (K-hrana
Mo) nebo 23keV (K-hrana
Rh) - využívá se tzv. efektu K-hrany,
zmíněného výše v pasáži "Filtrace, kolimace".
*) Pozn: Komprese
tkáně prsu vede i k jedné drobné výhodě z hlediska radiační
ochrany: stlačením se dočasně omezí průtok krve a
dojde k částečné hypoxii buněk tkáně.
Sníží se tím poněkud radiobiologický účinek X-záření,
neboť hypoxické buňky jsou méně citlivé vůči záření
("kyslíkový efekt" - §5.2 "Biologické
účinky ionizujícího záření, část "LQ
model").
Snímkování se provádělo kazetou s rtg filmem
opatřeným zesilovačem obrazu, nebo nověji pomocí
elektronického snímání obrazu - polovodičový plochý (flat)
panel s přímou digitalizací obrazu. Mezi zobrazovanou tkání
a filmem či zobrazovacím detektorem je umístěna sekundární
Buckyova clona pro zmenšení podílu rozptýleného záření,
snižujícího kontrast obrazu. Vzniklý rentgenový snímek
prsní žlázy se nazývá mamogram či mastogram.
Za vhodných okolností je možné odhalit nádor již od
velikosti cca 4 milimetrů. Mamografie je vhodná nejen pro
vyšetřování žen s příznaky či podezřením na karcinom
prsu, ale i pro screening - vyhledávání
časných stádií rakoviny prsu.
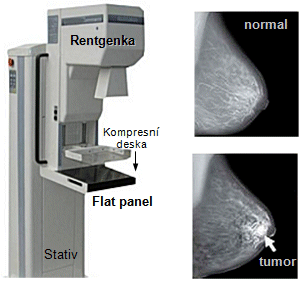 |
Obr.3.2.12.
Rentgenová mamografie
Prso se vloží mezi rentgenku a zobrazovací flat-panel
a stlačí se plastovou kompresní deskou.
Na RTG mamografickém obraze můžeme
pozorovat normální denzitu bez defektů (vpravo nahoře), nebo
léze zvýšené denzity, které mohou svědčit pro
tumor (vpravo dole). |
RTG mamografický přístroj může být
doplněn zařízením tzv. mamografické stereotaxe,
které snímá dva obrazy dané léze v šikmých projekcích pod
dvěma danými úhly (většinou ±15°). Vyhodnocení změny
pozice léze na těchto dvou stereosnímcích umožňuje přesné
zaměření zobrazených struktur podezřelých z nádorového
procesu - jejich lokalizaci a označení vhodným markerem (jako
je mandrén, drátek nebo barvivo), s možností odběru vzorku
pomocí biopsie pro histologické vyšetření.
Alternativní
mamografické metody
Vedle nejčastěji používané rtg mamografie existují i
některé další vyšetřovací metody založené na odlišných
principech:
¨
Ultrazvuková mamografie zobrazující příp. léze na
základě jejich odlišné hustoty a elasticity (o
ultrasonografii je stručně pojednáno v §4.6., pasáž "Ultrazvuková
sonografie").
¨
NMRI mamografie - zobrazení nukleární
magnetickou rezonancí
¨
Radioisotopová scintimamografie zobrazující zvýšenou
akumulaci vhodného radiofarmaka v příp. nádorové tkáni
(viz kap.4 "Scintigrafie");
může být provedena jako planární, SPECT či PET
scintigrafie. Specifická metoda pozitronové emisní
tomografie PEM je posána v §4.3, pasáži "Pozitronová emisní mamografie (PEM)".
¨
Elektroimpedanční mamografie snímající elektrickou
vodivost (impedanci) tkání mléčné žlázy. Pomocí elektrod
rozmístěných na kůži v okolí vyšetřované oblasti se do
tkáně zavádí slabý elektrický proud a rovněž pomocí
elektrod se snímá rozdělení elektrických potenciálů na
povrchu. Z těchto údajů lze rekonstruovat prostorové
rozložení lokální impedance tkáně - elektroimpedanční
obraz. U nádorové tkáně se pozoruje odlišná
elektrická vodivost od okolní tkáně.
Dentální RTG diagnostika
Samostatnou kategorií menších specializovaných rtg
přístrojů jsou zubní či dentální
rentgeny používané ve stomatologii. Jsou zde tři
druhy přístrojů:
¨ Intraorální RTG je velmi jednoduchý
přístroj: na pohyblivém rameně je umístěna malá rentgenka
kompaktního provedení s úzkým tubusem (v jejím krytu bývá
zapouzdřen i zdroj vysokého napětí cca 50¸70 kV). Malé
políčko rtg filmu se umístí ze zadní strany zubů a z
přední strany se exponuje rentgenkou. Po vyvolání se zobrazí
příslušný zub (či několik zubů) a jeho uložení v dásni,
včetně případných defektů.
¨ Panoramatický rentgen OPG (orthopantomogram),
zvaný též DPR (Dental Panoramatic Radiograph).
Rentgenka a naproti ní umístěný rtg film nebo zobrazovací
flat panel v průběhu expozice rotují
(obíhají) a opisují kruhovou či eliptickou trajektorii kolem
hlavy (čelistí) pacienta tak, aby fokální (ohnisková) vrstva
daná kompenzací vzájemného pohybu rentgenky a filmu (či
zobrazovacího detektoru) procházela středem linie čelisti
podél celé její délky. Na obraze tak vzniká rozvinutý panoramatický
obraz celé čelisti. V nejjednodušším případě se
toho dosahuje pomocí jednoho motorku, avšak kvalitnější
panoramatické zobrazení se dosahuje u přístrojů se 2 či 3
motorky, které uskutečňují rotaci ve více osách s lepším
přizpůsobením tvaru čelisti. Nejlepší zaostření všech
míst čelisti se dosahuje u multifokálních OPG
přístrojů, kde se snímá větší počet obrazů v různých
fokálních vrstvách, s následným vyhodnocením.
¨ Dentální CT je zmenšenou obdobou
klasické cone-beam CT (zmíněné výše) se
zobrazovacími detektory velikosti cca 3´4¸15´15 cm. Někdy se kombinuje
panoramatický rentgen s dentálním CT do jednoho systému.
Dentální CT se uplatňuje v čelistní chirurgii, u zubních
implantátů a v diagnostice patologických lézí v dané
oblasti.
Radiační
zátěž pacientů při RTG vyšetření
Při RTG vyšetřeních je vnějším zdrojem záření
rentgenka, X-záření po průchodu tělem pacienta dopadá na
detektor (dříve film, nyní flat panel nebo prstenec detektorů
u CT), obraz vzniká rozdílnou absorpcí záření v tkáních.
Prošlá část X-záření vytváří obraz, absorbovaná část
záření způsobuje radiační zátěž v
těle. Pacient je ozařován jen po dobu snímání (akvizice) v
požadovaných projekcích. Čím větší je počet a velikost
snímaných projekcí, intenzita použitého X-záření a
expoziční čas, tím vyšší je radiační zátěž pacienta.
Při použití
současné moderní rtg techniky je obecně radiační zátěž
pacientů relativně nízká. Vysoká
citlivost zobrazovacích detektorů a digitální počítačové
zpracování obrazů umožňuje optimalizaci,
při níž lze získat kvalitní RTG obrazy při nízké
radiační expozicí.
Absorbovaná radiační dávka
D [mGy] při rtg vyšetření určité oblasti těla je v
zásadě dána součinem intenzity X-záření (ta je dána
proudem rentgenkou [mA]), expozičního času [s] a
příslušných koeficientů :
D = G . mAs .
Koeficient G v sobě zahrnuje řadu faktorů, jako je
účinnost produkce X-záření rentgenkou, jeho energii danou
napětím [kV] na rentgence, filtrace, vzdálenost, absorbční
koeficienty tkáně. Měří se pomocí fantomů, nejčastěji
vodou plněných "akvárií" (pro planární rtg), nebo
válců průměru 16cm (hlava) či 32cm (hrudník) pro CT,
opatřených ionizačními komůrkami, termoluminiscenčními
nebo polovodičovými detektory. Pravděpodobnost vzniku
biologických stochastických účinků je úměrná této absorbované
radiační dávce [mGy] a velikosti
ozářené oblasti [cm3].
V planární rtg diagnostice se toto
kvantifikuje pomocí veličiny plošné dávky DAP
(Dose Area Product) [mGy.cm2], což je součin vstupní dávky X-záření
a velikosti (plochy S) ozářeného pole: DAP = D . S. Efektivní
dávka Def [mSv] pro pacienta, vyjadřující účinky záření
na organismus jako celek, se pak vypočítá jako součin: Def = EDAP . DAP , kde
koeficient EDAP (regionálně normalizovaná efektivní dávka
[mSv mGy-1
cm-2]) v
sobě zahrnuje zprůměrované tkáňové (orgánové)
váhové faktory wT pro struktury v ozařované oblasti.
Pro měření radiační dávky pacientů při
planárním RTG zobrazení se používají speciálně
kalibrované radiometry, tzv. DAP-metry *),
měřící součin absorbované dávky a ozařované plochy (Dose
Area Product). DAP metr je tenká transmisní
planparalelní ionizační komůrka upevněná na
výstupní kolimátor (clonu) RTG přístroje, jejíž plocha
pokrývá celé (maximální) pole X-záření - obr.3.2.5 vlevo nahoře. Ionizační proud, vznikající při
průchodu X-záření z rentgenky směrem k pacientovi, po
příslušné kalibraci, udává plošnou dávku DAP, kterou
obdrží vymezené zobrazované pole pacientova těla.
*) Radiometry tohoto druhu se někdy
nazývají též KAP-metry, měřící součin
kermy ve vzduchu a ozařované plochy (Kerma Area Product).
Pro X-záření používané v RTG diagnostice jsou hodnoty kermy
a dávky prakticky totožné. Jak je
diskutováno v §5.1 "Účinky záření
na látku. Základní veličiny dozimetrie.",
pasáž "Expozice, kerma, terma",
mezi dávkou a kermou platí vztah D = K.(1-g), kde g je frakce
energie uvolněných nabitých částic, která se ztrácí při
radiačních procesech v materiálu. Pro diagnostické
X-záření činí hodnota g pouze zlomky procenta.
Součin kermy a plochy je integrál kermy
ve vzduchu přes plochu svazku v rovině kolmé k centrální ose
svazku. Hodnota součinu kermy a plochy je téměř nezávislá
na vzdálenosti od ohniska rentgenky (pokud
zanedbáme zeslabení záření ve vzduchu, zpětně rozptýlené
záření a příp. X záření vznikající mimo ohnisko).
U CT zobrazení se
radiační zátěž kvantifikuje pomocí veličiny délkové
dávky DLP (Dose Lenght Product) [mGy.cm], což
je součin absorbované dávky D a délky L
ozářené oblasti: DLP = D . L.
Efektivní dávka Def [mSv] pro
rentgenovaného pacienta, vyjadřující stochastické účinky
záření na organismus jako celek, se pak vypočítá jako
součin:
Def = EDAP . DAP pro planární zobrazení , nebo Def = EDLP . DLP pro CT
zobrazení ,
kde koeficienty EDAP či EDLP - regionálně normalizovaná efektivní dávka
[mSv mGy-1
cm-1]- v
sobě zahrnují zprůměrované tkáňové (orgánové)
váhové faktory wT pro struktury v ozařované oblasti (§5.1 "Základní veličiny dozimetrie",
pasáž "Radiobiologická účinnost záření").
Jakým způsobem se tyto
změřené expoziční parametry využívají ke stanovení
radiačních dávek a jejich optimalizaci při RTG
vyšetřeních, je stručně rozebíráno v §5.7 "Radiační zátěž při radiační diagnostice a
terapii".
Další
zobrazovací diagnostické metody. Hybridní zobrazovací
systémy.
RTG diagnostika je nejstarší a dosud
nejdůležitější zobrazovací metodou v medicíně. S
technickým pokrokem zvláště v oblasti elektroniky a
počítačové techniky se vyvinuly některé další
alternativní zobrazovací metody lékařské diagnostiky. Jsou
to: Ultrazvuková sonografie,
Nukleární magnetická rezonance,
Termografie; v poslední době se začíná uplatňovat i elektroimpedanční
zobrazení tkáně. Celá kapitola 4 pak podrobně popisuje další
důležitou zobrazovací metodu - Scintigrafii.
Tyto metody jsou z fyzikálního
hlediska porovnávány v §4.6 "Vztah scintigrafie a ostatních
zobrazovacích metod", kde je
diskutován i jejich diagnostický přínos a jejich vzájemná komplementarita
v algoritmu komplexní diagnostiky. V posledních letech se
stále častěji objevují hybridní zobrazovací
systémy, kombinující do jednoho přístroje rtg
zobrazení CT se scintigrafickým PET nebo SPECT zobrazením,
popř. s nukleární magnetickou rezonancí NMRI. A též hybridní
zobrazovací+ozařovací technologie v radioterapii
(§3.6 "Radioterapie", část "Modulace ozařovacích svazků", pasáž "Hybridní integrace
zobrazovacích a ozařovacích technologií").
Základní aspekty vyhodnocování a
získávání diagnostických informací z
obrazů zmíněných radiologických modalit jsou uvedeny v §4.7
"Vizuální
hodnocení a matematická analýza diagnostických obrazů" .
------------------------ Fyzikálně-technická
zajímavost ------------------------
Rentgenové dalekohledy
Shora rozebíraná rentgenová diagnostika je transmisní
metodou, založenou na průchodu X-záření vyšetřovaným
objektem. X-záření je zde prostředkem, jak analyzovat
strukturu vyšetřovaného předmětu. Existují však situace,
kdy potřebujeme primárně vyhledat a zobrazit samotné
zdroje X-záření, jejich polohu a distribuci v
prostoru. A to "na dálku", ať již malou (analytické
a vyšetřovací metody materiálů), nebo velkou (odhalování
zdrojů X-záření ve vesmíru) - provádět rentgenovou
teleskopii.
Dalekohledy pracující v oboru rentgenového
záření musejí mít úplně jinou optiku než normální
teleskopy pro viditelné světlo. V optickém teleskopu jsou
použity sférické či parabolické čočky a zrcadla, na něž
dopadají světelné paprsky pod velkým úhlem (téměř kolmo)
a lámou se nebo odrážejí tak, že se sbíhají a protínají
v blízkosti ohniska, kde vzniká obraz. Pro X-záření nejsou
čočky použitelné vůbec. Za určitých okolností je
použitelný odraz na zrcadle, avšak na odraznou plochu zrcadla
musí paprsek dopadat pod velice malým úhlem,
téměř tečně. Vzhledem k vysoké energii fotonů a krátké
vlnové délce X-záření musejí rentgenové paprsky dopadat
velmi šikmo, prakticky "klouzat" po povrchu, neboť
při dopadu pod většími úhly (nebo dokonce kolmo) by fotony
X-záření pronikly pod povrch zrcadla a interagovaly by
individuálně s elektrony a s atomy jeho materiálu (fotoefektem
nebo Comptonovým rozptylem, viz §1.6 "Interakce
záření gama a X") - část by
prošla, většina by se v něm pohltila; žádné zobrazení by
nevzniklo. Při velmi šikmém dopadu se z pohledu fotonu
geometricky zvětší počet volných elektronů v kovovém
povrchu na jednotku délky (efektivně se zvětší elektronová
hustota), takže foton X-záření bude interagovat
kolektivně s velkým počtem volných elektronů,
podobně jako je tomu při odrazu světelné vlny od kovového
povrchu: elektromagnetická vlna-foton se podle zákonitostí
elektrodynamiky odrazí od kovového povrchu pod
stejným úhlem jako byl úhel dopadu. Nebo z pohledu odrazné
plochy se efektivně prodlouží vlnová délka přilétajícího
záření (její průmět), které se proto bude chovat podobně
jako světlo. Je to trochu podobné jako když hodíme kámen
velmi šikmo, téměř rovnoběžně, s vodní hladinou a on se
odrazí, příp. několikrát poskakuje po hladině. Tento
mechanismus však v praxi funguje pouze u měkkého
X-záření, do cca 30keV.
Obr.3.2.13. Princip zrcadlového rentgenového teleskopu
Rentgenová optika je tedy založena na
téměř tečném dopadu, kdy paprsek
X-záření dopadá téměř rovnoběžně s povrchem, jen tehdy
se odrazí. Takové odrazné povrchy musejí být velmi přesné
a hladké, jejich "drsnost" nesmí převyšovat
tisícinu mm. Rentgenový teleskop se skládá z jednoho nebo
několika velmi přesně tvarovaných souosých kovových
povrchů, skloněných pod velmi malým úhlem vzhledem
k optické ose systému (obr.3.2.13). Tato odrazná plocha může
mít kuželový tvar, ale optimální optické vlastnosti
poskytuje kombinace paraboloidu a hyperboloidu. Odrazné plochy
jsou uspořádány téměř rovnoběžně s dopadajícími
paprsky, které se proto odrážejí pod velmi malým úhlem -
nejprve od paraboloidu a vzápětí od hyperboloidu - do
ohniskové roviny, kde na základě geometricko-optického
zákona odrazu vytvářejí obraz rentgenového zdroje, od
něhož X-záření přišlo. Zde je záření snímáno
detektory. Dokonalejší typy rentgenových teleskopů jsou mnohozrcadlové,
sestávají z celé řady velmi přesně tvarovaných, pečlivě
seřízených a do sebe zasazených souosých parabolických a
hyperbolických zrcadel. Středová část systému je vycloněna
materiálem absorbujícím X-záření.
Rentgenové teleobjektivy tohoto druhu
konstruoval v 60.-90.letech především R.Giaccomi se svými
spolupracovníky. Stále je zdokonalovali a instalovali je na
kosmické družice: UHURU v r.1970, HEAO-2, Chandra v r.1999.
Pomocí těchto přístrojů bylo odhaleno mnoho rentgenových
zdrojů ve vesmíru - rentgenové dvojhvězdy, zbytky supernov,
neutronové hvězdy, aktivní jádra galaxií, oblaka
ionizovaného plynu v kupách galaxií (o
X-záření z vesmíru a jeho vzniku viz §1.6, část "Kosmické záření", pasáž "Kosmické X a gama
záření"). Současné rentgenové
teleskopy dosahují velmi dobré úhlové rozlišení (<0,5
obloukové vteřiny), spektrální (energetické) rozlišovací
schopnosti (1eV), i vysoké světelnosti a citlivosti k
X-záření i vyšších energií. Jsou základními nástroji
tzv. rentgenové astronomie.
V oblasti ještě kratších vlnových délek, tj. vyšší
energie fotonů, na rtg teleskopy navazuje problematika gama-teleskopů,
stručně rozebíraná na konci §4.2, část "Gamakamery
pro vysoké energie").
3.3.
Radiační měření mechanických vlastností materiálů
Vlastnosti interakce různých druhů ionizujícího záření s
látkou poskytují řadu možností bezdotykového
nedestruktivního měření některých mechanických a
strukturních vlastností různých předmětů a materiálů.
Většina těchto metod pracuje v experimentálním
uspořádání schématicky znázorněném na obr.3.1.1a,b v
§3.1. Analyzovaný předmět nebo vzorek je ozařován
vhodným druhem záření, přičemž se pomocí detektoru
měří ovlivňování tohoto záření analyzovaným
předmětem.
Radiační
měření tloušťky a hustoty
Prozařujeme-li materiál s danou hodnotou lineárního
součinitele zeslabení m, je absorbce a zeslabení záření exponenciálně
závislé na tloušťce materiálu - viz pasáž
"Absorbce záření v látkách" v §1.6 "Ionizující záření".
Změřením absorbce záření lze tak bezdotykově
stanovit tloušťku materiálu a její změny (v základním
uspořádání podle obr.2.8.1 vlevo). Pro tenké lehké
materiály jako je papír či plastové fólie je vhodné
prozařování zářením beta, zdrojem mohou
být radionuklidy 90Sr+90Y (tvrdší záření b Eb=0,546+2,27MeV,
hmotnostní polotloušťka absobce d1/2=90mg/cm2, vhodné pro tlustší vrstvy), 85Kr (Eb=670keV, d1/2=23mg/cm2), 147Pm (Eb=224keV, d1/2=5mg/cm2).
K měření hutnějších materiálů (jako jsou kovy) se
používá g-záření, emitované např.
radionuklidy 241Am (60keV), 137Cs (662keV), 60Co (1173+1332keV). Těmito metodami lze proměřovat
(skenovat) příslušné předměty, nebo i na běžícím páse
průběžně sledovat tloušťku vyráběné fólie či
válcovaného hutního materiálu.
Zeslabení záření při průchodu látkou je též
výrazně závislé na hustotě sledovaného
materiálu. Při známé (konstantní) tloušťce materiálu
můžeme na základě zeslabení svazku procházejícího
záření sledovat hustotu materiálu a její změny. Hustoměry
tohoto druhu nacházejí uplatnění např. při monitorování
dopravy látek potrubím (v chemickém či potravinářském
průmyslu) či pásovými dopravníky (úpravny uhlí,
dávkování složek v metalurgii a pod.).
Pozn.: V případě, že měřený vzorek
je přístupný jen z jedné strany, využívá se někdy pro
měření tloušťky a hustoty rozptylové metody:
předmět se ozařuje svazkem záření a sleduje se intenzita
Comptonovsky zpětně rozptýleného záření (obr.2.8.1
uprostřed), která je závislá na tloušťce a hustotě
materiálu. Tak je tomu u stěn potrubí, kotlů a uzavřených
nádob, či ve vrtech (karotážní měření). Přesnost a
citlivost těchto rozptylových metod je ovšem nižší než u
metod transmisních.
Radiační
hladinoměry
Radionuklidové hladinoměry určují výšku sloupce
kapaliny na základě zeslabení svazku záření g kapalinou podle
toho, zda záření prochází kapalinou nebo vzduchem. Vedle
kapalin se takto dají monitorovat i sypké materiály. Tato bezkontaktní
metoda má svůj význam tam, kde se jiné metody nedají snadno
použít - např. v přetlakových a podtlakových nádobách,
nebo u kapalin agresívních či zahřátých na vysokou teplotu.
Nejčastěji se používají g-zářiče s radionuklidy 137Cs (662keV) a 60Co (1173+1332keV), popř. 241Am (60keV).
Geometrické uspořádání zářiče a detektoru je
nejčastěji horizontální, kdy zářič a
detektor jsou umístěny po stranách nádrže proti sobě a
detekují úroveň hladiny (v
nejjednodušším případě se používá jeden zářič a jeden
detektor, jehož odezva po zesílení spíná kontakty relé při
dosažení hladiny k měřenému místu).
Při vertikálním uspořádání jsou zdroj a
detektor pod a nad nádrží, takže zeslabení záření při
průchodu sloupcem kapaliny je exponenciálně závislé na
výšce hladiny v nádrži; výšku hladiny lze sledovat
kontinuálně.
Neutronové
měření vlhkosti
Tato metoda je založena na pružném rozptylu
rychlých neutronů na jádrech vodíku
(obsažených ve vodě), které ze všech prvků nejúčinněji
rozptylují a zpomalují neutrony. Měřič vlhkosti je tvořen
zdrojem rychlých neutronů (většinou 241Am ve směsi s beryliem, aktivita cca stovky MBq až
jednotky GBq) a detektorem pomalých neutronů (viz §2.6). Lze
použít buď uspořádání prozařovací, kde
se měří zeslabení toku neutronů ze zdroje vlivem jejich
rozptylu na jádrech vodíku, nebo odrazové,
kde se měří vzrůst toku zpomalených neutronů v důsledku
jejich rozptylu v okolním materiálu obsahujícím jádra
vodíku.
Neutronová metoda měření vlhkosti materiálů se
používá v řadě odvětví, např. v chemickém průmyslu,
stavebnictví, zemědělství, hornictví. Nejčastější je
použití pro měření vlhkosti sypkých materiálů
jako je zemina, písek, maltové směsi, rudy, uhlí a koks,
obilí atd.
Pozn.: Odezva toku
neutronů je dána celkovou objemovou vlhkostí. Pokud
je potřeba stanovovat hmotnostní vlhkost, používají
se někdy kombinované neutronové+gama sondy
obsahující neutronový zdroj i zdroj g-záření (např. 137Cs) a detektor
neutronů i detektor g (bývá často sloučeno do jedné kompaktní sondy). Z
odezvy na záření g lze stanovit hustotu materiálu, z neutronové odezvy
jeho vlhkost; přepočet objemové vlhkosti na hmotnostní
vlhkost pak může být realizována elektronicky ve
vyhodnocovací jednotce přístroje.
Radiační defektoskopie
Další metodou, založenou na rozdílech v absorbci pronikavého
záření v látkách, je radiační defektoskopie.
Při odlévání, chladnutí, svařování, obrábění i provozu
výrobků a součástí strojů a zařízení, může docházet
ke vzniku nehomogenit, dutin, prasklin a podobných vnitřních defektů,
které zhoršují mechanické vlastnosti součástky a mohou
vést k poruchám strojních zařízení. Defektoskopie
obecně je metoda nedestruktivního zkoumání struktury
("defektů") v makroskopické konzistenci materiálu.
Radiační defektoskopie umožňuje nedestruktivní
analýzou nehomogenit v konstrukčních materiálech a
hotových výrobcích odhalit případné praskliny a jiné
anomálie. Základní schéma defektoskopického měření je
podobné jako u výše podrobně popsané rentgenové diagnostiky v medicíně. Analyzovaný předmět se ozáří
kolimovaným svazkem pronikavého záření X nebo g, přičemž
prošlé záření je zobrazováno na fotografickém filmu - radiografie,
nebo se zobrazuje na flourescenčním stínítku či
elektronickém detektoru do počítače - radioskopie.
Absorbce ionizujícího záření je závislá na tloušťce a
hustotě materiálu (viz exponenciální vztah v pasáži "Absorbce
záření v látkách" v
§1.6), takže zeslabená místa se projeví větším
zčernáním filmu.
Případná nehomogenita či prasklina se po
vyvolání zobrazí na filmu jako lokální defekt
v jinak homogenním zčernání emulze. Používají se filmy a
vývojky zajišťující co nejvyšší strmost křivky
zčernání, aby se dostatečně kontrastně zobrazily i
malé nehomogenity prošlého záření. Zčernání filmu se
hodnotí většinou vizuálně pomocí speciálních
prozařovacích lamp, příp. je lze vyhodnocovat fotometricky.
Nyní se již filmy postupně přestávají používat - prošlé
záření se snímá citlivým elektronickým detektorem.
Detektor, digitální polovodičový plochý zobrazovací
detektor (flat
panel), snímá intenzitu
gama či X záření, které materiálem projde a výskyt vady
(trhliny, dutiny a pod.) se projeví změnou intenzity
měřeného záření v daném místě.
Pro defektoskopii ocelových předmětů se
používá buď X-záření o energii cca 60-400keV z
technického rentgenu, nebo g-záření z vhodných radionuklidů - iridium 192Ir, selen 75Se, cesium 137Cs, kobalt 60Co,
ojediněle též tvrdé brzdné záření g o energii do 10MeV
produkované lineárním či kruhovým urychlovačem elektronů
(zabrzděním elektronů na terčíku). Tvrdé záření gama či
brzdné záření je třeba použít zvláště při
prozařování kovů (oceli) tloušťky větší než 100mm, kde
běžné rentgenové záření již nestačí. Pro radiografii
tenších vrstev je naopak vhodnější měkčí fotonové
záření, které poskytuje vyšší kontrast zobrazené
drobných defektů (z radionuklidů jse
vhodné zmíněné Ir-192 nebo Se-75).
Defektoskopie se uplatňuje především tam,
kde jsou kladeny vysoké nároky na kvalitu
materiálů a konstrukčních dílů. Jsou to např. potrubí
plynovodů, lopatky turbin, tlakové nádoby reaktorů, mostní
konstrukce atd.
Rentgenová
mikroskopie, mikro-CT
Pro strukturní analýzu drobných předmětů (jako jsou
elektronické součástky či drobné odlitky) se používají
tzv. mikrorentgeny. Speciální rentgenka má
velmi malé dopadové ohnisko (pouhých několik mikrometrů),
takže svazek X-záření vychází téměř z bodového zdroje a
poskytuje vysokou ostrost a rozlišovací schopnost obrazu.
Měřený vzorek se umísťuje velmi blízko k rentgence a film
či zobrazovací detektor do větší vzdálenosti - dochází k
projekčnímu zvětšení obrazu. Pro tento
účel se někdy používá rentgenových lamp s tenkou čelní
tzv. transmisní anodou (viz
§3.2, část "Rentgenky",
pasáž "Speciální druhy rentgenových trubic"), což umožňuje maximálně přiblížit zobrazovaný
předmět k ohnisku na anodě a tím dosáhnout velkého
zvětšení i při nepříliš velké vzdálenosti mezi
prozařovaným předmětem a zobrazovacím detektorem. Pro rtg
mikroskopii (XRM - X-ray microscopy) se používá
především měkké X-záření cca 20¸60keV. Fotony nízké
energie X-záření interagují s atomy vyšetřované látky
především fotoefektem, což poskytuje vyšší
kontrast absorbce mezi oblastmi i s malými rozdíly
denzity. Ve velkých speciálních laboratořích se k rtg
mikroskopii používá i velmi měkkého X-záření (cca 2¸10keV - v okolí
K- nebo L-hrany absorbčního spektra vyšetřovaného
materiálu, kde je největší kontrast absorbce a zobrazení) z undulátoru
synchrotronu (viz §1.5, část "Urychlovače
nabitých částic", pasáž
"Urychlovače jako generátory synchrotronového
záření"), s příp. použitím
krystalového monochromátoru a Fresnelovy zónové destičky,
fungující jako spojná čočka rtg optiky. Používá se buď skenovací
režim, nebo zobrazení pomocí speciálních pixelových
detektorů. Jedná se o velmi náročné laboratorní
metody!

Rentgenová mikroskopie se speciální mikrofokusovou rentgenkou
s transmisní anodou.
Pro detailní 3D analýzu drobných
předmětů se dále používá CT rentgenová tomografie
či mikro-tomografie (mCT), jejíž princip je
analogický jako u výše popsané medicínské rentgenové
tomografie (§3.2, část "Rentgenová
tomografie - CT"). Hlavní rozdíl spočívá v tom, že při měření
nerotuje rentgenka a detekční systém, ale mezi statickou
rentgenkou a zobrazovacím detektorem se otáčí zobrazovaný
předmět. Prošlé X-záření, měřené zobrazovacím
detektorem pro řadu různých úhlů otáčejícího se vzorku,
se rekonstruuje do obrazů příčných řezů, jejichž soubor
vytváří 3-D obraz analyzovaného objektu.
Bezpečnostní
kontrola materiálů
Na principu radiačního měření mechanických vlastností
(hustoty) materiálů je založena i rentgenová kontrola
zavazadel, používaná v posledních letech na
letištích. Na přepážkách příjmu zavazadel pro leteckou
dopravu jsou instalovány malé rtg přístroje - rentgenka a
protilehlý elektronický zobrazovací detektor, mezi nimiž
procházejí kontrolovaná zavazadla. Vzniklý absorbční obraz
se okamžitě promítá na displeji, někdy i s
"pseudo"barevným zobrazením (umělé přiřazení
barev stupním šedi), s cílem rozpoznat především kovové
předměty (jako jsou zbraně).
Rentgenová
difrakční analýza struktury krystalových mřížek
Dopadá-li
rentgenové záření na látku s krystalovou strukturou, dochází k difrakci části X-záření,
při níž se toto záření odráží od pravidelné struktury
krystalové mřížky - X-záření se pružně rozptyluje na
elektronech měřeného krystalu. Následně může docházet k interferenci
tohoto rtg záření. V difrakčním interferenčním obraze je
pak zakódovaná informace o vnitřní struktuře krystalu.
Při dopadu monochromatického X-záření
o vlnové délce l » 0,1 nm (srovnatelné
se vzdáleností mezi
ionty vytvářejícími krystalovou
mřížku) mohou
být paprsky v určitém směru zesíleny, v ostatních zeslabeny či vyrušeny. Rentgenové záření je
zesíleno a tvoří interferenční maximum, je-li splněna tzv. Braggova podmínka, aby dráhový úhel dvou
paprsků byl celočíselným násobkem vlnové délky záření:
n.l =
2.d.sinJ
, kde J je
úhel, který svírá dopadající paprsek s rovinou krystalu, d je vzdálenost mezi dvěma
sousedními rovinami krystalu (mřížková konstanta), l je vlnová délka použitého
rentgenového záření a n=1,2,3,... je celé číslo . Za této situace se intenzita rozptýlených vln sčítá.
Pro daný krystal s mřížkovou konstantou d je tedy interferenčního
maxima při difrakci dosaženo jen při určitých hodnotách l a J. Obvykle jsou
snímána úhlová spektra 1.řádu (n=1), kde je maximum
nejvýraznější, pouze pro rozlišení některých detailů se
analyzují spektra vyšších řádů (nízká
intenzita - výrazné prodloužení doby expozice).
Obr.3.3.2. Principiální uspořádání rentgenové difrakční
analýzy krystalových mřížek
Zařízení pro měření difrakce, tzv. difraktometr, je tvořen goniometrem,
v jehož středu je uložena analyzovaná látka a na jehož
jednom rameni je zdroj X-záření a na druhém rameni detektor
měřící intenzitu IX rtg záření. Otáčením goniometru se měří úhly J, pro něž je
detekována maximální intenzita IX "odraženého" X-záření, tj.
interferenční maximum, v reflexním režimu.
Ojediněle se používá i měření v transmisním režimu,
kdy se měří difrakce X-záření prošlého vzorkem. Popř.
zobrazení difrakčního obrazce na fotografickém filmu
nebo elektronickém zobrazovacím detektoru. Monochromátor
spojitého spektra X-záření je zařazen buď v primárním
svazku, nebo v cestě sekundárního difrakčního záření. Pro
detailní analýzu struktury monokrystalů se měří nezávisle
úhly rentgenky J1 a detektoru J1 a je zařazen další goniometr umožňující
otáčení vzorku i v kolmém směru (Bragg-Brentanův
difraktometr). V RTG mikrodifrakci se
používá rentgenka s mikrofokusem (její konstrukce byla popsaná výše v pasáži "Speciální
druhy rentgenových trubic" a použití v předchozím
odstavci "Rentgenová mikroskopie; mikro-CT"); v nejnáročnějších aplikacích i synchrotronové
X-záření (§1.5, část "Generátory synchrotronového
záření").
Rentgenová difraktometrie se využívá v řadě
oblastí materiálového výzkumu, především pro analýzu
krystalové struktury látek - jak monokrystalů (monokrystalová
RTG strukturní analýza), tak polykrystalických a
práškových materiálů (prášková rtg strukturní
analýza). Též při nedestruktivní analýze
archeologických a uměleckých předmětů.
Pozn.: Lze ji
též využít pro rozklad spojitého (polychromatického)
X-záření a získání monochromatické složky.
...............
Pozitronová
anihilační spektrometrie
Pozitronová anihilační spektrometrie slouží k analýze
lokálních elektronových hustot a konfigurací v látkách. Je
založena na spektrometrickém měření doby života
pozitronů v látce (PLS
- Positron Lifetime Spectroscopy).
Ozařujeme-li analyzovaný materiál pozitrony, rychlé pozitrony
se v látce na dráze několika mikrometrů (za
čas cca 10 pikosekund) zpomalí a za
normálních okolností mohou (přes
nestabilní pozitronium) anihilovat s
elektrony. Mohou však být zadrženy v místech strukturních
nepravidelností krystalové mřížky (pórech) a anihilovat se zpožděním
s elektrony z okolí. Abychom mohli stanovit dobu života
pozitronů, potřebujeme v prvé řadě detekovat okamžik
vzniku (vyzáření) pozitronu. To je možné tehdy,
když radioaktivní zdroj pozitronů synchronně emituje
i záření gama z excitované hladiny dceřinného
jádra.
Zkoumaný materiál se tedy lokálně ozařuje
smíšeným b+- g
zářičem (nejčastěji 22Na), přičemž doba života pozitronů se stanovuje na
základě měření zpožděných koincidencí
mezi detekcí fotonu záření g z ozařujícího
radionuklidu (u 22Na je to g 1274 keV) a detekcí anihilačního fotonu g 511 keV.
V případě
nejobvyklejšího použití b+- g zářiče 22Na detekční radiometrická aparatura sestává ze dvou
gama-detektorů (scintilačních či polovodičových):
1. Detektoru nastaveného na fotopík 1274keV
deexcitačního záření gama dceřinného nuklidu 22Ne. To je "startovací"
impuls časové koincidenční analýzy, indikující okamžik vzniku
pozitronu.
2. Detektoru nastaveného na 511keV
anihilačního záření, vznikajícího e-e+anihilací
pozitronu. To je "koncový" impuls
časové koincidenční analýzy, určující okamžik zániku
pozitronu.
V pevných látkách bez
strukturních defektů je doba života pozitronů cca 0,25ns, u
pozitronů anihilujících v defektech se prodlužuje na cca
0,75ns. Touto metodou je možné pozorovat defekty struktury
materiálu o velikosti cca 0,1 až 1nm - dislokace, vakance,
shluky vakancí, klastery, popř. precipitáty. Využívá se
při sledování technologie přípravy různých materiálů
(umělé hmoty, kovy, vodiče, izolanty, polovodiče) a též
při sledování vlivu prostředí a technologií na materiály (únava a "stárnutí" materiálů, teplotní
a radiační vlivy a pod.).
3.4.
Radiační analytické metody materiálů
Metody atomové a jaderné fyziky, jakož i vlastnosti různých
druhů záření, poskytují důležité nástroje pro analýzu
materiálového a prvkového složení různých předmětů.
Většina těchto metod pracuje v experimentálním
uspořádání ideově znázorněném již na úvodním
obr.3.1.1a,b v §3.1. Analyzovaný předmět nebo vzorek je
ozařován vhodným druhem primárního záření,
jehož interakcí s atomy či jádry vzniká sekundární
záření, které z materiálu "vynáší"
informace o jeho složení. Toto záření se detekuje
a analyzuje. Z velkého množství různých atomových,
jaderných a radiačních analytických metod uvedeme jen
určitý výběr těch typických a častěji používaných, s
akcentem na fyzikální podstatu, bez přílišných technických
podrobností.
Rentgen-fluorescenční
analýza
Tato metoda nedestruktivního zjišťování
chemického (prvkového) složení látek je založena na
měření sekundárního fluorescenčního charakteristického
rentgenového záření vzbuzeného primárním
ozařováním zkoumaného vzorku. Měřený vzorek ozařujeme
nejčastěji fotonovým zářením - buď X-zářením z
rentgenové lampy, nebo zářením gama z vhodného radionuklidu
- obr.3.4.1 (ozařování nabitými
částicemi zmíníme v závěru této pasáže). Interakcí tohoto fotonového záření s atomy
zkoumaného vzorku dochází k fotoefektu (viz
pasáž "Interakce záření gama " v §1.6
"Ionizující záření") většinou na slupce K
(pokud je energie záření vyšší než vazbová energie
elektronu na této slupce), načež při přeskoku elektronů z
vyšší slupky (L) na uvolněné místo dochází k emisi
charakteristického X-záření (série K), jehož energie je
jednoznačně určena protonovým číslem Z atomu.
Dojde-li k fotoefektu na slupce L, pak přeskokem
elektronů ze slupky M je vyzařováno charakteristické
X-záření série L.
Energie (spektrální čáry Kab)
fluorescenčního X-záření jsou charakteristické pro každý
prvek, množství emitovaných fotonů charakteristického
záření je přímo úměrné množství atomů daného druhu,
je tedy mírou koncentrace daného prvku. Spektrometrickou
analýzou energie (vlnové délky) takto vzniklého
fluorescenčního záření lze zjistit, které prvky
jsou přítomné ve zkoumaném vzorku a podle intenzity
jednotlivých píků fluorescenčního záření lze určit
množství (koncentraci) těchto prvků ve vzorku.
Metoda buzení charakteristického X-záření primárním gama
zářením se někdy označuje zkratkou XRF (gamma-induced
X-ray Fluorescent Emission).
 |
Obr.3.4.1.
Typické uspořádání zdroje záření, analyzovaného
předmětu a detektoru při rentgen-fluorescenční
analýze.
Vpravo nahoře je detailní struktura píků Ka,b charakteristického X-záření, změřená
polovodičovým Ge(Li) detektorem. |
Energie primárního
budícího záření g nebo X je nejvhodnější jen o něco vyšší než je
vazbová elektronů na slupce K (popř. L) v atomech
analyzovaných prvků; tehdy je nejvyšší účinný průřez
pro fotoefekt. Proto se používají různé ozařovací zdroje
pro lehčí, střední a těžké prvky. K ozařování
zkoumaných vzorků se tedy kromě rtg lampy používají pro
analýzu lehkých prvků radionuklidy vyzařující měkké
X-záření jako je železo 55Fe (X Mn L-série 5,9-6,5keV), curium 244Cm (X Pu L-série 12-23keV), pro středně těžké prvky americium 241Am (g 60keV), pro analýzu těžkých
prvků, jako je zlato, wolfram, olovo, uran a pod., pak kobalt 57Co (g 122+136keV), cesium 137Cs (g 662keV), cer 144Ce (g 140keV).
K detekci charakteristického X-záření se pro
jednodušší a orientační měření (jako je geologický
průzkum a vyhledávání rud, kontrola obsahu kovů v metalurgii
a pod.) používají scintilační detektory, avšak pro
přesnější a komplexnější laboratorní analýzu je třeba
použít polovodičový detektor s vysokým
rozlišením a mnohokanálový analyzátor. Při
kvantitativní analýze je třeba provést korekci na rušivé
comptonovsky rozptýlené záření g a samozřejmě též
pečlivou kalibraci zařízení.
Charakteristické X-záření má čtyři velmi
blízké energetické linie (související s jemnou strukturou
elektronových hladin K a L), které se označují jako Ka1,Ka2, Kb1,Kb2 - obr.3.4.1 vpravo
nahoře. Např. pro olovo jsou tyto energie 72.8,74.97, 84.8,87.3
keV, pro zlato 66.99,68.81, 77.9,80.1 keV, pro železo je energie
X-záření již jen 6.4 keV, pro hliník 1.5keV (u těchto
nízkých energií již prakticky není možné odlišit linie Ka a Kb). U
lehkých prvků je tedy energie X-záření velmi nízká a
obtížně se detekuje. Rtg.-fluor. analýza je proto vhodná
především pro zjišťování obsahu těžších prvků.
K buzení charakteristického X-záření se
někdy používá primární ozařování nabitými
částicemi, které ionizují atomy dané látky, s
následnou deexcitací a emisí X-záření. Metoda částicově-indukované
emise X-záření se označuje zkratkou PIXE
(Particle-Induced X-ray Emission). Obvykle se ozařuje
protony o energii cca 2-4 MeV, analyzuje se povrchová vrstva
vzorku do hloubky cca 5mm.
Rentgen-fluorescenční analýza má velkou
přednost v tom že je rychlá, přesná a reprodukovatelná,
nevyžaduje žádné chemické zpracování vzorků, které mohou
být ve všech skupenstvích. Zkoumaný materiál se nijak nepoškozuje
a nedochází ani ke generování umělé radioaktivity. Lze
zkoumat i celé předměty, bez nutnosti
odebírání vzorků - jedná se o metodu nedestruktivní.
Je proto vhodná m.j. i pro analýzu složení uměleckých
předmětů, což může pomoci jejich časovému či
autorskému zařazení, zjišťování původu, jakož i
ověření jejich pravosti.
Aktivační
analýza
Tato jaderně-analytická metoda je založena na
ozařování zkoumaného vzorku takovým zářením (druhem a
energií), které vstupuje do jader zkoumaných atomů a
způsobuje tam jaderné reakce. Při těchto
reakcích dochází jednak k emisi záření (především gama),
hlavně však z původně stabilních jader vznikají nestabilní
isotopy - radionuklidy, které se
následně rozpadají radioaktivní přeměnou a nebo b s následnou
emisí fotonů g. Měří se buď sekundární záření emitované při
vlastní jaderné reakci, především se ale proměřuje g-spektrum
emitované radionuklidy vzniklými jadernými reakcemi v
důsledku primárního ozáření. Analýzou tohoto spektra se
stanoví prvkové složení vzorku (kvalitativní a při potřebné kalibraci i
kvantitativní).
Neutronová aktivační analýza
NAA (zvaná též indukovaná či instrumentální
neutronová aktivační analýza INAA, viz níže) je vysoce citlivá metoda analýzy chemického
složení látek, založená na záchytu neutronů
(reakce n,g) v jádrech zkoumané látky, čímž vznikají
radioaktivní jádra (viz §1.3 "Jaderné reakce"): NAZ + n ® N+1B*Z; B* ® B + gP; N+1BZ ® N+1C*Z+1 + e-(b) + n; C* ® C + gD. Při reakcích jsou emitovány dva druhy záření
gama: okamžitě po záchytu neutronu je to záření gP, následně při radioaktivním rozpadu aktivovaných
jader je emitováno záření gD - dolní část
obr.3.4.2. Ozářením zkoumaného vzorku neutrony tak dochází
ke vzniku radionuklidů - k "aktivaci"
vzorku, načež spektrometrickou analýzou
energií a intenzit záření (především g) emitovaných z
aktivovaného vzorku lze stanovit příslušný radionuklid
a zpětně "dohledat" i jemu odpovídající
(neaktivní) výchozí nuklid
obsažený ve vzorku, jehož aktivací radionuklid vznikl
(obr.3.4.2). S použitím vhodné kalibrace lze stanovit též
jeho obsah (koncentraci) ve zkoumaném
materiálu.
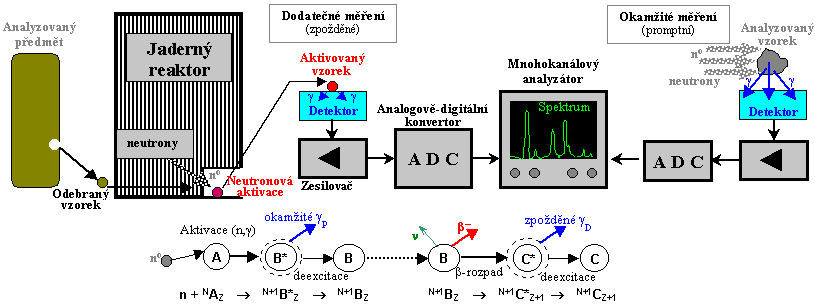
Obr.3.4.2. Typický postup při neutronové aktivační analýze.
Neutronové ozařování analyzovaných vzorků
se provádí buď v ozařovacích komůrkách v jaderném
reaktoru jak je ukázáno na obrázku (jaderný reaktor je mohutným zdrojem neutronů, viz
§1.3, část "Štěpení atomových jader"), nebo pomocí neutronů ze
speciálních urychlovačů, tzv. neutronových
generátorů (§1.5, část
"Urychlovače nabitých částic", pasáž "Neutronové
generátory"). V laboratorních
podmínkách a v terénu se používá i radionuklidových
neutronových zdrojů, tvořených směsí
alfa-zářiče s lehkým prvkem (např. a-radionuklidu 241Am ve směsi s
beryliem, dochází k reakcím a,n), či těžkým
transuranovým radionuklidem (nejčastěji kalifornium 252), při
jehož spontánním štěpení se uvolňují neutrony (§1.3, "Transurany"). Pro neutronovou
aktivační analýzu se používají především pomalé
neutrony o energiích cca 0,001-0,55 eV, které mají vysoký účinný průřez záchytu
mnohými jádry. Z neutronových zdrojů, poskytujících
většinou rychlé neutrony o energiích řádově MeV, se proto
neutronový svazek vede nejdříve do moderátoru
a ozařuje se teprve zpomalenými neutrony.
Pro komplexní NAA se detekce
záření gama z neutrony ozářených vzorků provádí
většinou polovodičovými g-spektrometry
s vysokým energetickým rozlišením (§2.5 "Polovodičové detektory"), aby bylo možno identifikovat přesné energie
gama záření a odlišit píky ležící často v těsné
blízkosti. Pro některé jednodušší aplikace, kdy např.
stačí změřit zastoupení jednoho či několika málo daných
elementů, lze použít i scintilační detektory
(které nemají tak dobré energetické rozlišení, ale mají
vyšší detekční účinnost - §2.4 "Scintilační detekce a spektrometrie
záření gama"). Jestliže se
měření aktivovaného vzorku rozšíří o současnou - koincidenční
- detekci dvou či více kvant emitovaného záření gama
pomocí dvou spektrometrických detektorů, označuje se metoda
jako koincidenční aktivační analýza CINAA (Coincident
INAA). Metoda je vhodná tehdy, když výsledkem aktivace
jsou radionuklidy s kaskádní deexcitací za
vyzáření dvojice kvant fotonů (jako je např. 60Co). Koincidenční
měření pak pronikavě snižuje pozadí rušivých impulsů.
Detekci lze případně kombinovat s polohově citlivými
detektory (jako jsou polovodičové pixelové detektory),
registrujícími měkké g-záření nebo nabité částice, především
elektrony b-, které
jsou emitovány aktivovanými jádry v koincidenci s fotony g. Tímto způsobem
lze zobrazit i prostorové rozmístění analyzovaného
prvku ve vzorku.
Z hlediska úpravy měřených vzorků se používají dva
způsoby aktivační analýzy:
¨ Instrumentální
aktivační analýza INAA, kde se ozářený vzorek přímo, bez
chemické úpravy, měří na g-spektrometru. Toto je nejjednodušší a
nejčastější způsob provádění NAA. V příslušném
zařízení bývá neutronový zdroj a g-spektrometr někdy integrován
v jednom kompaktním přístroji, který lze použít nejen v
laboratoři, ale i v terénu. Taková měření lze provádět i nedestruktivním
způsobem: Neutronovým zdrojem ozáříme analyzovaný předmět
nebo jeho část, změříme indukované záření g, načež můžeme
předmět vrátit do původního používání (pokud není příliš silně aktivován dlouhodobými
radionuklidy).
¨ Radiochemická
aktivační analýza RNAA, při níž se po ozáření vzorek
nejprve podrobí chemické separaci - buď pro
odstranění rušivých radionuklidů (které by mohly
přezařovat analyzované radionuklidy, či s nimi interferovat),
nebo pro zvýšení koncentrace požadovaných radioisotopů.
Tento způsob se používá méně často pro značnou pracnost a
laboratorní náročnost.
Z hlediska časového vztahu mezi ozařováním a měřením se
neutronová aktivační analýza rozděluje na dvě kategorie:
l Následná - zpožděná
gama-neutronová aktivační analýza DGNAA (Dellayed
Gamma-ray Neutron Activation Analysis), kde se měření
gama záření ze vzorku provádí po skončení neutronového
ozáření (jako je na obr.3.4.2 uprostřed). Měří se zde
"následné" (zpožděné) záření gD vznikající při b-radioaktivitě aktivovaných jader N+1BZ ® N+1C*Z+1 + e-(b) + n deexcitací vzbuzených
hladin dceřinného jádra: C* ® C + g. Toto je nejčastěji
používaná metoda vhodná tam, kde při neutronové aktivaci
vznikají radionuklidy s delším poločasem rozpadu (minuty a
delším).
l Okamžitá (promptní
*) gama-neutronová aktivační analýza PGNAA (Prompt
Gamma-ray Neutron Activation Analysis), kdy se měření
emitovaného g-záření provádí během neutronového ozařování
(obr.3.4.2 vpravo). Gama-spektrometrem se z ozařovaného vzorku
měří záření g dvojího druhu (původu): 1.
Okamžité fotony gP, vyzářené
zpravidla velmi rychle po neutronovém záchytu z excitovaných
hladin aktivovaných jader B*® B + g. 2.
Záření gD vznikající
následně při b-radioaktivitě aktivovaných jader N+1BZ ® N+1C*Z+1 + e-(b) + n deexcitací vzbuzených
hladin dceřinného jádra: C* ® C + g. Tento způsob je vhodný
tehdy, když neutronovou aktivací vznikají krátkodobé
radionuklidy (které by se během doby mezi ozářením a
měřením vzorku většinou rozpadly), nebo nuklidy stabilní,
či radionuklidy s čistým b-rozpadem nebo malým podílem g-záření (zde se pak
uplatní okamžité fotony gP vznikající po
radiačním záchytu neutronů). Promptní NAA spadá automaticky
do kategorie shora zmíněné instrumentální
aktivační analýzy.
*) Do této kategorie lze v jistém smyslu
zařadit i metodu neutrony stimulované gama emise,
kdy se vzorek ozařuje rychlými neutrony,
jejichž nepružným rozptylem dochází k excitaci jader
v analyzovaném vzorku. Při následné deexcitaci dochází k
emisi g-záření charakteristých energií
pro jednotlivé nuklidy. Spektroskopickou detekcí tohoto g-záření,
prováděnou v průběhu neutronového ozařování, lze stanovit
přítomnost a koncentraci příslušných prvků a jejich
isotopů. Tato metoda je experimentálně zkoušena i pro účely
in vivo gamagrafického zobrazení v medicíně (viz §4.3,
pasáž "Neutrony stimulovaná emisní počítačová
tomografie NSECT").
Neutronová aktivační analýza může
dosahovat mimořádně vysokou citlivost
(umožňuje detekovat i 10-12g prvku v 1g vzorku), takže je vhodná ke
zjišťování stopových množství látek,
např. obsah stopových prvků v tkáních rostlin a
živočichů, znečištění vod, čistota polovodičových
materiálů atd.
Pozn.: Pro
speciální účely biologického výzkumu se někdy používá i
neutronová aktivační analýza in vivo:
příslušná část organismu se ozáří neutrony (z reaktoru
nebo neutronového generátoru) a následuje gamagrafické
zobrazení distribuce indukované radioaktivity beta
(doprovázené gama), mapující rozložení zkoumané látky v
tkáních a orgánech.
Kromě aktivace pomocí neutronů se ojediněle
používá i protonová a gama-
aktivační analýza, při níž se k aktivaci jader
vzorku používají protony urychlené na urychlovači,
např. cyklotronu (způsobuje reakce
radiačního záchytu protonu [p,g], popř. reakce typu [p,n],
[p,d], [p,a]), nebo vysoce
energetické gama-záření (způsobuje
fotojaderné reakce [g,n], [g,p], při vyšších energiích může být z jádra
vyraženo i více částic [g,2n], [g,d], [g,2p], [g,a]), vznikající jako brzdné
záření elektronů urychlených v betatronu, mikrotronu či
lineárním urychlovači.
Mössbauerova
spektroskopie
Mössbauerova spektroskopie je nedestruktivní
analytická metoda založená na tzv. Mössbauerově jevu
rezonanční jaderné absorbce záření g - viz §1.6, část "Interakce
záření gama". Vzorek se
ozařuje monochromatickým zářením g a detektor měří
intenzitu prošlého nebo "odraženého" (rezonančně
rozptýleného) záření v závislosti na jemných změnách
energie záření g, která se v úzkém rozmezí mění v důsledku Dopplerova
jevu přesně regulovaným mechanickým pohybem
zdroje vůči vzorku pomocí lineárního motorku. Záření g musí mít energii
přesně odpovídající excitované hladině jádra zkoumaného
vzorku. Dopplerovým jevem se vykompenzuje ztráta energie
odražených jader, dojde k rezonanční absorbci
fotonů g, doprovázené maximem absorbce a
následně k emisi fotonu téže energie.
Tato metoda je použitelná na látky
obsahující takové prvky, které vznikají jako dceřinná
jádra vhodných radioisotopů a mají excitované hladiny
emitující záření g; zářením g z takového radioisotopu se vzorky ozařují. Jemná
poloha maxim absorbce je závislá na vlastnostech chemické
vazby, jichž se atomy obsahující analyzovaná jádra
účastní, na vlastnostech krystalové mřížky,
jakož i na vnitřních magnetických a elektrických polích v
krystalech. Analýzou jemné struktury Mössbauerova
spektra (což je závislost absorbce g na rychlosti
posuvu zdroje vzhledem k vzorku) lze tak stanovit některé vnitřní
chemické a fyzikální vlastnosti zkoumaného
materiálu.
Metoda je vhodná pro 57Fe, 57Co, 129In, 119Sn, 121Sb *). Používá se především na materiály
obsahující železo 57Fe. Umožňuje provádět analýzu
rozložení železa v materiálu v různých krystalografických
polohách, jeho oxidačního stupně, analýzu feromagnetických
materiálů, slitin, minerálů a pod. Pro analytické účely se
vzorky upravují do tenké fólie, nebo práškového stavu (o
hmotnosti několika gramů).
*) Počet vhodných prvků (jader majících vhodný radionuklid,
vyzařující záření g z vhodné excitované hladiny stabilního dceřinného
jádra) vhodných pro tuto analýzu je velmi omezený,
takže význam Mössbauerovy spektroskopie není srovnatelný s
takovými metodami jako je aktivační analýza,
rentgen-fluorescenční anylýza či defektoskopie.
Při Mössbauerově
spektrometrii železa se jako zdroj záření g používá
radionuklid 57Co, který se s poločasem 270 dní elektronovým
záchytem rozpadá na excitované jádro 57Fe. Toto jádro při deexcitaci emituje záření g o energiích
692keV (0,14%), 136keV (11%), 122keV (87%) a 14,4keV (9%).
Právě záření g dílčího přechodu z excitované hladiny o energii
14,4keV je díky nízké energii vhodné pro buzení rezonanční
jaderné absorbce. Vzhledem k vysoké Debyeově teplotě Fe
(360°K) probíhá Mössbauerův jev i za normální laboratorní
teploty, přičemž Dopplerův frekvenční posun, potřebný pro
kompenzaci odrazu jádra 57Fe, se dosahuje mechanickým posuvem zdroje rychlostí
pouze řádu 1mm/s.
Pozn.: Vysokou
citlivost Mössbauerova jevu rezonanční jaderné absorbce g-záření 14,4keV 57Fe využili v r.1960
R.V.Pound a G.A.Rebka ke změření gravitačního
frekvenčního posuvu v tíhovém poli Země, což bylo
významným testem správnosti Einsteinovy obecné teorie
relativity jakožto fyziky gravitace a prostoročasu - viz §2.4
"Fyzikální zákony v zakřiveném prostoročase" v knize "Gravitace,
černé díry a fyzika prostoročasu".
Hmotové spektrometry a separátory
Hmotové spektrometry a separátory, používané ve fyzikální
chemii a radiochemii, pracují v podobném uspořádání jako magnetický
spektrometr nabitých částic podle obr.2.6.1 vlevo -
viz §2.6, pasáž "Magnetické
spektrometry". Analyzovaná látka
je v ionizační komůrce ionizována, vzniklé kationty o
náboji e jsou elektrickým polem urychlovány a v
rychlostním filtru (tvořeném např. zkříženým elektrickým
a magnetickým polem) se selektují ionty s konstantní
rychlostí v. Ty pak vlétají vstupní štěrbinou do
magnetického pole intenzity (indukce) B, v
němž opisují kružnici o poloměru R = (v/e.B).m, úměrném
hmotnosti m. Ionty o různé hmotnosti opisují různé
dráhy a dopadají tím na různá místa základny - zařízení
tedy od sebe odděluje ionty o různé hmotnosti
(dané hmotností jádra). Změnou magnetického pole jsou
postupně do detektoru fokusovány ionty odpovídajících
hmotností - vzniká hmotnostní spektrum. V
hmotnostním separátoru je místo detektoru instalován vhodný
terčík, na němž se dopadající ionty vybrané hmotnosti
absorbují.
Magnetická hmotnostní spektrometrie je
náročná metoda pro nejpřesnější analýzu
zastoupení prvků a jejich jednotlivých
isotopů v analyzovaných látkách. Magnetická
hmotnostní separace umožňuje izolovat naprosto čisté
vzorky přesně definovaného izotopického
složení, ovšem jen ve velmi malých množstvích.
Ionizační
analyzátory plynů
Při průchodu ionizujícího záření (a nebo b) plynným prostředím je
absorbce a ionizace závislá na hustotě a složení plynu. Průtoková
ionizační komora s vestavěným zářičem a nebo b tak může
sloužit jako analyzátor pro kontrolu složení plynů.
Požární
hlásiče
Ionizační hlásič požáru
je tvořen dvěma elektrodami se vzduchovou mezerou. Záření a z nanesené
vrstvičky radionuklidu (nejčastěji 241Am, cca 30 kBq) vytváří mezi elektrodami ionizační
proud. Za přítomnosti kouře mezi elektrodami dojde ke změně
absorbce prostředí a tím ke změně ionizačního proudu, což
zaregistrují elektronické obvody požární signalizace.
Radiační detektor elektronového záchytu -
ECD
Pro detekci sloučenin s vysokou elektronovou
afinitou (jako jsou freony, chlorované pesticidy a
další halogenované sloučeniny) lze použít
radiační detektor elektronového záchytu (ECD - Electron
Capure Detector). Je tvořen ionizační komorou
válcového tvaru, naplněnou inertním plynem (např. argonem),
jehož jedna elektroda (katoda) je opatřena vrstvičkou
nízkoenergetického zářiče b, většinou 63Ni (aktivita cca
300MBq). Emitované záření b vytváří ionizaci atomů plynu, komorou protéká
určitý ionizační proud. Když do komory vstoupí plyn
obsahující atomy s vysokou elektronovou afinitou, tyto atomy
pohlcují elektrony v ionizovaném plynu a ionizační
proud komorou poklesne, což je elektronicky
registrováno. Takovéto komory jsou často používány jako koncový
detektor v kolonách plynové chromatografie.
Nukleární
magnetická rezonance - metoda analytická a zobrazovací
Nukleární magnetická rezonance
(NMR) je značně složitá fyzikálně-elektronická metoda,
založená na chování magnetických momentů atomových
jader při působení střídavého radiofrekvenčního
signálu v silném permanentním magnetickém poli. Tato
původně analytická metoda byla později zdokonalena a
rozvinuta i jako důležitá metoda zobrazovací.
Pozn.:
Nukleární magnetickou rezonanci jsme zařadili mezi jaderné a
radiační metody přesto, že v ní nefiguruje žádné
ionizující záření. Jedná se však o metodu založenou na
poznatcích jaderné fyziky - na vlastnostech
atomových jader. Fyzikální jev zvaný nukleární
magnetická rezonance - NMR, byl prozkoumán ve
40.letech (F.Bloch, E.M.Purcell) a byl zpočátku využíván v chemii jako vzorková
NMR spektrometrie. V 70. a 80. letech se začaly
vyvíjet i zobrazovací metody s použitím NMR (průkopníky byli P.Lauterbuer, P.Mansfield,
A.Maudsley, R.Damadian, r.1977) - viz
níže.
Pokusíme
se zde stručně nastínit principy a metodiku NMR. Vzhledem ke
značné principiální a technické komplikovanosti NMR
(v tomto s ní může částečně soupeřit jen scintigrafie)
však musíme dodržet maximální stručnost...
Fyzikální
princip NMR
Jev nukleární magnetické rezonance může obecně
nastávat při interakcích jader atomů s vnějším
elektromagnetickým polem. Každý nukleon (proton i neutron) má
vlastní "mechanický" moment hybnosti - spin
(nukleony patří mezi fermiony se spinem 1/2, viz §1.5 "Elementární
částice"). Tento rotační
moment hybnosti nukleonů podle zákonitostí elektrodynamiky
vytváří - indukuje - vlastní elementární
magnetický moment mp = 1,41.10-27J/T,
rovný 2,79- násobku tzv. Bohrova jaderného magnetonu
*) - podrobněji je diskutováno v §1.1,
pasáž "Kvantový moment hybnosti, spin,
magnetický moment", odstavec
"Magnetický moment". Atomová jádra díky
spinům svých nukleonů vzbuzují tedy velmi slabé magnetické
pole - mají určitý magnetický moment m. Spin a
magnetický moment mají však jen atomová jádra s lichým
nukleonovým číslem, neboť spiny a magnetické momenty
spárovaných protonů a neutronů se vzájemně ruší - jsou
nulové. Magnetický moment jádra je tvořen nespárovaným
nukleonem - protonem či neutronem. Magnetickou rezonanci lze
tedy pozorovat pouze u jader s lichými nukleonovými
čísly - především vodíku 1H, dále u 13C, 15N, 19F, 23Na, 31P atd.
*) Jaderný magneton mN je fyzikální
konstanta vyjadřující vlastní dipólový magnetický
moment protonu indukovaný jeho spinem: mN = e.h/2mp ,
kde e je elementární elektrický náboj (protonu,
elektronu), h je redukovaná Planckova
konstanta, mp je klidová hmotnost protonu. V
soustavě jednotek SI je jeho hodnota přibližně mN =
5,05.10-27J/T. Je analogický Bohrovu
magnetonu elektronu me = e.h/2me , který je však 1836-krát větší, v
poměru hmotnosti protonu a elektronu. Stojí za zajímavost, že
i neutron, ač elektricky nenabitý, má nenulový magnetický
moment mn=-0,966.10-27J/T
poněkud menší a opačného znaménka než proton. Ukazuje se,
že magnetický moment nukleonů má svůj původ v jejich
kvarkové struktuře (§1.5., část "Kvarková
struktura hadronů"a
§1.1, pasáž "Magnetický moment").
Magnetické
momenty jader v magnetickém poli
Za normálních okolností jsou vlivem tepelného pohybu atomů
směry spinů a magnetických momentů jednotlivých jader
chaoticky "rozházené", jejich orientace je náhodná
a neuspořádaná (obr.3.4.4a), elementární magnetická pole se
v průměru vzájemně ruší, v makroskopickém měřítku
látka nevykazuje žádné magnetické vlastnosti (nemáme zde na mysli feromagnetické látky, kde se
jedná o efekt elektronů v atomových obalech). Umístíme-li však analyzovanou látku do silného
magnetického pole (o intenzitě či indukci B
řádově několika Tesla), zorientují se magnetické momenty
jader do směru vektoru B tototo vnějšího
magnetického pole (aspoň částečně) - magnetický moment jader je rovnoběžný se
siločárami magnetického pole (obr.3.4.4b). Čím je
magnetické pole silnější, tím je toto uspořádání
dokonalejší *). Navenek se to projeví nenulovým vektorem
magnetizace M ve směru indukce vnějšího
magnetického pole B. Velikost vektoru
magnetizace je úměrná síle vnějšího magnetického pole B
a procentu souhlasně orientovaných mag. momentů jader v
látce. Dostatečně silné magnetické pole B
se nyní většinou realizuje pomocí supravodivého
elektromagnetu, jehož vinutí musí být trvale
chlazeno kapalným héliem (fyzikální
principy supravodivých magnetů jsou stručně rozebírány v
§1.5, část "Elektromagnety v urychlovačích", pasáž "Supravodivé
elektromagnety").
*) Míra tohoto uspořádání je však ve
skutečnosti velice malá! V běžně
používaných magnetických polích 1-3T se na každých 1
milion jader vodíku nachází ve stavu souhlasné orientace v
průměru jen cca 7-20 jader. Naprostá většina jader je v
důsledku tepelného pohybu orientována v různých směrech,
včetně protisměrného (vyjadřuje to Boltzmannův
rozdělovací zákon). V tomto smyslu je nutno obr.3.4.4b brát
jen jako symbolické schéma, na němž je zachyceno pouze těch
několik jader, které nabývají souhlasné orientace...
Jelikož běžná látka, např. voda nebo tkáň,
obsahuje v 1 gramu asi 1022 jader vodíku, i tak malý
přebytek počtu orientovaných jader poskytuje měřitelnou
velikost vektoru magnetizace a odezvového radiofrekvenčního
signálu.
Larmorova
frekvence, radiofrekvenční excitace a relaxace
V magnetickém poli B se jádra (s nenulovým
magnetickým momentem m) chovají jako magnetické dipóly, na které působí
dvojice sil m.B. To způsobí, že jádro bude osou
svého magnetického momentu rotovat kolem
směru B - bude vykonávat precesní
pohyb (podobný precesnímu pohybu
gyroskopu či dětské "káči" kolem svislého směru
v tíhovém poli) tzv. Larmorovou
frekvencí
wL = g.B , neboli fL = g.B/2p ,
kde g je
gyromagnetický poměr jádra, což je poměr
magnetického momentu jádra a jeho "mechanického"
momentu setrvačnosti [ rad·s -1
·T -1 ]. Precesní pohyb
vzniká při změnách vnějšího magnetického pole nebo
změnách úhlu magnetického momentu v tomto poli a trvá tak
dlouho, dokud se mag. moment neustálí v klidové poloze.
Vyšleme-li pomocí další cívky
(vysokofrekvenční - vf, neboli radiofrekvenční - RF) do takto
magneticky polarizované látky krátký střídavý elektromagnetický
signál (jehož frekvence rezonuje
s výše zmíněnou Larmorovou precesí fLdaného
druhu jádra v magnetickém poli), vychýlí
se směr magnetického momentu jádra dočasně ze
směru určeného vektorem B vnějšího
magnetického pole (obr.3.4.4c) *). Vychýlení vektoru
magnetizace je způsobenou magnetickou složkou excitačního RF
pulsu. Úhel tohoto vychýlení je úměrný amplitudě (energii)
RF pulzu a jeho době trvání. Nejčastěji se používají RF
pulsy 90° nebo 180°.
*) Splnění
rezonanční podmínky: Jádra jsou schopna
účinně přijmout energii ze střídavého elektromagnetického
pole jen tehdy, když Larmorova frekvence precese jádra a
frekvence elektromagnetického impulsu je stejná. Precedující
jádra tak s elektromagnetickým impulsem na dané Larmorově
frekvenci rezonují - odtud název "magnetická
rezonance".
Po odeznění tohoto excitačního signálu
dochází k relaxaci (za
stálé rotace Larmorovou frekvencí), při
níž se budou vyzařovat elektromagnetické vlny
s klesající intenzitou, dokud se magnetický moment po spirále
nevrátí zase zpět do směru B. Tyto
elektromag. vlny budou v přijímacích cívkách
indukovat střídavé napětí - "echo"
radiofrekvenční signál **). Tento relaxační signál (označovaný někdy zkratkou FID - Free
Induction Decay), má sinusový průběh s
exponenciálně klesající amplitudou (viz
níže Relaxační časy). Je to
užitečný signál, který nese informace o vnitřní struktuře
analyzované látky. Frekvence tohoto signálu
je rovna výše zmíněné Larmorově precesi a pro danou sílu B
vnějšího magnetického pole je určena gyromagnetickým
poměrem g jádra, tj. druhem
jádra, amplituda relaxačního
signálu je úměrná koncentraci jader daného
druhu - takto lze nukleární magnetickou rezonanci použít k analýze
složení látek: jaké prvky a v jaké koncentraci jsou
ve vzorku obsaženy. Např. pro jádra vodíku (protony) má
gyromagnetická konstanta hodnotu g = 2,675.10-8s-1T-1 a v magnetickém
poli o indukci 1Tesla Larmorova NM rezonanční frekcence činí
42,574MHz, při 1,5T je to 63,58MHz - oblast radiovln
(krátké vlny). Pro
těžší jádra je úměrně nižší.
**) Sfázování
velkého počtu jader: Přijímací cívky NMR
samozřejmě nejsou schopny zaznamenat relaxační vyzařování
jednoho či několika jader. K získání měřitelného signálu
je zapotřebí deexcitace velikého nmožství jader (>cca
1012), a
to synchronně a ve stejné fázi! Pokud dojde k
rozfázování, MNR signál prudce poklesne či vymizí (srov.
níže "Relaxační časy - T2).
Obecná pozn.: Kvantové chování: Z důvodu lepší
srozumitelnosti výkladu jsme zde zatím explicitně nezahrnuli kvantové
chování magnetického momentu, uvažovali jsme jeho kontinuální
chování. Orientace vektoru magnetického momentu jader v
magnetickém poli ve skutečnosti nabývají diskrétních
kvantových stavů - paralelně (0°), kolmo (90°) a
antiparalelně (protichůdně, 180°) se směrem vektoru B
magnetické indukce vnějšího magnetického pole. Základní,
energetickxy nejnižší stav je paralelní, zatímco kolmá nebo
antiparalní konfigurace má vyšší energii - excitovaný
stav. Ze základního do excitovaného stavu magnetického
momentu přecházejí jádra absorbcí kvanta
elektromagnetické enerie, která musí být přesně rovna
rozdílu energií mezi oběma stavy. Příslušná frekvence
odpovídá rezonanční Larmorově frekvenci. Při
deexcitaci se pak emituje elektromagnetický
signál o téže frekvenci. Precesní rotace magnetického
momentu jader v magnetickém poli je opět jen naše modelová
představa, jak názorně vysvětlit chování jader v
magnetickém poli...
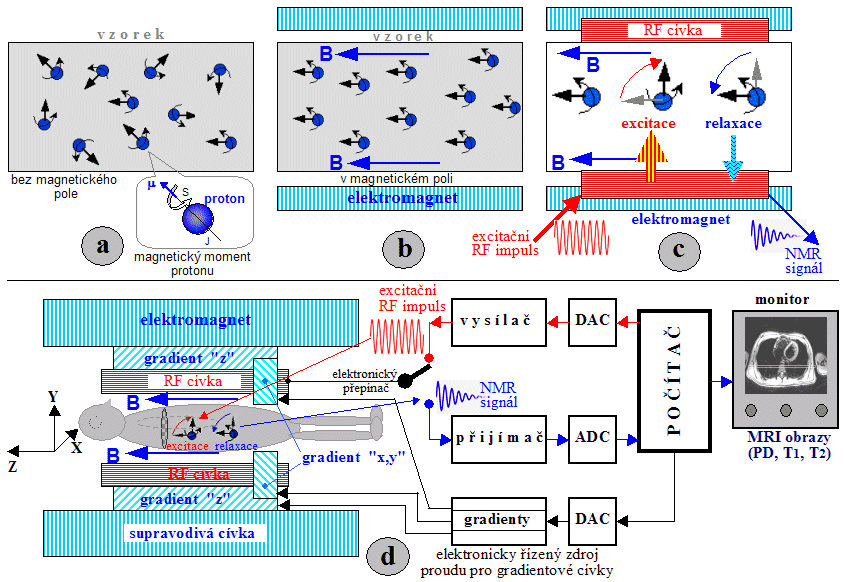
Obr.3.4.4. Nukleární magnetická rezonance -
zjednodušené schématické znázornění.
a) Magnetické momenty jader v analyzované látce mají
za normálních okolností chaoticky rozházené směry.
b) Působením silného magnetického pole B
se mag. momenty jader částečně zorientují do směru vektoru B.
c) Vysláním vf elektromagnetického pole se tato
zorientovaná jádra vychýlí ze směru B,
např. o 90°. Po vypnutí tohoto vf pole nastává relaxace,
při níž budou vychýlená jádra při svém návratu za
precesní rotace vysílat elektromag. NMR signál s
exponenciálně doznívající amplitudou.
d) Zjednodušené principiální schéma zařízení pro
NMR zobrazení. Pro jednoduchost je zakreslena jen jedna
radiofrekvenční (RF) cívka, která se elektronicky přepíná
střídavě do vysílacího a přijímacího režimu; většinou
bývají oddělené vysílací a přijímací RF cívky. (ADC=analogově-digitální konvertor,
DAC=digitálně-analogový konvertor).
Radiofrekvenční
cívky
RF cívky jsou jakýmisi "anténami"
NMR systému, které vysílají excitační RF
signály směrem do analyzované látky, anebo přijímají
odezvové RF signály z relaxujících jader v analyzované
látce. Jako vysílací a přijímací cívka může být v
zásadě použíta tatáž cívka, která se elektronicky
přepíná do vysílacího a následně do přijímacího režimu
(jak je symbolicky zakresleno na schématu
v obr.3.4.4d). Kvalitnější detekce
odezvového NMR signálu však lze dosáhnout použitím
oddělené (samostatné) přijímací RF cívky. Vzhledem k
poměrně vysoké Larmorově frekvenci (desítky MHz) mají RF
cívky velmi jednoduché provedení: jsou tvořeny smyčkou
drátu kruhového nebo obdélníkového tvaru, která se
umisťuje do blízkosti analyzovaného materiálu (vzorku, nebo
zájmové oblasti v organismu). Někdy bývají vhodně
tvarovány (ohýbány do sedlového nebo
válcového tvaru) pro dosažení lepší
homogenity RF signálu v analyzované oblasti.
Do vysílací cívky se v různých
časových sekvencích pouští krátký, ale velmi silný
radiofrekvenční střídavý proud, o vysoké amplitudě,
okamžitém výkonu až desítky kW. V přijímací cívce se pak
indukuje odezvový signál z relaxujících jader naopak o velmi nízké
amplitudě (řádově milivolty), který se pro další
elektronické zpracování musí výrazně zesílit
v úzkopásmovém vysokofrekvenčním zesilovači. Při NMRI
zobrazení (viz níže) se používají speciální přijímací
RF cívky různých velikostí a tvarů, aby těsně obepínaly
analyzovanou oblast - pro zobrazení mozku, kloubů, páteře
atd.
NMR
spektroskopie a analýza
NMR spektroskopie probíhá tak, že se zvyšuje
frekvence budícího vf signálu, tento signál přerušovaně
napájí cívky ve vysílacím režimu, nastane vždy přepnutí
do přijímacího režimu a měří se intenzita vf signálu - echa
- vysílaného vzorkem umístěným v magnetickém poli Bo při zpětné
relaxaci magnetických momentů jader. Frekvence,
při níž nastává rezonanční maximum, Larmorova
frekvence, určuje druh jádra (nejvyšší
je pro vodík - zmíněných 42,6MHz pro B = 1Tesla), intenzita
rezonančního maxima určuje koncentraci
příslušných atomů ve vzorku. Všechna jádra jednoho
isotopu, vložená do téhož magnetického pole, by sama o sobě
měla rezonovat při stejné frekvenci. Jsou-li však atomy
těchto jader součástí chemických sloučenin,
liší se rozložení elektronů v jejich okolí a tyto elektrony
způsobují elektromagnetické stínění jader.
Efektivní magnetické pole působící na jádro pak již není Bo, ale B
= Bo.(1-s), kde stínící faktor s, popisující
intenzitu stínění, jemně závisí na chemickém složení
analyzované látky. Tato změna efektivního magnetického pole
způsobuje ve spektru NMR signálu tzv. chemický posun
frekvence.
Dalším efektem, ovlivňujícím jemnou strukturu NMR
spektra, je vzájemná interakce jader sousedních atomů
zprostředkovaná valenčními elektrony. V důsledku těchto
interakcí se pozoruje rozštěpení rezonančních maxim
studovaných jader na 2-4 linie vzdálené o cca 20Hz - dochází
k multiplicitě signálu.
Detailní analýzou frekvencí, intenzit a multiplicit v NMR
spektru lze tedy získat informace o chemickém složení
a struktuře organických i anorganických
látek. Moderní NMR spektrometry jsou řízeny počítačem,
přičemž indukovaný NMR signál je analyzován s použitím Fourierovy
transformace.
Relaxační
časy
Po vypnutí vysokofrekvenčního budícího pole vychýlená
jádra v magnetickém poli relaxují - vracejí
se po spirálové dráze zpět do původního rovnovážného
stavu ve směru Bo (který si zde označíme jako osu "z"), což
se v přijímací cívce pozoruje jako volné doznívání
indukovaného vf signálu s exponenciálním poklesem amplitudy.
Rychlost této relaxace (resp. doba doznívání) je ovlivněna
interakcí jaderných spinů s okolními atomy a vzájemnou
interakcí mezi jadernými spiny. V signálu NMR je tak
zakódována i informace o okolních atomech a molekulách -
informace o chemickém složení a struktuře
látky. Doba doznívání rezonančního signálu se
charakterizuje dvěma relaxačními časy T1 a T2.
Relaxační doba T1, nazývaná
někdy spin-mřížková (název
pochází z původního používání NMR pro analýzu pevných
látek s krystalovou mřížkou),
představuje základní časovou konstantu relaxace
magnetických momentů jader z vychýlené polohy do
rovnovážné polohy ve směru permanentního magnetického pole.
Zachycuje rychlost, s jakou vychýlené jádro při relaxaci
odevzdává energii elektromagnetickým vlnám a okolnímu
prostředí, přičemž podélná magnetizace ve směru osy z
se k původní hodnotě Mo vrací podle exponenciálního zákona: MZ = Mo(1 - e-t/T1) . Definuje se jako
doba, za kterou podélná magnetizace při relaxaci dosáhne
(1-e)-násobku původní hodnoty Mo, přičemž signál poklesne na 63% (pokud byla
provedena excitace magnetického momentu jádra o 90°).
Relaxační doba T2, zvaná někdy spin-spinová,
vyjadřuje časovou konstantu, se kterou v důsledku vzájemné
interakce spinů a magnetických momentů sousedních jader,
vedoucí k defázování precesního pohybu magnetických
momentů, klesá magnetizace v příčném směru x-y: MXY =MXYo
e-t/T2.
T2 se definuje jako
čas, za který poklesne transverzální magnetizace MXY e-krát.
Pozn.: Přijímací cívka v MRI po
ukončení excitačního impulsu ve skutečnosti detekuje
kratší relaxační dobu značenou T2*. Kromě
relaxační doby T2 je způsobena strmějším poklesem
příčné složky materiálové magnetizace v důsledku
drobných změn v nehomogenitě magnetického pole,vedoucí k
desynchronizaci. U zobrazení MRI je tento jev většinou
negativní, lze jej vykorigovat či eliminovat u tzv. "spin
- echo sekvence" - viz níže.
Relaxační časy T1 a T2 jsou výsledkem vzájemného působení rezonujících
jader s jejich okolím a charakterizují chemické vlastnosti a
strukturu vyšetřovaného materiálu. Při medicínském
využití jsou často výrazně odlišné pro zdravou a
nádorovou tkáň.
V nejčastěji používaném vnějším
magnetickém poli 1,5 T mají relaxační časy T1 a T2 vody a některých lidských tkání (za
fyziologického stavu) následující přibližné hodnoty :
| Druh tkáně: |
voda |
krev
okysličená |
krev
neokysličená |
tuk |
svaly |
proteiny |
šedá hmota
mozková |
bílá hmota
mozková |
játra |
ledviny |
| T1
[ms] |
4300 |
1350 |
1350 |
250 |
880 |
250 |
920 |
780 |
490 |
650 |
| T2
[ms] |
2200 |
200 |
50 |
70 |
50 |
<= 1 |
100 |
90 |
40 |
70 |
Relaxační časy jsou
charakteristické pro různé látky a tkáně - závisí na
koncentraci jader, teplotě, velikosti molekul, chemických
vazbách. Z tabulky je vidět, že např. jádra vodíku pevně
vázaná v molekulách tuku či bílkovin relaxují mnohem
rychleji než protony slabě vázané v molekulách vody.
NMR
zobrazení - MRI
Metoda NMR sloužila původně jako analytická metoda
složení a struktury vzorků. Pokrok v elektronice a
počítačové technice v 70. a 80. letech umožnil použití
signálu NMR pro vytvoření obrazu hustoty protonů ve
vyšetřovaném objektu. Vznikla tak metoda NMR
zobrazení (NMRI - Nuclear Magnetic Resonance Imaging;
slovo "nuclear" se často vypouští a používá se
zkratka MRI) - obr.3.4.4d.
Aby bylo možné detekovat NMR signály separátně a lokálně
z jednotlivých míst vyšetřovaného objektu (organismu či
tkáně) a pomocí něho vytvořit zobrazení,
je třeba zajistit prostorově-geometrické kódování
souřadnic ve vyšetřovaném objektu. Toho lze
dosáhnout tím, že na hlavní konstantní homogenní pole Bo superponujeme
přídavné gradientní magnetické pole ve
směru osy X,Y,Z. Tato gradientní magnetická pole ve směru
každé osy X,Y,Z se vytvářejí příslušnou dvojicí gradientních
cívek. Změnami gradientného magnetického pole
dosáhneme toho, že k magnetické rezonanci bude docházet
pokaždé v jiném místě vyšetřovaného objektu. Tímto
gradientním magnetickým kódováním prostorových souřadnic
pak můžeme provádět NMR zobrazení.
Gradientní cívky
jsou "přídavné" elektromagnety umístěné ve
vhodných místech uvnitř hlavního silného elektromagnetu.
Jsou navinuté měděným drátem nebo kovovým páskem,
dimenzované pro poměrně vysoké proudy desítky i stovky
ampér. Gradientní cívky jsou v pulzních sekvencích napájeny
poměrně silným proudem (cca 500A) z elektronicky regulovaných
zdrojů, které umožnují rychlé a přesné nastavení síly a
směru buzeného magnetického pole - přídavného gradientního
pole. Produkují gradienty v rozmezí cca 20-100 mT/m. Aby MRI
zobrazení netrvalo enormě dlouhou dobu, je třeba aby rychlost
gradientních změn byla poměrně vysoká - dosahuje se cca
100-200 T.m-1.s-1; to vyžaduje určité
napětí (cca 50-300V) k překonání indukčnosti gradientních
cívek - napájecí zdroje gradientních cívek jsou poměrně
robustní (výkonové). Silné proudové nárazy v gradientních
cívkách při interakci s magnetickým polem vyvolávají mechanické
vibrace, což způsobuje značnou hlučnost při
MRI. Podélné gradientní cívy (ve směru Z) mají
závity navinuté ve stejném směru jako hlavní cívka, X
(gradient ve směru levo-pravém) a Y (gradient ve směru
nahoru-dolů) jsou tvořeny cívkami sedlového tvaru s kolmo
navinutými závity.
Všimněme si nejprve
podélného gradientního pole Bz(z) ve směru Z.
Jeho superpozice s hlavním mag. polem Bo způsobí, že
skutečná "místní" hodnota magnetického pole B
= Bo+Bz(z) bude záviset na souřadnici z: B
= B(z). Vyšleme-li do vzorku, umístěného v
tomto mírně nehomogenním gradientním magnetickém poli
vysokofrekvenční impuls určité frekvence f, bude se
signál magnetické rezonance vysílat atomovými jádry jen z tenké
vrstvy vzorku o souřadnici z, pro kterou je
splněna rezonanční podmínka f = g.B(z)/2p. Změnou frekvence f
vysokofrekvenčních excitačních impulsů, nebo intenzity
podélného gradientního pole Bz, se mění poloha z
vrstvy, v níž se vytváří odezvový signál magnetické
rezonance. Tímto způsobem se zachytí informace o závislosti
prostorového rozložení hustoty jader ve směru osy Z -
je dosaženo elektronicko-geometrického kódování této
souřadnice - vrstvy z.
Zobrazení prostorového rozložení hustoty jader v dané
vrstvě z v příčných směrech X a Y se
pak získá působením dalšího, příčného, gradientního
magnetického pole ve směru osy X a Y, čímž se zkoumaná
vrstva rozloží na elementární objemy - "pixely",
v nichž se zjišťuje závislost intenzity relaxačního NMR
signálu a též časy jeho doznívání. Změnou těchto
gradientních polí se získávají údaje pro jednotlivá místa
ve vrstvě z a jejich počítačovou rekonstrukcí se
získá obraz příčného řezu protonové
hustoty ve vyšetřované vrstvě z (obr.3.4.4d vpravo).
Elektronickou analýzou relaxačních časů NMR signálu se
zároveň vytvářejí i obrazy příčných řezů v
relaxačních časech T1 a T2
(označují se jako T1
či T2 - vážené
obrazy). Množina obrazů příčných řezů pro různé hodnoty
souřadnice z pak vytváří 3-rozměrný
tomografický obraz vyšetřované oblasti v protonové
hustotě a relaxačních časech v jednotlivých "voxelech".
Pomocí počítačové grafiky pak již lze vytvářet obrazy
libovolných řezů vyšetřovanou oblastí, které jsou jasově
modulovány v široké škále odstínů šedi (od bílé až po
černou), k odlišení struktury tkání a orgánů.
Základním předmětem zobrazení metodou NMRI
jsou vodíková jádra - zobrazení protonové
hustoty a relaxačních časů. Někdy se proto NMRI označuje
jako "vodíkové topografické zobrazení".
Intenzita takového NMR obrazu odráží v každém místě
především množství vody ve zkoumané tkáni
a charakter vazby a rozložení molekul vodíku v buňkách a
extracelulárním prostoru, jakož i rozložení tuku a
proteinů. Na základě těchto strukturních rozdílů mohou
být v MRI obrazech od sebe rozlišeny různé tkáně
- např. voda, sval, tuk, šedá a bílá hmota v mozku.
Obecně jsou na obrazech NMRI lokálně zachyceny
dvě základní informace:
1. Distribuce hustoty jader
vytvářejících nukleární magnetickou rezonanci -
nejčastěji protonové hustoty PD vodíku v
tkáni. Obrazy PD v podstatě zachycují anatomickou
stavbu tkání a orgánů, jsou do značné míry
podobné rentgenovým obrazům CT, které mapují elektronovou
denzitu tkání.
2. Distribuce relaxačních časů
T1 a T2 souvisejících s chemickým
složením a strukturním stavem
tkáně v jednotlivých místech. Takové obrazy se nazývají T1 a T2 - vážené.
O tom, do jaké míry bude ve výsledném obrazu
MRI zastoupena protonová hustota PD, časy T1 a T2 - jak a čím bude tento obraz modulovaný
- "vážený" - rozhodují pulsní
sekvence: časový sled vysílaných RF impulsů a
odezvových signálů "echa" (bude
podrobněji diskutováno níže).
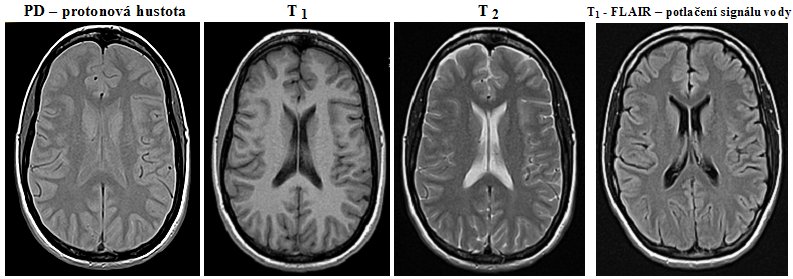
Obr.3.4.5 MRI obrazy mozku (transaxiální řez,
bez patologie) v protonové hustotě, relaxačních časech T1 a T2 a ve speciální sekvenci FLAIR pro potlačení
signálu vody.
(MRI obrázky mozku pořídil MUDr.
Jaroslav Havelka, vedoucí odd. MRI RDG ústavu FN Ostrava)
Protonové hustoty a zvláště
relaxační časy jsou jiné nejen pro různé
druhy tkání (viz výše uvedená tabulka), ale liší se i v
závislosti na fyziologickém či patologickém stavu téže
tkáně. To činí z NMRI zobrazení významnou diagnostickou
metodu v medicíně, včetně oblasti nádorové
diagnostiky.
Pozn.: Podobně
jako u rentgenové diagnostiky, i u NMRI se pro zvýšení
kontrastu zobrazení určitých struktur (např. dutin či cév)
používají kontrastní látky, avšak nikoli
na densitním, nýbrž magnetickém základě - feromagnetické
sloučeniny, většinou na bázi gadolinia.
Pulsní sekvence v
NMRI
U medicínského MR zobrazování je žádoucí vytvářet
snímky s dostatečně vysokým kontrastem mezi
různými druhy tkání, aby MRI radiolog mohl co nejlépe
odpovědět na danou klinickou diagnostickou otázku.
Optimálního kontrastu zobrazení mezi různými tkáněmi s
odlišnými densitami a rexačními časy lze dosáhnout vhodným
způsobem excitace magnetických momentů jader a následného
měření jejich odezvového MR signálu: nastavením parametrů
pulsní sekvence - časového sledu vysílaných
elektromagnetických budících impulsů RF a následných
měření "echa" elektromagnetického signálu
vydávaného relaxujícími jádry. Prvním parametrem je zde intenzita
(energie) vyslaného radiofrekvenčního excitačního pulsu (RF),
která určuje převážný úhel vychýlení (sklopení) vektoru
magnetizace analyzovaných jader - 90° nebo 180°. Čím
vyšší excitační intenzita se vyzáří do analyzované
cílové tkáně, tím vyšší je procento překlopení mag.
momentu jader a tím silnější je pak odezvový signál a více
času je potřeba pro relaxaci. Dalším parametrem je časový
interval TR, ve kterém opakovaně
aplikujeme jednotlivé radiofrekvenční excitační impulsy.
Čím kratší je tento interval, tím méně času je k T1
relaxaci. Třetím parametrem je čas TE (echo time) mezi excitačním
impulsem a detekcí odezvového rezonančního signálu. Čím
delší je tento čas, tím méně budou k měřenému
rezonančnímu signálu přispívat jádra s kratším
relaxačním časem T2. Zcela orientační hodnoty časů
pulsních sekvencí pro získání základních typů MRI obrazů
při B=1,5 T jsou:
PD: TR=1000 ms,
TE=5-30 ms ; T1-vážený:
TR=10 ms, TE=5-30 ms ; T2-vážený:
TR=1000-2000 ms, TE=80-100 ms .
V souvislosti s těmito zákonitostmi bylo
vypracovíno několik význačných sekvencí
vysílání excitačních radiofrekvenčních impulsů a
navazující detekce odezvových relaxačních signálů (v MR hantýrce se někdy nazývají "MRI
techniky") :
->
Saturation -
recovery sekvence, při níž se v pravidelných
intervalech vysílají 90° RF impulsy. Po příchodu každého
RF impulsu se vektor magnetizace otočí o 90° a začne relaxace
s různými časy T1
v různých tkáních. Když přijde další RF impuls, bude
z-složka magnetizace různá v různých tkáních. Vhodnou
opakovací periodou TR excitačních RF impulsů můžeme
nastavit optimální kontrast požadovaných tkání v časech T1. Tato nejjedenodušší MRI
technika se nyní používá již zřídka, byla nahrazena níže
uvedenou inversion-recovery sekvencí, poskytující
vyšší kontrast.
->
Spin - echo
sekvence, sestávající z 90° RF impulsu, po němž následuje
180° RF impuls. Po překlopení vektoru magnetizace do roviny xy
vlivem 90°RF impulsu nastupuje T2 (resp. T2*)
relaxace, při níž dochází k rozfázování. Následný
180°RF impuls však působí "refokusačně" -
překlopí jednotlivé spiny v rovině xy o 180° a spiny se
opět sfázují. Výsledkem je echo-signál v přijímací
cívce, jehož amplituda je závislá na relaxačních časech T1 a T2 tkáně (nepříznivý T2* se zde
neuplatňuje, neboť vliv nehomogenity mag. pole na
rozfázování se eliminuje při sfázování 180° impulsem). Charakter a kontrast zobrazení lze nastavovat pomocí
časů TR a TE . Při krátkém TR i krátkém TE dostaneme T1-vážený obraz, dlouhý TR a
krátký TE poskytne obraz protonové hustoty, dlouhý TR a
dlouhý TE poskytuje T2-vážený obraz. Vzhledem k této variabilitě
možností zobrazení je spin-echo nejčatěji
používanou MRI technikou.
->
Inversion - recovery
sekvence, tvořená sekvencí 180° a následujícího 90° RF
impulsu. Úvodní 180° puls invertuje vektor
magnetizace na opačný, načež probíhá T1 relaxace. S časovým odstupem TI -
doba inverze pak následuje 90° RF impuls, který
překlopí vektor magnetizace do roviny xy. V přijímací cívce
je detekován vf signál závislý na T1 relaxačním čase zobrazované tkáně. Kontrast
obrázku lze vhodně nastavit pomocí času TI. Lze dosáhnout
podstatně kontrastnějšího zobrazení než u saturation
recovery techniky.
Speciálním nastavením času TI = T1.ln2 se dosáhne potlačení obrazu
tkáně, která má tento relaxační čas T1. Nastavením krátkého inverzního času TI (cca 140ms
při magnetu 1,5T) - tzv. short time inversion recovery
STIR - se v obraze dosáhne potlačení signálu
tuku. Naopak prodloužením času TI (na cca 2600ms) - fluid
attenuation inversion recovery FLAIR - můžeme
dosáhnout potlačení signálu vody. Na takto
"očištěných" obrazech lze pak lépe posuzovat
ostatní jemné detaily a anomálie ve struktuře
vyšetřovaných tkání.
->
Gradient - echo
sekvence začíná 90° RF impulsem (který sklopí vektor
magnetizace do roviny xy), po kterém se aplikuje gradient
magnetického pole. Jádra v sousedních atomech tak budou
vykazovat precesi s mírně odlišnou Larmorovou frekvencí, což
způsobí rozfázování spinů. Následuje aplikace druhého
mag. gradientu s opačným znaménkem, který znovu sfázuje
spiny a v tomto okamžiku se měří echo. Používá se pro
získání T2-váženého
obrazu.
->
..........
sekvence ............?doplnit další sekvence?...........?doplnit
obrázek grafického diagramu sekvencí?...
Počítačovou analýzou MRI obrazů, získaných
s vhodnými sekvencemi (zmíněnými
výše), lze vytvářet speciální
modulace obrazů - jako je zobrazení s potlačením
signálu vody či tuku. Další speciální sekvence
se používají pro funkční MRI (zmíněnou
níže):
->
Susceptibility weighted imaging (SWI)
zobrazuje tkáně s mírně rozdílnou magnetickou
susceptibilitou. Používá k tomu prodloužených gradient-echo
sekvenci pro zobrazení v T2*.
Její hlavní variantou je Blood
oxygenation level dependent (BOLD), viz
níže fMRI.
->
Diffusion weighted imaging (DWI) zobrazuje difuzi vody uvnitř elementů
tkáně, projevující se Brownovým pohybem molekul. Používá
se spin-echo sekvence s aplikací 2 gradientů, registruje se
subtilní efekt, při němž Brownovsky pohybující se molekuly
vody vykazují odlišný vztah fázování-defázování při
obrácení mag. gradientu; vede to k nepatrně slabšímu T2 signálu.
Magnetická
rezonanční spektrometrie MRI
Zobrazení magnetickou rezonancí MRI může být doplněno magnetickou
rezonanční spektrometrií (MRS), popsanou výše,
která toto vyšetření obohacuje o další fyziologické
informace. Pomocí analýzy chemického posuvu
Larmorovy frekvence se zde provádí chemická analýza
zobrazovaných struktur in-vivo, např. úroveň cholinu či
lipidu. Chemické posuny jsou velmi jemné, takže tato metoda je
náročná nejen z hlediska signálové analýzy, ale je
zapotřebí i vysoké intenzity (dopručuje se min. 3 T) a
homogenity magnetického pole.
Funkční
zobrazování magnetickou rezonancí - fMRI
Magnetická rezonance může být vhodnou metodou pro
neinvazívní zobrazování funkce různých
tkání a orgánů (spolu s "molekulárním"
zobrazováním v nukleární medicíně - .....). fMRI zatím
nalezla uplatnění hlavně při funkčním zobrazování
mozku, mapování neuronální aktivity.
Neurony (které nemají vnitřní zásoby
energie) potřebují pro svou zvýšenou
aktivitu rychle obdržet cukr a kyslík. Hemodynamická odezva na
tuto potřebu způsobí jednak zvýšení krevní perfúze v
daném místě, hlavně však větší uvolňování kyslíku z
krve, než u neaktivních neuronů. To vede ke změně
relativních úrovní okysličeného oxyhemoglobinu a
neokysličeného deoxyhemoglobinu v krvi v místech neuronální
aktivity.
Z tohoto hlediska se používají dva základní
způsoby nepřímého mapování neuronální aktivity:
-
Lokální zvýšení perfúze
v místě zvýšené neuronální aktivity - perfúzní fMRI.
-
Změna poměru
okysličené a neokysličené krve v místě
neuronální aktivity. Metoda se nazývá BOLD fMRI (Blood
Oxygen Level Dependent). Změny relativních
úrovní oxy- a deoxy-hemoglobinu mohou být detekovány na
základě jejich mírně rozdílné magnetické susceptibility.
Základní hemoglobin bez navázaného kyslíku (deoxyhemoglobin)
má mírně paramagnetické vlastnosti, avšak pokud je
na něj navázán kyslík (oxyhemoglobin), chová se mírně diamagneticky.
Pokud se v určitém místě mozkové tkáně nahromadí více
deoxyhemoglobinu, získá se z něj poněkud silnější MRI
signál, než z míst, v nichž převažuje deoxyhemoglobin.
MRI funkční zobrazení mozku se provádí po neurologické
aktivaci, buď motorické (např.
pohyb prstů na rukou), zrakové, jazykové
nebo kognitivní .
Fyzikálně-elektronická
realizace NMRI
NMR zobrazení je nejsložitější
zobrazovací metodou. Činnost zařízení pro NMR zobrazení je
elektronicky značně komplikovaná a náročná, takže musí
být řízena výkonným počítačem s
důmyslným softwarem - obr.3.4.4d. V multiplexním
režimu je synchronně řízen proces vysílání
sekvence radiofrekvenčních impulsů, modulace gradientních
magnetických polí, snímání a analýza relaxačních
signálů magnetické rezonance, rekonstrukce a tvorba
výsledných obrazů, jakož i řada dalších transformačních
a korekčních procedur. Jelikož se jedná o harmonické
(sinusové) průběhy, provádí se snímání a rekonstrukce s
použitím Fourierovské analýzy - ve
frekvenčním tzv. K-prostoru. Je to soustava
matic vymezená v paměti vyhodnocovacího počítače MRI, do
jejchž jednotlivých elementů se nahrávají frekvence,
amplitudy a souřadnice MRI signálů. Z těchto
"surových" dat se s pomocí Fourierovy
transformace a dalších analytických metod vytvářejí
výsledné MRI obrazy.
Poznámka:
Na podobném principu jako NMR je založena i elektronová
paramagnetická rezonance (EPR). Zde se využívá
magnetických momentů elektronových obalů atomů.........
3.5.
Radioisotopové stopovací metody
Radioisotopové stopovací neboli indikátorové
metody slouží ke sledování skrytého pohybu a distribuce
hmoty uvnitř fyzikálních, chemických či biologických
soustav, nebo v různých technologických zařízeních. Do
soustavy se vpraví vhodná "značená" látka s
navázaným radionuklidem - tzv. radioindikátor,
jehož pohyb a chování v systému se pak sleduje na základě
detekce ionizujícího záření, emitovaného při
radioaktivních přeměnách jader v radioindikátoru. Pohyb a
distribuci radioindikátoru lze sledovat dvěma základními
způsoby:
- Odběr vzorků z
vhodných míst sledované soustavy, jejich úprava a
změření vhodným detektorem (g nebo b).
- Zevní detekce
vycházejícího záření g detektorem
umístěným do vhodného místa vyšetřovaného
systému (ojediněle uvnitř, většinou vně
sledovaného systému.
Radioisotopové stopovací metody se
využívají v řadě oborů vědy a techniky, průmyslu,
zemědělství a především medicíny. Jen stručně zde
zmíníme několik aplikací technických a obecně
biologických, podrobněji se níže zastavíme na aplikacích v
nukleární medicíně.
Radioisotopové
stopovací metody jako první vyzkoušel již v r.1913
chemik G.Hevesy, který zjistil, že radioisotopy mají shodné
chemické chování jako stabilní isotopy téhož
prvku. Na rozdíl od stabilních isotopů však radionuklidy
mohou být "viditelné" prostřednictvím pronikavého
záření, vznikajícího při přeměně jader.
Radioisotopová
scintigrafie a nukleární medicína
Nukleární medicína je obor zabývající se diagnostikou
a terapií pomocí radioaktivních
látek v otevřené formě, aplikovaných do
vnitřního prostředí organismu.
Radioaktivní isotopy reagují chemicky
stejně jako stabilní isotopy téhož prvku - proto se
v metabolismu organismu chovají stejně jako neradioaktivní
isotopy daného prvku. Avšak díky tomu, ža radioaktivní
isotopy jsou "viditelné" prostřednictvím
pronikavého záření, které vzniká při radioaktivních
přeměnách jejich jader, je možné sledovat pohyb a
metabolismus prvků a sloučenin, obsahujících
radionuklidy - radioindikátorů - v organismu a
tím vyšetřovat funkce jednotlivých orgánů.
V závislosti na orgánu, jehož funkce má být vyšetřena, se
označí specifická látka (radiofarmakum) vhodným
radioisotopem. Po aplikaci do organismu je pak sledován pohyb a
metabolismus této látky - buď zobrazením pomocí gamakamery,
nebo měřením odebraných vzorků (krve nebo moči).
Radioisotopová
diagnostika in vivo - scintigrafie
Při radionuklidové diagnostice in vivo
v nukleární medicíně se pacientovi aplikuje (většinou
intravenózně, někdy perorálně či inhalačně) malé
množství vhodné g-radioaktivní látky – tzv. radioindikátoru
či radiofarmaka. Použitý radioindikátor je specifický pro
jednotlivé orgány a druhy vyšetření. Aplikovaná
radioaktivní látka vstoupí do metabolismu
organismu a distribuuje se tam podle svého chemického
složení – fyziologicky či patologicky se hromadí
v určitých orgánech a jejich částech a následně se
vylučuje či přeskupuje. Z míst depozice radioindikátoru
vychází záření gama, které díky své pronikavosti
prochází tkání ven z organismu. Pomocí citlivých
detektorů měříme toto záření g a zjišťujeme tak
distribuci radioindikátoru v jednotlivých orgánech a
strukturách uvnitř těla.
Nejdokonalejšími zařízeními tohoto druhu jsou
gamakamery (scintilační kamery) – pomocí nich zobrazujeme
v záření g distribuci radioindikátoru v organismu. Tato metoda,
zvaná scintigrafie, tak umožňuje získávat informace
nejen anatomické, ale hlavně vypovídat o orgánových
funkcích a metabolismu. Matematickým vyhodnocením
scintigrafických studií můžeme získat křivky časového
průběhu distribuce radioindikátoru a vypočítat dynamické parametry
charakterizující funkci příslušných orgánů.
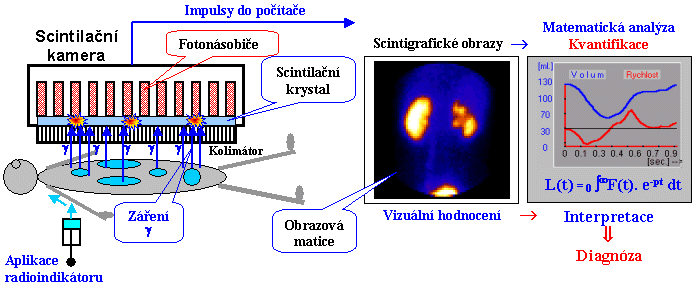
Schématické znázornění celého procesu
scintigrafického vyšetření - od aplikace radioindikátoru
pacientovi, přes proces scintigrafického zobrazení
gamakamerou, hodnocení, matematickou analýzu a kvantifikaci,
až po interpretaci a stanovení diagnózy.
Tomografická gamakamera SPECT
(Single Photon Emission Copmputerized Tomography) pomalu rotuje
kolem těla pacienta, snímá scintigrafické obrazy z různých
úhlů a pak pomocí počítačové rekonstrukce vytváří obrazy
příčných řezů (jsou to řezy kolmé na osu rotace
kamery), z nichž pomocí počítačové grafiky lze zkonstruovat
i prostorové (3-rozměrné) obrazy rozložení
radioindikátoru v orgánech uvnitř těla.
Tomografická gamakamera PET (Positron
Computerized Tomography) detekuje fotony anihilačního
záření gama (o energii 511 keV) vylétající v
protilehlých směrech při anihilaci pozitronů vyzařovaných b+ radioindikátorem aplikovaným pacientovi. Tyto fotony
anihilačního záření se koincidenčně detekují
prstencovým scintilačním detektorem a počítačovou
rekonstrukcí přímkových průmětů koincidenčních míst se
vytvářejí obrazy příčných řezů a příp. prostorové
3-rozměrné obrazy podobně jako u SPECT.
Nukleární medicína poskytuje specifické metody
pro vyšetření prakticky všech orgánů a spolupracuje tak s
širokým spektrem klinických oborů. Nejrozšířenější
využití je především v kardiologii, nefrologii,
neurologii, onkologii, tyreologii,
gastroenterologii.
Nukleárně medicínské metody patří mezi minimálně
zatěžující neinvazivní diagnostické vyšetřovací
metody. Díky vysoké citlivosti detektorů je pacientovi
aplikováno jen velmi malé množství radiofarmaka, které je
potřebné k získání kvalitní obrazové informace. Radiační
zátěž při metodách v nukleární medicíně je srovnatelná
(a často i menší) jako při RTG vyšetřeních *).
*) Při RTG vyšetření je zdrojem
ionizujícího záření přístroj a radiační dávka závisí
m.j. na počtu prováděných snímků, či na rozsahu oblasti
snímané při CT. U scintigrafie není zdrojem záření
diagnostický přístroj, ale samotný pacient, resp. jeho
vyšetřovaný orgán. Můžeme tedy pořídit libovolný počet
scintigrafických snímků, aniž by se změnila radiační
zátěž pacienta.
Radionuklidová scintigrafie je podrobně popsána v kapitole
4 "Radioisotopová
scintigrafie".
Radiačně navigovaná chirurgie -
sentinelové uzliny
Důležitou radioisotopovou stopovací metodou nukleární
medicíny je lokální radiační měření úzce kolimovanou
miniaturní detekční sondou záření gama v radiačně
navigované chirurgii při detekci tzv. sentinelových
uzlin. Při chirurgické léčbě nádorových
onemocnění je důležité odstranit nejen primární nádor,
ale pokud je to možné i další tkáně, do kterých by mohly
být infiltrovány nádorové buňky. Tyto nádorové buňky se z
primárního ložiska šíří především lymfatickými
cestami, takže jako první bývají zasaženy lymfatické
uzliny v okolí nádorového ložiska. Aplikujeme-li do
periferní části nádorového ložiska vhodný radioindikátor
koloidního skupenství (nejčastěji 99mTc nanokoloid, velikost částic cca 50-600 nm, aktivita
cca 40-150 MBq), bude se šířit lymfatickými cestami a zachycovat
a shromažďovat se v těch uzlinách, které jsou lymfaticky
spojeny s nádorovým ložiskem. První taková uzlina v
lymfatickém "povodí" nádorového ložiska se
nazývá sentinelová uzlina. Hromadění
radioindikátoru v uzlinách se dá zobrazit scintigraficky.
Nejdůležitější je však sledování radioindikátoru během
vlastního chirurgického výkonu, kdy pomocí kolimované
detekční sondy chirurg přímo v operačním poli může najít
sentinelovou uzlinu s obsahem radioindikátoru, a též u
vyoperované uzliny se přesvědčit, zda je v ní obsažen
radioindikátor.*)
*) Spolu s radioindikátorem se aplikuje
současně i modré barvivo (........), které rovněž proniká
do uzlin, takže chirurg může sentinelovou uzlinu rozpoznat i
podle modrého zabarvení.
Po aplikaci radioindikátoru se nejprve provede
scintigrafické zobrazení se zakreslením zobrazených uzlin,
pak pacient odchází k vlastnímu chirurgickému výkonu,
během něhož se používá detekční gama-sonda jednak k
peroperační detekci sentinelové uzliny, jednak k detekci
radioaktivity v již vyoperované uzlině. Dále následuje
histologické vyšetření sentinelové uzliny pro klasifikaci
typu tumoru, což pomůže optimalizovat další postup terapie.
Diagnostika in vitro. Radioimunoanalýza
- radiosaturační analýza
V nukleární medicíně se též používají
radioizotopové diagnostické metody in vitro, kde se
(neradioaktivní) vzorky pacientům odebrané analyzují
s využitím radioizotopových technik - radiochemických a
současně biochemických. Nejčastěji je to radioimunoanalýza
(RIA) či radiosaturační analýza
(RSA), která slouží k vysoce citlivému zjišťování
koncentrace složitých biologických látek v krevním séru -
hormonů, tumorových markerů a jiných biologicky významných
látek.
Jejím základem je imunochemická reakce
antigenu se specifickou protilátkou (antibody - Ab). Využívá
se kompetitivní imunoreakce, v níž radioaktivně
značený antigen Ag* "soupeří" o vazebná místa na
protilátce (která se v reakční směsi nachází v omezeném
množství) s neznačeným antigenem. K analyzovanému vzorku se
přidá příslušná protilátka značená vhodným
radionuklidem Ag* (většinou radiojódem I-125), která zreaguje s daným hormonem za vzniku
nerozpustného komplexu Ag*-Ab. Po odstranění nenavázané
frakce (propláchnutím vodou) zbude ve vzorku sloučenina,
jejíž aktivita bude závislá na koncentraci hormonu v
analyzovaném vzorku - množství značeného komplexu
antigen-protilátka Ag*-Ab je nepřímo úměrné koncentraci
stanovovaného antigenu. Čím více stanovované látky se v
primárním vzorku nachází, tím menší množství značeného
komplexu Ag*-Ab antigen-protilátka vznikne a tím menší bude
aktivita ve výsledném vzorku. Měří se ve studnovém
scintilačním detektoru (viz §2.7, část
"Automatické
měření sérií vzorků"). Tyto metody mají velký význam pro endokrinologii.
...................doplnit
Metody RIA či RSA dosáhly největšího rozvoje
v 70. a 80. letech, kdy se široce prováděly v radiochemických
RIA laboratořích na odděleních nukleární
medicíny. Potom se postupně přestěhovaly z pracovišť
nukleární medicíny do laboratoří klinické biochemie.
Od 90.let jsou postupně vytlačovány a nahrazovány optickými
metodami fluorescenčními a chemo-luminiscenčními, bez
použití radionuklidů a ionizujícího záření...
Radioisotopová
terapie
Vedle diagnostiky je součástí nukleární medicíny i terapie
pomocí otevřených radionuklidů, např. léčba
hyperthyreózy a rakoviny štítné žlázy, krevních
onemocnění, paliativní a kurativní terapie u různých typů
nádorů, onemocněních kloubů - podrobněji viz níže v §3.6
"Radioterapie", část "Radioisotopová
terapie".
Nukleární medicína –
interdisciplinární obor
Nukleární medicína je vzhledem k fyzikální podstatě
svých metod a k používané přístrojové technice obor
interdisciplinární. Vedle lékařů (specializovaných a atestovaných v oboru nukleární
medicíny), zdravotních sester a
laborantek, zde pracují v týmové spolupráci i
odborníci dalších profesí – fyzik, elektronik,
radiochemik, farmaceut. Spolu s medicinskými a
fyzikálně-technickými aspekty je na pracovištích nukleární
medicíny při práci s radioisotopy věnována značná
pozornost i radiační ochraně pracovníků a pacientů (viz kap.5 "Biologické účinky
ionizujícího záření. Radiační ochrana").
Podrobný popis principů, metod
a klinického využití nukleární medicíny je v kapitole 4
"Radioisotopová scintigrafie".
Autoradiografie
- fotografické zobrazení distribuce
beta-radioindikátoru ve zkoumaných preparátech při těsném
kontaktu fotografické emulze se vzorkem je popsáno v §2.2
"Fotografická detekce ionizujícího záření",
pasáži "Autoradiografie".
3.6.
Radioterapie
Radioterapie je fyzikálně-medicínský obor využívající biologické
účinky ionizujícího záření pro léčebné
účely. Ve velké většině se jedná o terapii nádorových
onemocnění - radiační onkologie, v menší
míře se pomocí záření léčí i některá degenerativní a
zánětlivá postižení. V poslední době se občas používá
i tzv. radiochirurgie, především u cévních a
neurologických malformací (viz víže
"Stereotaktická radioterapie"). Než se budeme podrobněji věnovat vlastní
radioterapii, zmíníme některé biologické aspekty
nádorových onemocnění, diagnostiku a neradiační
terapeutické metody (chemoterapii, biologickou terapii) - pro
zasazení problematiky do širšího kontextu.
Nádorová
onemocnění - jejich podstata a vznik
Vyšší organismy, včetně nás lidí, se skládají z miliard
buněk různých druhů a funkcí v řadě tkání a orgánů.
Tyto buňky mají omezenou životnost, po určité době
zanikají (většinou apoptózou -
§5.2, pasáž "Mechanismy
buněčné smrti"), přičemž jsou většinou nahrazovány buňkami
novými, vznikající dělením stávajících buněk.
Proces zániku a dělení buněk je za normálních okolností
důsledně kontrolován, aby byla zajištěna tkáňová
homeostáza. Během svého života jsou často buňky zvenku
i zevnitř vystavovány různým škodlivým vlivům.
Vznikající lehká poškození jsou většinou opravována
intracelulárními reparačními mechanismy a takto opravené
buňky mohou pak opět plnit své původní funkce (viz §5.2, pasáž "Reparační
procesy"). Při vážném poškození
většinou dochází k zániku buňky. Může se však občas
stát, že "středně těžké" poškození není pro
buňku smrtelné, ani se je nepodaří bezchybně opravit;
taková buňka se může dále dělit, avšak s narušenou
genetickou informací v DNA - s mutací. To za
určitých okolností může vést k porušení kontroly procesu
buněčného dělení a nakonec vyústit v patologické nekontrolované
množení buněk - vznik nádorového onemocnění.
Nádory, především zhoubné,
patří k nejčastějším a nejzávažnějším onemocněním,
ohrožujícím zdraví i život pacientů. Při vzniku nádoru
dochází k tvorbě patologické tkáňové hmoty (novotvaru),
zpravidla nevratné, v níž probíhá nekontrolované
množení abnormálních buněk, na úkor
zdravé tkáně; v organismu se neuplatňuje zpětná vazba,
která by tento růst zastavila. Nádorové buňky mohou
prorůstat do okolní tkáně, oddělit se od původního nádoru
a lymfatickými či krevními cestami migrovat do dalších
částí organismu, usazovat se tam a vytvářet druhotná
ložiska - zakládat metastázy. Svým nekontrolovaným
dělením masa nádorových buněk utlačuje okolní zdravou
tkáň, rozrušuje ji a může tak porušovat funkci
důležitých orgánů. Příčina vzniku takového stavu není
přesně známa *), tkví hluboko uvnitř buněčné struktury,
pravděpodobně v mutačních změnách v DNA.
Prevence a kauzální léčba nádorových onemocnění je proto
obtížná.
*) Byly jen vypozorovány některé rizikové
faktory, které se na vzniku nádorů podílejí či
zvyšují pravděpodobnost jejich výskytu. Jsou to různé
látky chemické, tzv. karcinogeny,
jako jsou některé cyklické uhlovodíky a cigaretový kouř,
skladba potravy. Nebo vlivy biologické - některé viry (tzv. onkoviry),
jejichž RNA může (prostřednictvím tzv. reverzní
transkriptázy) vstupovat do DNA eukaryotických buněk a
měnit jejich genetickou informaci, mohou způsobit nádorovou
transformaci buněk (popř. nemusí vést přímo ke vzniku
nádoru, ale zabránit imunitní odpovědi, která by byla
schopna rozpoznat nádorové buňky a zlikvidovat je). Dále jsou
to faktory genetické, dědičná
predispozice (hereditární genomický imprinting např.
u Nyemegen syndromu, Ataxia teleagiectasia, Bloomova syndromu,
Fanconiho anemie, Xeroderma pigmentosum, Li-Fraumeni syndrom
zmutovaného genu TP53 kódujícího p53); je podmíněno
specifickou mutací v tumor-supresorových genech
(mutace genu TP53 u Li-Fraumeni syndromu, NF1,2 u
neurofibromatózy, BRCA1,2 u hereditárního karcinomu prsu a
ovarie, APC u kolorektální polypózy, WT1 i Wilmsova tumoru
ledvin, RB1 u retinoblastomu, mutace genu MLM u maligního
melanomu). Z fyzikálních vlivů je to ultrafialové
záření působící na kůži a zvláště tvrdší ionizující
záření, jak je podrobně rozebíráno v §5.2 "Biologické účinky ionizujícího záření".
Je rakovina nová
civilizační nemoc (která
se v minulosti nevyskytovala) ?
Tento názor se časo mezi lidmi vyskytuje, ale je mylný.
Nádorová onemocnění se nepochybně začínaly objevovat hned
po vzniku mnohobuněčných složitějších organismů se
specializovanými buňkami pro různé funkce. Již tehdy
některé buňky s neopraveným genetickým poškozením v DNA
"zapoměly" jakou funkci by měly vykonávat v
organismu a mohly se začít nekontrolovaně množit.
Většina nádorových onemocnění postihuje
měkké tkáně, takže v paleontologických a archeologických
nálezech se jejich pozůstatky nedají nalézt. Pouze kostní
nádory zanechávají zřetelné fosilní stopy. Podařilo se
nalézt vzorek kosti želvy starý cca 240 milionů let,
destruovaný kostní rakovinou. U lidských předků byla
nádorová destrukce kosti nalezena v cca 2 milionů let staré
kosti australopiteka. V historické době byla rakovina popsána
již ve starověkém Egyptě. Avšak až do 19.stol. byla
rakovina považována za poměrně vzácnou. Lidé tehdy trpěli
a umírali na mnoho jiných nemocí. Dnes jsme schopni většinu
z nich vyléčit (některé byly prakticky
vymýceny). Nádorová onemocnění,
zvláště v pokročilejším stádiu, jsou však i nyní
obtížně léčitelná.
Zvýšený výskyt nádorových onemocnění v
poslední době je dán jednak dokonalejší diagnostikou,
pravděpodobně však bohužel i horším životním stylem
většiny lidí v konzumní společnosti.
Kancerogeneze - vznik nádorů
Za normálních okolností představuje mnohobuněčný
organismus systém jednotlivých tkání a orgánů,
sestávajících z velkého množství buněk, vykonávajících
svou funkci v harmonickém společenství ve prospěch celého
organismu. Tato spolupráce a "sociální chování"
buněk je zajišťována velmi složitými a komplexními
regulačními procesy, zahrnujícími signály z monitorování
vnějšího prostředí, přenos signálů do vnitřního
prostředí buňky, vznik buněčné odpovědi, vyhodnocení
signálů a jejich koordinace s ostatními signály. Buňky,
které nezapadají do tohoto regulačního mechanismu (z důvodu
poškození či ztráty své funkce) jsou eliminovány mechanismy
"programované" buněčné smrti, apoptózy.
Rovněž množení buněk je přesně řízeno tak, aby
odpovídalo potřebám tkáně a organismu - dynamická
rovnováha, tkáňová homeostáza. Porušením
regulačních mechanismů mohou vzniknout různé patologické
stavy a onemocnění organismu. Jedním z nich je porušení
regulace buněčného dělení: v některé buňce dojde k
takové genetické změně (mutaci), která jí dovolí
přežít, dělit se a produkovat dceřinné buňky, které
"neposlouchají" regulační mechanismy tkáňové
homeostázy. Může tím vzniknout postupně expandující
populace zmutovaných buněk - klon nádorových buněk,
množících se na úkor zdravé tkáně.
Vznik
nádoru (kancerogeneze) je složitý vícestupňový
proces, při němž se postupně nahromadí několik mutací,
které změněným buňkám neškodí, ale naopak je
zvýhodňují a umožňují jejich rychlé dělení bez ohledu na
potřeby organismu. Důležitý význam pro vznik a rozvoj
nádorového onemocnění mají zejména následující faktory :
-> Deregulace buněčného cyklu
Pro udržování tkáňové homeostázy (vyváženého
počtu funkčních buněk dané tkáně) je nutná kontrola
rychlosti, s jakou buňky vznikají, vyvíjejí se a zanikají - regulace
buněčného cyklu. Vlivem některých mutací může
dojít ke vzniku autonomních růstových (mitogenních) faktorů
v buňce, jejich autokrinní produkci, či ke ztrátě citlivosti
k signálům, které buněčný cyklus zastavují. Regulace
buněčného cyklu a dělení se účastní zejména proteiny p21
a p27, které se mohou vázat na některé kinázy
(sloužící jako regulátory replikace DNA a dělení buňky) a
inhibovat jejich aktivitu; v nádorových buňkách bývá obsah
těchto regulačních proteinů snížený. Naopak aktivita
některých kináz (§5.2, část
"Buňky - základní jednotky živých organismů", pasáž "Proteiny, enzymy,
kinázy") je v
nádorových buňkách zvýšená. Jedná se především o tyrosinkinázu
- enzym který přenáší fosfát na hydroxylovou skupinu
cyklické aminokyseliny tyrosinu, čímž ovlivňuje funkci a
aktivitu příslušné bílkoviny. Zvýšená tyrosinkinázová
aktivita receptoru pro epidermální růstový faktor EGFR
(Epidermal Growth Factor Receptor) vede ke zvýšené
nitrobuněčné signalizaci, porušující regulaci buněčného
cyklu. Tato zvýšená aktivita EGFR může být způsobena
zvýšenou expresí ligandu EGFR (kterým je epidermální
růstový faktor EGF), nebo mutací v tyrosinkinázové doméně
EGFR, která vede k trvalé ligand-independentní aktivaci
mutovaného receptoru. Další receptor, který podporuje růst a
dělení buněk, je receptor epidermálního růstového
faktoru HER2 (Human
Epidermal Receptor), zvaný též erbB2,
při jehož zvýšené přítomnosti dochází k nadměrnému
dělení buněk, což může vést až ke vzniku nádoru.
Rovněž deregulovaný přenos signálu prostřednictvím
signální dráhy fosfatidylinositol-3-kinázy Pl3K/Akt/mTOR
poskytuje buňkám stimuly pro neomezený růst a přežití,
které mohou vést k nádorovému bujení.
Porušení regulace buněčného cyklu může vést k proliferaci
takto změněných buněk nezávisle na okolním prostředí,
nezávisle na potřebách tkáně a organismu - je zpravidla
prvním stupněm kancerogeneze.
-> Inhibice apoptózy
Dalším důležitým mechanismem udržení tkáňové
homeostázy je regulace rychlosti, s jakou
"přebytečné" buňky v tkáňové populaci umírají.
Obvyklý způsob, kterým buňky podléhají řízenému zániku
je apoptóza (podrobněji
popsaná v §5.2, část "Účinek záření na
buňky", pasáž "Mechanismy
buněčné smrti", kde
jsou rozebírány vnitřní a vnější signální dráhy
apoptózy) - "programovaná"
buněčná smrt, zanikající buňkou aktivně řízená.
Apoptický program je potenciálně přítomen ve všech
buňkách, je spouštěn vnitřními signály (poškození DNA,
hypoxie,...) nebo vnějšími "signály smrti", které
buňka dostává od regulačních mechanismů v tkáni. Správně
fungující apoptóza, spouštěná vnějšími regulačními
mechanismy z tkáně, představuje účinnou ochranu proti
nadměrnému zmnožení buněk. Apoptóza spouštěná
vnitřními mechanismy pak funguje jako ochrana proti
přežívání a množení zmutovaných buněk s poškozenou DNA.
Inhibice (zablokování, poškození) apoptózy - apoptická
rezistence buněk - umožňuje, aby vyvíjející se
nádorové buňky mohly přežívat a množit se, navzdory zájmu
organismu. Apoptóza může být narušena např. změnou
(mutací) genu TP53 kódujícího protein p53, zvýšenou
koncentrací antiapoptického genu Bcl-2 v mitochondriích (chrání membrány mitochondrií - zabraňuje průniku cytochromu
c a spuštění kaspázového řetězce proteolytické
degradace v cytoplasmě) a jistě i
dalšími dosud neprozkoumanými faktory.
Pozn.: Jedná se
zde především o potlačenou apoptózu indukovanou vnějšími
regulačními mechanismy tkáně. Při silném ozáření
nádorových buněk, při němž dochází k závažnému
neopravitelnámu poškození DNA, však vnitřně aktivovaná apoptóza
probíhá.
-> Immortilizace buněk
Většina běžných somatických buněk může dosáhnout
jen určité hranice v počtu svých dělení, tzv. Hayflickův
limit (cca 40-60 cyklů); pak již buňky schopnost dělení
ztrácejí. Je to způsobeno mitotickým
zkracováním telomerů DNA (o buněčném
cyklu, zkracování telomerů, senescenci buněk, apoptóze a
pod. viz též §5.2 "Biologické účinky
ionizujícího záření").
Tento limit v počtu dělení by automaticky zastavil růst
nádorové populace. Zvýšený výskyt aktivního enzymu
zvaného telomeráza (v koprodukci s tankyrázou),
popř. mechanismy homologní rekombinace sekvencí
telomerů (je diskutováno v §5.2, část "DNA,
chromosomy, telomery"),
jsou však schopny zajistit úplnou replikaci konců DNA
(zabránit zkracování telomerů) - získání neomezeného
replikačního potenciálu, tzv. immortilizace
- "nesmrtelnost" buněk. Neregulované a neomezené
dělení klonogenních nádorových buněk, které se vymaní z
mechanismů tkáňové homeostázy, je typickou vlastností
nádorového onemocnění.
-> Inhibice imunogenity
Imunitní systém organismu je v zásadě schopen nádorové
buňky rozpoznat a zničit je. Některé nádorové buňky však
ztrácejí svoji imunogennost *), nebo je imunitní systém
poškozen - takové buňky se pak vymykají kontrole imunitních
mechanismů a může dojít k jejich nekontrolovanému množení.
*) Mnohé nádorové buňky mají na svém
povrchu protein CD47, který je chrání před
bílými krvinkami (fyziologicky se tento protein vyskytuje na
povrchu krevních buněk, aby byly chráněny před vlastními
bílými krvinkami) a imunitní systém je proto nemůže
zlikvidovat.
-> (neo)Angiogeneze
V počátečních stádiích (velikost nádoru do cca 0,5-1mm)
jsou nádorové buňky zásobovány kyslíkem a živinami difuzí
z okolního mezibuněčného prostředí tkáně, v níž nádor
roste. Jak se počet nádorových buněk zvětší, toto
zásobení již nepostačuje - dochází k hypoxii
nádorové tkáně, doprovázené expresí speciálních interleukinů,
především HIF1 (hypoxia-iducible transcription factor),
indukující produkci vaskulárního endoteliálního
růstového faktoru VEGF (jakož i expresi VEGF mRNA).
Regulační mechanismy v tkáni na to mohou reagovat angiogenezí
- tvorbou nových cév, zajišťujících prokrvení nádorové
tkáně a její bohaté zásobení kyslíkem a živinami, jakož
i odplavování odpadů metabolismu. Nádorový růst je
závislý na angiogenezi - nezbytně vyžaduje dostatečné
zásobení živinami a kyslíkem, které zajišťují nově
vytvořené cévy. Každé zvýšení objemu nádoru je spojeno s
růstem nových kapilár.
Nádorová neoangiogeneze či neovaskularizace
je důležitým mezníkem v progresi nádorového onemocnění,
umožňujícím nádorům dorůst do makroskopické velikosti,
ohrožující tkáně i celý organismus. Prokrvení nádorové
tkáně též umožňuje šíření nádorových buněk krevní
cestou - vznik metastáz :
-> Tvorba metastáz
U většiny nádorových onemocnění je
nejnebezpečnější vlastností tumorů schopnost vytvářet sekundární
ložiska, tzv. metastázy (řec.
meta=změna, stasis=místo -> změna místa,
přestěhování). Metastázy jsou příčinou více
než 90 % úmrtí na nádorová onemocnění. Nádorové
buňky mohou prorůstat do okolní tkáně, oddělit se od
původního nádoru a lymfatickými či krevními cestami
migrovat do dalších částí organismu, usazovat se tam a
vytvářet druhotná ložiska - zakládat metastázy. Nádorová buňka nejprve pronikne do okolní
tkáně a následně do krevního nebo lymfatického řečiště.
Pokud v tomto řečišti přežije, může jím být unášena a
migrovat do dalších tkání a orgánů. Tam může opustit toto
řečiště a proniknout do tkáně v novém místě, tam se
etablovat a začít se dělit. Metastázování je
často řetězové: ze sekundární metastázy se
uvolňují a migrují nádorové buňky a zakládají další,
terciální, metastázy atd. Výsledkem může být rozšíření
nádorového onemocnění do celého těla - generalizace.
Problematika
karcenogeneze je velmi složitá, s řadou zatím neprobádaných
faktorů. Vedle mutací známých a kódujících genů v DNA se
mohou uplatňovat i sekvence tzv. "genetického smetí"
či "zbytečné DNA", které přes
příslušné RNA mohou fungovat jako regulační
"spouštěče" či "vypinače"
nitrobuněčných procesů (viz též
§5.2, část "DNA, chromosomy, telomery").
Když to tedy stručně
shrneme, nádorové onemocnění vzniká, když některé (původně zdravé a funkční)
buňky v těle projdou několika mutacemi ve své DNA a
začnou se nekontrolovaně dělit, přičemž imunitní
mechanismy organismu nedokážou tento růst zastavit. Vznik
nádorového onemocnění je jev stochastický, nedá se
konkrétně předpovědět zda a kdy u daného jedince vznikne;
dá se pouze statisticky odhadnout pravděpodobnost jeho
vzniku.
Závislost
na věku a velikosti organismu ?
Mechanismy kancerogeneze a stochastický vznik nádorového
onemocnění navozují očekávání, že čím více buněk má
organismus ve svém těle a čím déle žije, tím větší je
riziko že onemocní rakovinou. Časový faktor růstu rizika
nádorových onemocnění s věkem konkrétního jedince se
skutečně téměř vždy uplatňuje - čím déle někdo žije,
tím více času mají jeho buňky na zmutování; a zároveň i
imunitní procesy se při stárnutí oslabují. U závislosti na
velikosti organismu je však situace složitější. Některá
velká a dlouhověká zvířata téměř netrpí nádorovými
onemocněními, i když mají mnohem více buněk a žijí
srovnatelně dlouho nebo dokonce déle než lidé. Jsou to např.
velryby grónské, sloni, ale částečně i krávy a koně.
Naproti tomu některá drobná zvířata jako myši a krysy s
poměrně krátkým životem cca 4 roky, jsou vysoce náchylná k
nádorům. Jedním z faktorů které za tím stojí je rychlejší
metabolismus (-> vznik většího množství mutagenních metabolických
zplodin) a rychlejší buněčné dělení (-> častější
mitotická reprodukce příp. chyb v DNA). U velkých a
dlouhověkých živočichů, kteří mají zpravidla i
pomalejší metabolismus, byly nalezeny též genetické
faktory, spočívající ve zmnožení genu TP53, který
kóduje protein p53 spouštějící apoptózu, nebo obecně
rychlejší vývoj tumor-supresujících genů. Je neurčitá
naděje, že některé z těchto molekulárně-genetických
protinádorových strategií se v budoucnu podaří uměle
uplatnit i v klinické onkologii..?..
Typy nádorů
Nádory a nádorová onemocnění (označovaná často souhrnným
názvem karcinom či rakovina) se vyznačují
značným počtem druhů a velkou variabilitou. Rozdělují se
podle několika kritérií :
l Podle zdravotní
závažnosti
× Benigní
(nezhoubné) nádory (lat. benignus =
neškodný,přívětivý, štědrý)
jsou zpravidla lokalizovány a vůči okolní tkáni izolovány
opouzdřením, neprorůstají do jiných tkání a netvoří
vzdálené metastázy. Nemusí pro organismus vytvářet větší
škody či obtíže (mohou často v tkáni zůstat - pozor však
na riziko maligního zvrhnutí!), v případě potřeby je lze
zpravidla úspěšně chirurgicky odstranit.
× Maligní
(zhoubné) nádory (lat. malignus =
zlý, zlo plodící), neboli tumory
(lat. tumor = otok,zduření), rostou destruktivně a infiltrativně
- nádorové buňky prorůstají do mezibuněčných prostorů
okolních tkání (které utlačují a rozrušují), buňky se
uvolňují a šíří se krevní či lymfatickou cestou do
jiných tkání a orgánů, kde často vytvářejí vzdálená
sekundární "dceřinná ložiska", tzv. metastázy
(řec. meta=změna, stasis=místo -> změna
místa, přestěhování). I po
odstranění primárního nádorového ložiska mohou metastázy
nadále růst a vytvářet další metastázy. Vlivem
metastatického rozsevu (diseminace) tak může dojít k
nekontrolovanému šíření onemocnění, často do celého
organismu (generalizace).
l Podle orgánu, z
něhož nádor primárně pochází - např.
karcinom prsu, plic (bronchogenní), prostaty atd.
l Podle názvu buněk
a tkání. Název nádoru se tvoří z latinského názvu
tkáně, orgánu či původních buněk, z nichž nádor vznikl a
k tomuto názvu se přidá koncovka "-om" - např. melanom či melanoblastom (kožní
nádor buněk melanocytu), gliom či glioblastom
(primární mozkový nádor z glií, též astrocytom), lymfom
(nádorové bujení lymforetikulární tkáně) atd. Maligní
nádorové onemocnění krvetvorné tkáně, projevující se
zmnožením bílých krvinek (které jsou nezralé a neplní svou
normální funkci), se nazývá leukemie.
l Podle lokalizace
metastatického postižení - např. metastáza
karcinomu prsu do jater, do skeletu, a pod.
l Podle tkáňové a
buněčné povahy
- Nádory epitelové zvané (v užším smyslu) karcinomy
jsou nejčastějším druhem zhoubných nádorů. Podle
buněčné vrstvy z nichž vycházejí s rozdělují dále na spinocelulární
a bazocelulární karcinomy (tyto názvy pocházejí z
kožních nádorů).
Podle mikroskopického vzhledu nádorových buněk (při
histologickém pozorování) a tvaru růstu nádoru se někdy
používá označení papilární (bradavčitý - nádor
vytvářející bradavčité nebo třásnité útvary), tubulární
(vytvářející trubicové struktury), medulární
(dřeňový), duktální (vývodový), lobulární
(lalůčkový) a pod.
Benigní nádory vycházející ze žlázového epitelu se
nazývají adenomy, maligní nádory adenokarcinomy.
- Nádory mezenchymové, zvané sarkomy,
vycházejí z pojivových tkání. Vyskytují se méně často.
Výsledná
terminologie konkrétních druhů nádorů je často tvořena
spojením názvů jednotlivých kategorií - např. adenokarcinom
prostaty, osteosarkom u skeletu, a pod.
Některé konkrétní druhy
nádorů
Nádorová onemocnění jsou velmi různorodá, bylo popsáno cca
100 druhů a poddruhů nádorových diagnóz. Zmíníme zde
stručně několik známějších a častěji se vyskytujících
druhů nádorových onemocnění :
-> Kožní nádory
postihují primárně kůži, ale mohou prorůstat do hlubších
vrstev tkáně, některé druhy i zakládat metastázy. Maligní
melanom je nádorové onemocnění které vzniká z
neoplastické prolyferace melanocytů. Rizikovým faktorem je UV
záření (včetně nadměrného
opalování na slunci). Melanom se
zpočátku šíří radiálně v kůže, později může
metastázovat do lymfatických uzlin, nebo hematogenně do
vnitřních orgánů. V tomto případě je velmi nebezpečný,
je jedním z nejzhoubnějších nádorů! Bazaliom -
bazocelulární kožní karcinom - se vyvíjí ve vrstvě
bazálních buněk v kůži. Je nejčastějším nádorovým
onemocněním kůže. K jeho vzniku rovněž přispívá UV
záření. Většinou je téměř benigní, jen málokdy
metastazuje. Odstraňuje se excizí nebo laserově. Spinocelulární
karcinom (spinaliom) vychází z plochých buněk
"dlaždicovitého" /skvamozního) tvaru, které se
nacházejí v epitelové tkáni střední vrstvy kůže. Může
později metastázovat (hlavně lymfatickou
cestou), takže by se měl odstranit
excizí i s bezpečnostním lemem. Název spinocelulární
se používá i pro skvamozní nádory výstelky dutých
tělesných orgánů, dýchacích cest, dělohy.
-> Karcinom plic -
bronchogenní - je časté onemocnění zvláště u mužů,
rizikovým faktorem je hlavně kouření. Většinou nastává
zhoubné bujení buněk epitelové tkáně. Dvěma hlavními
skupinami jsou malobuněčné a nemalobuněčné
karcinomy plic. Častěji se vyskytuje nemalobunečný karcinom.
Rozděluje se na adenokarcinom (vzniká v okrajové plicní
tkáni), spinocelulární karcinom (vychází z epitelu velkých
dýchacích cest) a velkobuněčný karcinom. Malobuněčný
karcinom je tvořen malými buňkami tvaru ovesných zrnek, záhy
metastázuje krevními i lymfatickými cévami, je obtížněji
léčitelný. Kromě primárních plicnícních nádorů se
plicích mohou vyskytovat i metastázy zhoubných
nádorů z jiných tkání (jako je karcinom prsu, .....); v
kapilárním cévním řečišti plic se mohou kolující
nádorové buňky znadno zachytit.
-> Rakovina prsu je
nejčastějším nádorovým onemocněním u žen.
Nejčastější (cca 80%) je duktální karcinom prsu,
který vzniká z buněk výstelky vývodů mléčné žlázy.
Dále lobuární ca prsu (10-15%) vznikající v
lalůčcích (lobulech) prsní žlázy. Podle histologie se dále
karcinomy prsu dělí podle přítomnosti nádorových
markerů/receptorů na povrchu buněk, jako je HER2+. To je
důležité pro biologickou léčbu. Vedle mízních uzlin
(nejčastěji v podpaží) nádory prsu metastazují
často do skeletu, jater, plic. Pro včasnou diagnostiku ca prsu
je doporučována pravidelná mamografie po 40.roce (popsaná výše v §3.2, pasáž "RTG
mamografie").
-> Gynekologické nádory
u žen - dělohy a děložního hrdla, čípku, vaječníků.
Jedním z rizikových faktorů je infekce onkogenních virů HPV.
Nádory děložního hrdla a čípku, vycházející s
vrstvy epitelu, jsou to nejčastěji spinocelulární
karcinomy (80%) a adenokarcinomy (20%). U nádorů dělohy
jsou nejčastější epiteliální nádory adenokarcinomy
endometria (83%). Nádory vaječníků a vejcovodů
jsou většinou epitelové karcinomy.
-> Karcinom prostaty
je jedním z nejčastějších onkologických onemocnění
mužů. Nádor adenokarcinomu prostaty se nejčastěji
vyvíjí v periferní části žlázy. Specifickou vlastností
nádorových buněk prostaty je zvýšená exprese prostatického
specifického antigenu PSA. Důležitou diagnostickou
indicií karcinomu prostaty je tedy zvýšená hladina PSA
v krevních vzorcích (bývá poněkud
zvýšená i u benigní hyperplazie a zánětů prostaty). Pokročilý karcinom prostaty může často
metastázovat do mízních uzlin v pánvi a do skeletu. Některé
prostatické nádory jsou hormonálně závislé, na
několik let může být účinná hormonální terapie (kastrace, estrogeny); po delší
době se však často stávají hormonálně refrakterní.
Nádorové buňky ca prostaty mají ještě jednu specifickou
vlatnost výhodnou pro diagnostiku a terapii:
kromě vylučování PSA do krve na své buněčné stěně mají
zvýšený výskyt transmembránového receptoru Prostatický
Specifický Membránový Antigen PSMA. Na tento receptor se
podařilo vyvinout odpovídající ligandy jako je
PSMA-617 a radioaktivně je označit jednak diagnostickými
radionuklidy 68Ga nebo 18F pro scintigrafické zobrazení, tak i terapeutickými
radionukllidy 177Lu nebo 225Ac pro účinnou biologicky cílenou radionuklidovou
terapii. Tento přesný teranostický přístup
umožňuje vyléčit i metastatický hormonálně refrakterní
karcinom prostaty - viz níže Karcinom prostaty
- Radioisotopová terapie může zvítězit nad rakovinou
prostaty !".
-> Nádory ledvin a
močového měchýře. Nejčastějším
nádorem ledvin je adenokarcinom ledvinného parenchymu,
z epitelu renálních tubulů (nazývaný
někdy Grawitzův tumor). Nejčastějšími
nádory močového měchýře jsou papilární nádory
vycházející z urotelu, které mívají tvar výrustků
vyklenujících se do dutiny močového měchýře.
-> Nádory jater.
Primární hepatocelulární karcinom, vznikající
maligním zvrhnutí jaterních buněk hepatocytů, se vyskytuje
poměrně vzácně. Játra jsou však častým místem metastáz
různých zhoubných nádorů (rakoviny tlustého střeva, prsu,
plic,...), neboť jimi protéká krev ze zažívacího traktu,
kterou m.j. "očišťují" od metabolitů. V krevním
řečišti jater se proto mohou zachytit i kolující nádorové
buňky.
-> Kolorektální karcinom -
nádory tlustého střeva jsou většinou adenokarcinomy
vznikající ze žlázových buněk střevní sliznice.
Rizikovým faktorem jsou polypy - výrustky ze stěny
střeva, ze kterých za delší dobu může vzniknout karcinom. V
pokročilé fázi často metastázuje především do jater.
-> Karcinom pankreatu
vychází hlavně z exokrinní části pankreatu, nejčastěji se
jedná o adenokarcinom z epitelu pankreatických
vývodů, kterými prochází pankreatické enzymy. Je zpočátku
asymptomatický, většinou bývá diagnostikován až v pozdním
stádiu, kurativní terapie zatím nebývá úspěšná. Z
hlediska endokrinologie a biochemie se karcinom pankreatu
zahrnuje mezi tzv. neuroendokrinní tumory. Jejich
specifickým znakem je přítomnost somatostatinových
receptorů, kterých lze využít k biologicky cílené
radionuklidové terapii pomocí somatostatinových analogů
značených 177Lu (je zmíněno níže "Neuroendokrinní
nádory").
-> Karcinom štítné
žlázy může být diferencovaný (papilární
a folikulární), medulární, nediferencovaný
(anaplastický). Buňky diferencovaního thyroidálního
karcinomu, včetně příp. metastáz, si zachovávají schopnost
akumulovat jód, na čemž je založena jeho scintigrafická
diagnostika a většinou úspěšná terapie radiojódem
131I (je podrobněji popsáno v §4.9.1 "Thyreologická radioisotopová diagnostika" a níže v části "Biologicky cílená
radionuklidová terapie", pasáž "Terapie karcinomu štítné žlázy
radiojódem 131I").
-> Nádory ve skeletu mohou
být dvojího původu. Primární kostní nádory,
mající svůj původ v buňkách vyskytujících se v kostech,
zvané kostní sarkomy, jako je osteosarkom, se
vyskytují zřídka. Daleko častější jsou kostní
metastázy, vznikající maligním bujením nádorových
buněk pocházejících z nádorových onemocnění jiných
tkání - nejčastěji ca prsu, prostaty, dělohy a dalších.
Většina metastáz do skeletu je hematogenních. Vaskulárně
zásobené vnitřní prostředí kosti je "živnou
půdou" pro zachycení a zmnožení nádorových buněk,
které se dostanou do kostní tkáně a začnou se vázat se
stromálními buňkami. Zvláštním případem jsou
osteolytická ložiska v kostech způsobená mnohočetným
myelomem; zde se nejedná o metastázy v obvyklém smyslu.
-> Nádory mozku a CNS.
Primární mozkové nádory časo vznikají z buněk podpůrné
mozkové tkáně (neuroglie) - gliomy. Nejčastější
jsou astrocytomy, od méně zhoubných pylocytárních
až po velmi agresivní a nebezpečné glioblastomy.
Dále oligodendrogliomy, které jsou též méně agresivní.
Vedle primárních mozkových nádorů bývá mozková tkáň
ještě častěji postižena i metastázami nádorů z
jiných tkání a orgánů (karcinom prsu, plic, maligní
melanom, ....), jejichž hematogenně migrující buňky mají
zvýšenou pravděpodobnost se zachytit, díky vysokému
prokrvení mozku. Intrakraniální nádory, včetně metastáz,
do velikosti cca 3cm lze poměrně úspěšně léčit stereotaktickou
radioterapií (je popsaná níže
"Stereotaktická radioterapie"), předevšém pomocí Lexellova
gama-nože.
Hemato-onkologické nádory - malignity
krve a krvetvorných orgánů - tvoří samostatnou specifickou
skupinu, často difuzně lokalizovaných lézí :
-> Leukemie je
způsobena nádorovým zmnožením některých typů bílých
krvinek - leukocytů, které jsou nezralé a neplní
svou normální funkci. Je to doprovázeno útlumem normální
krvetvorby. Myeloidní leukemie postihuje tvorbu monocytů nebo
granulocytů, lymfatická leukemie postihuje tvorbu lymfocytů.
Podle rychlosti průběhu se vyskyje leukemie akutní a
chronická. Do kategorie myeloproliferativních
onemocnění patří i polycytemie, což je
zmnožení erytrocytů v krvi. Zvyšuje se tím viskozita krve,
což může zhoršovat krevní oběh.
-> Lymfomy tvoří
skupinu nádorových onemocnění lymfatické soustavy, které
mají různý stupeň malignity. Projevují se nejčastěji
zvětšením mízních uzlin ......... Podle typu nádorových
buněk se tradičně dělí na hodgkinské a nehodgkinské. .....
Pro terapii lymfomů lze použít monoklonální protilátky
jako je rituximab, pro biologicky cílenou
radionuklidovou terapii monoklonální protilátky anti-CD37
značené 90Y ibritutomab tiuxetan nebo anti-CD20 177Lu-tetulomab (je zmíněno níže "Imunoterapie
lymfomů").
-> Mnohočetný myelom je
maligní onemocnění při kterém dochází ke zmnožení
klonálních plasmatických buněk - myelomových plasmocytů
v kostní dřeni, která je sídlem hematopoetických buňek z
nichž vznikají všechny druhy krevních buněk. V myelomových
buňkách vznikají genetické změny, které jim umožní
nekontrolovaný růst. Krevní cestou (spolu s normálními
funkčními krvinkami) se šíří do dalších míst kostní
dřeně a občas mohou infiltrovat i do jiných tkání -
vznikají často vícečetné léze. Nádorové myelomové buňky
produkují patologické cytokiny, monoklonální imunoglobulin
(zvaný též paraprotein), z nichž některé porušují
rovnováhu mezi osteoblastickou a osteoklastickou aktivitou ve
skeletu. Myelomové léze v kostní dřeni pak často napadají
kostní tkáň zevnitř, dochází přitom ke vzniku řady
osteolytických ložisek v postižených kostech (nejsou to kostní metastázy v obvyklém smyslu). V těchto ložiscích dekalcifikace může docházet k
patologickým zlomeninám. Dále dochází k poruchám krvetvorby
(především červených krvinek- anemie) a často též k
poškození ledvin.
Stojí za zajímavost, že z myelomových buněk se pomocí tzv.
hybridomové technologie získávají monoklonální
protilátky (je popsáno níže v pasáži "Monoklonální
protilátky"), které jsou
důležité pro biologicky cílenou protinádorovou terapii i
diagnostiku.
Anatomický rozsah -
pokročilost - nádorového onemocnění (staging)
Pro posouzení možností optimální terapie je
rozhodující pokročilost nádorového
onemocnění - jak se nádorové bujení v organismu
rozšířilo, kam až proniklo. Anatomický rozsah
(pokročilost, staging) nádorového onemocnění se
často hodnotí podle tří kritérií "TNM":
T-tumor, N-nodes (uzliny), M-metastázy; čím vyšší číslo,
tím větší rozsah a šíření:
T - rozssah primárního nádoru: T0 (bez
známek primárního nádoru), T1 (nádor velikosti do
2cm), T2 (2-4 cm), T3 (nádor větší než
4cm), T4 (větší nádor prorůstající do dalších
struktur).
N - přítomnost a rozsah infiltrace v
regionálních mízních uzlinách: N0(bez infiltrace v
uzlinách), N1(metastáza v jedné uzlině, <3cm), N2(oboustranné
metastázy <6cm), N3(metastázy >6cm). Případně
N2 označuje 2-4 a N3 více než 4 metastázy v
regionálních uzlinách. Jsou různé konvence číslování T a
N podle druhu a lokalizace tumoru.
M - přítomnost vzdálených metastáz: M0-
bez metastáz, M1 - výskyt vzdálených metastáz.
Nádorová TNM
klasifikace se nepoužívá u maligních onemocnění
hematologických a lymfatických (leukemie, lymfomy), které
nejsou lokalizované, nýbrž difúzní.
Jednodušší klasifikace pokročilosti je na
čtyři stádia nádorového onemocnění,
zvaná též FIGO klasifikace (Federation International of Gynecology and
Obstetrics):
Stádium I. - menší nádorové
ložisko s lokálním růstem, bez jakékoli diseminace
(odpovídá T1,N0,M0).
Stádium II. - rozsáhlejší nádor s
lokálním růstem, bez diseminace nebo s minimální
regionální infiltrací (odpovídá T2,N0-1,M0).
Stádium III. - rozsáhlý
lokální nádor s regionální infiltrací (T3-4,N2,M0).
Stádium IV. - nádorové postižení s
infiltrací i na jiné tkáně nebo se vzdálenými metastázami
(odpovídá zhruba T2-4,N2-4,M1).
Na
všech těchto aspektech je závislá volba způsobu
léčby a její úspěšnost. Obecně
je úspěšnost terapie největší u izolovaných dobře
diferencovaných nádorů v raných stádiích bez metastatické
infiltrace (např. T1-2,N0-1,M0). V pozdních stádiích s
rozsáhlou metastatickou infiltrací (generalizací) je
léčba obtížná a většinou málo úspěšná...
Stupeň diferenciace
nádorových buněk - grading
Buňky nádorové tkáně vznikly mutací a maligní
transformací (viz výše "Kancerogeneze -
vznik nádorů") původně normálních buněk určité zdravé tkáně
či orgánu, v němž nádorové onemocnění vzniklo. Nesou si
tudíž řadu vlastností těchto původních buněk, avšak
některé další jejich vlastnosti se liší. Stupeň diferenciace
tumoru - nakolik se nádorové buňky liší od
buněk normální tkáně z níž vznikly - se označuje jako grading
(lat. gradus = stav, stupeň určitého
procesu). Pokud si nádorové buňky
zachovají část vlastností původní tkáně, jejímž
zvrhnutím vznikly, jedná se o diferencovaný nádor.
Často však nádorové buňky ztrácejí vlastnosti původní
tkáně - vzniká nediferencovaný (anaplastický)
nádor, který je do značné míry autonomní, bez vazby na
regulační mechanismy původní tkáně. Nádorový grading se
někdy kvantifikuje pomocí score: G1
(dobře diferencovaný), G2 (středně diferencovaný), G3
(špatně diferencovaný), G4 (nediferencovaný -
anaplastický). U ca prostaty se používá vícestupňový Gleasonův
systém gradingového score (až 10 stupňů).
Nebezpečnost
nádorového onemocnění závisí též na velikosti
nádorových buněk. Malobuněčný typ nádoru má
většinou rychlý infiltrativní růst s častou metastatickou
diseminací
Složitá heterogenní biologická struktura
nádorové tkáně
Kolem skupiny nádorových buněk,
přesahující velikost cca 2 mm, se postupně začíná tvořit
tzv. nádorové stroma (řec.
stroma = podložka, rozprostřené prostředí, lůžko). Je to nádorové mikroprostředí obsahující řadu
složek - firoblasty, vaskulární a imunitní buňky,
extracelulární matrix. Představuje téměř 90% nádorové
hmoty. Donedávna se tomuto nádorovému mikroprostředí v
onkologii nevěnovala větší pozornost, vyšetřovaly se jen
vlastní nádorové buňky. Novější výzkumy však ukazují,
že stroma hraje důležitou úlohu ve vývoji a růstu nádoru.
Že toto mikroprostředí nejen poskytuje nádorovým buňkám
mechanickou oporu a zprostředkovává přísun kyslíku a
živin, ale produkcí růstových, angiogenních a dalších
onkogenních faktorů se také výrazně podílí na zvyšování
metabolismu nádorových buněk, na progresi nádoru, invazi,
metastázování, imunosupresi.
Fibroplastový aktivační protein
FAP a jeho inhibitor FAPI
Jednou z hlavních buněčných populací
ve stromatu nádoru jsou fibroblasty - buňky
protáhlého vřetenového nebo hvězdicového tvaru, které se
vyskytují ve vazivových tkáních, kde produkují
extracelulární matrix a kolagen. Často se vyskytují v
neaktivním stavu a k jejich aktivaci dochází při remodelaci
tkáně. V nádorovém stromatu se vyskytují aktivní
fibroplasty, aktivované nádorovými buňkami, které exprimují
aktivační protein FAP. Firoblastový aktivační protein je
vysoce exprimován v nádorově asociovaných firoblastech
stromatu u řady epiteliálních karcinomů a přispívá k
agresivnějšímu průběhu nádorovího onemocnění. Naproti
tomu v normálních tkáních se nachází nízká exprese FAP.
Proto je FAP vhodným cílem pro zobrazovací diagnostiku a
biologicky směrovanou terapii - inhibitoray FAPI mohou dobře
fungovat v teranostice v onkologii.
Vhodné
chelátory, jako jsou DOTA, umožňují konjugační navázání
molekul FAPI s radionuklidy. Jednak s diagnostickými
radionuklidy (zkouší se 68Ga nebo 99mTc -FAPI-04 pro scintigrafické zobrazení PET či
SPECT). Dále s terapeutickými radionuklidy
jako jsou lutetium 177Lu, ytrium 90Y nebo aktinium 225Ac FAPI-46 pro teranostické aplikace.
Buněčná heterogenita nádorové
tkáně
V počátečních fázích, po svém vzniku, je nádor tvořen v
podstatě homogenní populací zmutovaných
buněk, které se vymkly regulačním mechanismům tkáňové
homeostázy a zahájily nekontrolované dělení. V
pozdnějších stádiích však histocytologické analýzy
ukázaly, že nádorová tkáň často obsahuje dva či více
klonů buněk s rozdílnými biologickými vlastnostmi -
je již heterogenní. Je to způsobeno
zvýšenou fragilitou DNA a genetickou nestabilitou nádorových
buněk, které mohou při opakovaných děleních podlehnout dalším
mutacím. Nádorová heterogenita komplikuje léčbu,
neboť různé části nádoru mohou mít různou
radiosenzitivitu. K podobnému efektu vede i příp. hypoxie
některých částí nádoru (viz níže
"6R", bod "Kyslíkový efekt").
Konkrétní
druh a povahu nádoru lze nejspolehlivěji stanovit histologickou
analýzou vzorku nádorové tkáně pod mikroskopem.
Zkušený patolog zpravidla rozezná původ a typ nádorových
buněk *) a též zda se jedná o tkáň benigní či maligní.
Histologické vyšetření by vždy mělo předcházet
terapii.
*) Nádorové buňky, které pod
mikroskopem vypadají podobně a histologicky se zařazují do
stejné kategorie, však mohou mít geneticky různé
příčiny maligního chování. Mohou se na něm
podílet i regulační mechanismy nekódující RNA
pocházející z dosud neprozkoumaného "genetického
smetí", "zbytečné" DNA (je zmíněno též v
§5.2, část "DNA, chromosomy, telomery"). To může výrazně komplikovat řetězec
diagnostika®terapie nádorových onemocnění.
Podrobnější
klasifikace nádorů a jejich klinických vlastností je již
mimo rámec tohoto fyzikálně zaměřeného pojednání.
Diagnostika nádorových onemocnění
Úspěšnost každé terapie do značné míry závisí na
pečlivé diagnostice - jak na primárním
vyšetření před léčbou, tak sledování odezvy během
terapie i následné dlouhodobé dispenzarizace. Ve zvýšené
míře to platí u nádorových onemocnění. Maligní tumory se
vyznačují některými specifickými charakteristikami :
- Jsou to útvary zpravidla o vyšší denzitě
než okolní tkáň; rovněž pro ultrazvuk vykazují většinou
zvýšenou echogenitu než okolní tkáň.
- Skládají se z metabolicky aktivních buněk
- mají zpravidla zvýšený metabolismus.
- Mají obvykle zvýšenou vaskularizaci,
zvýšený krevní průtok a zvýšenou energetickou spotřebu.
Mohou však obsahovat i hypoxické okrsky.
- Nádorové buňky mohou na svém povrchu obsahovat ve
zvýšené míře některé obecné buněčné antigeny, nebo
mohou být nostiteli antigenů specifických.
- Dále mohou nádorové buňky obsahovat ve své
buněčné membráně některé zvláštní receptory.
Všechny tyto vlastnosti mohou být využity
pro diagnostické zobrazování a pro cílenou
terapii.
× Primární nádorová diagnostika
Jedná se o odhalení primárního nádoru, jeho lokalizace a
rozsahu před operačním výkonem, jakož i záchyt
případných metastáz k určení postupu další léčby. Vedle
viditelných či hmatných povrchových a mělce uložených
lézí se primární nádorová diagnostika provádí
především pomocí fyzikálních zobrazovacích metod
- rtg
diagnostika (planární, nyní
především CT - §3.2), ultrazvuková sonografie, radionuklidová gamagrafie (planární, SPECT, nyní především PET - kap.4),
nukleární magnetická
rezonance NMRI. Nádory
lokalizované na stěnách tělesných dutin a trubic (žaludek,
střeva, děloha) mohou být rozpoznány pomocí optických metod
endoskopických. Je třeba upozornit, že
žádná ze zobrazovacích metod sama o sobě nerozhodne
o maligním charakteru onemocnění! Zobrazovací metody je proto
nutno kombinovat s metodami biochemickými
a zvláště histologickými (viz níže).
Jelikož některé nádory mohou produkovat specifické
látky (ať již samy nádorové buňky, nebo při intrerakci s
imunitním systémem organismu), jsou důležité i biochemické
analytické metody krevních či tkáňových vzorků. Jsou to
především různé druhy nádorových markerů
- složitých organických molekul (většinou proteinového
složení), jejichž zvýšená exprese v organismu je důsledkem
nádorového procesu - např. stanovení koncentrace PSA
u prostaty, nebo markerů CA19-9, CEA, AFP. V poslední době se
pro nádorovou diagnostiku zkouší (imuno)histochemické
stanovení antigenu Ki-67 (neboli
MKI67 o hmotnosti 360kDa; název pochází ze studie v Kielu,
Kiel - 67.klon v 96.misce), který je
spojen s buněčnou proliferací - s ribosomální DNA
transkripcí. Dále stanovení apoptického genu p53
(resp. jeho mutace) či antiapoptického genu Bcl-2.
Nebo cytologické vyšetření pomocí průtokové cytometrie.
"Molekulární"
gamagrafické zobrazení
Většina zobrazovacích metod poskytuje pouze
morfologicko-anatomické informace o přítomnosti, velikosti a
tvaru tkáně, lišící se hustotou od okolí. Na obrazech CT a
NMRI zobrazíme nádorovou masu, která se svou denzitou či
protonovou hustotou a relaxačními časy T1,T2 liší od okolní
tkáně, avšak nezachytíme, zda ve zobrazené anomální tkáni
jsou viabilní a proliferující nádorové buňky.
Gamagrafie (scintigrafie) sice nevyniká prostorovým
rozlišením, zato však zachycuje funkční metabolické
vlastnosti lézí - prokrvení, metabolismus, drenáž a další
funkce tkání a orgánů - na "molekulárně-biochemické"
úrovni (viz §4.9.6 "Onkologická radionuklidová diagnostika"). Zvláště PET zobrazení
distribuce 18F- fluor-deoxyglukózy (FDG), nebo 18F- 3-fluoro-3-deoxy-thymidinu (FLT), či 18F- fluorocholinu,
poskytuje kontrastní obrazy viabilních a
proliferujících nádorových lézí.
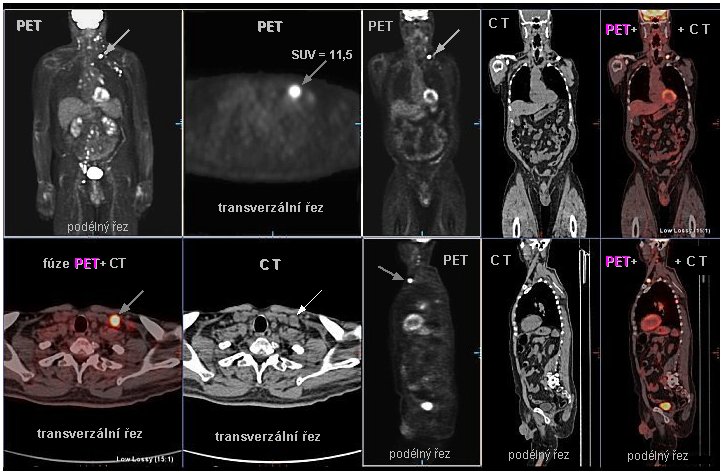 |
|
Příklad
scintigrafie PET/CT s 18FDG u pacienta s lymfomem.
Na PET obrazech jsou patrná vícečetná
ložiska zvýšeného metabolismu glukózy v
lymfatických uzlinách krku, axily vlevo, mediastina,
retroperitonea, pánve a třísla, svědčící pro
viabilní nádorovou neoplazii.
Fyziologicky se 18-FDG deponuje v mozku, v
dutém systému ledvin, močovém měchýři, lehce
difúzně v játrech a ve slezině, variabilní bývá
akumulace v myokardu
Na transverzálním řezu je separátně
zobrazeno výrazné ložisko v oblasti nadkličku (vyznačeno šipkami) pro
posouzení metabolické akumulace pomocí hodnoty SUV [g/ml.]:
SUVmax ložiska v nadkličku je 11,5 , při referenčním
SUVmax jater 2,9 a mediastina 1,4 .
( PET/CT obrazy
pořídil
MUDr. Martin Havel, Ph.D.,
vedoucí pracoviště PET/CT
KNM FN Ostrava )
|
Tato metoda je vhodná i pro monitorování
odezvy nádorové tkáně na radioterapii, neboť se pomocí
ní zobrazuje metabolicky aktivní nádorová tkáň, na rozdíl
od buněk inaktivovaných; lze tak sledovat
"úspěšnost" terapie. Je m.j. schopna rozpoznat recidivu
nádoru (s proliferujícími buňkami) od jiných útvarů,
nekrotické či vazivové tkáně. Radioindikátory 18F- FMISO a 18F- FETNIM zobrazují
buněčnou hypoxii, která je důležitá z hlediska
nádorové angiogeneze a pro plánování radioterapie
(radiosenzitivita, kyslíkový efekt - viz níže "Fyzikální a
radiobiologické aspekty v radioterapii").
Normální celotělový scintigram skeletu
Mnohočetné
metastázy (ca prsu) do skeletu
Pro zobrazení metastáz v kostech, již v raném stádiu
infiltrace, se nejlépe osvědčuje scintigrafie skeletu
(celotělová scintigrafie v PA i AP projekci, s příp.
cílenými SPECT obrazy podezřelých míst) po aplikaci
osteotropních radiofarmak, což jsou fosfátové komplexy,
jejichž akumulace odráží zvýšenou osteoblastickou aktivitu
jako reakci na nádorovou destrukci kosti. Planární
celotělovou scintigrafii skeletu je užitečné doplnit
kombinovaným zobrazením SPECT/CT s fúzí
obrazů, pro upřesnění anatomické lokalizace lézí. U
karcinomu štítné žlázy je diagnostika založena na
scintigrafii po aplikaci radiojódu 131I.
Značené peptidy, které se vážou na peptidové
receptory na povrchu některých typů nádorových buněk, se
používají hlavně u neuroendokrinních nádorů,
obsahujících somatostatinové receptory (cyklický peptid somatostatin je látka
hormonálního charakteru, která má tlumivý účinek na tvorbu
některých hormonů, především růstového; řec. soma=tělo,tělísko,
statizo=stát, zastavit). K zobrazení
příslušných nádorů i k predikci efektu terapie
somatostatinovými analogy se používá umělý analog
somatostatinu, octreotid, označený indiem - 111In-pentetreotid
(OctreoScan), nebo 68Ga-DOTATOC pro PET scintigrafii.
Logickou návazností diagnostiky pomocí těchto
radioindikátorů je jejich označení terapeutickými
radionuklidy s aplikací pro radioisotopovou biologicky cílenou
radioterapii, viz níže "Radioisotopová terapie", pasáž "Radionuklidová terapie
nádorů a metastáz".
Dále se používají některé nespecifické indikátory
nádorů, jejichž zvýšená akumulace v nádorové tkáni je
založena na jejich schopnosti pronikat patologicky změněnou
permeabilitou stěn a kapilár a vázat se uvnitř viabilních
buněk. Používá se 99mTc-MIBI a Tetrofosmin, především u lymfomů a
karcinomu mamy (mamoscintigrafie). V onkologické diagnostice se
též ještě používá galiová scintigrafie
(většinou planární celotělové zobrazení, doplněné
příp. SPECT obrazy) s 67Ga-citrátem. Chemicky jsou ionty Ga analogy iontů Fe,
navazují se na transportní bílkovinu transferin a akumulují
se v proliferujících nádorových tkáních, zvláště u
lymfomů. Galiová scintigrafie se nyní již opouští a
nahrazuje se PET scintigrafií s 18F-značenými ligandy. Ve vývoji je teranostika pomocí
FAIP - zmíněná výše v "Fibroplastový aktivační protein FAP a jeho inhibitor
FAPI ".
Nepřímo lze na nádorové procesy usuzovat i z jiných
scintigrafických vyšetření, např. dynamické scintigrafie
ledvin, jater.
Multifaktoriální
analýza obrazů - radiomika
S použitím metod "strojového učení" a umělé
inteligence byly vyvinuty postupy tzv. radiomiky
- sofistikované analýzy obrazů ve spojení se statistickým
zpracováním dat z velkého počtu pacientů, které dokáží
rozpoznat i skryté informace, přímo
nevititelné vizuálně. Tyto analýzy mohou odhalit některé
podobnosti a shody, napomáhající upřesnit pravděpodobnou
diagnózu nádorových typů, příp. předpovědět odezvu na
terapii a průběh onemocnění. Je diskutováno v kapitole 4,
§4.7, odstavec "Muktifaktoriální statistická
analýza obrazů, radiomika".
Histologické
vyšetření
Pokud je pomocí zobrazovacích či jiných vyšetřovacích
metod nalezena anomální tkáň (novotvar), která by mohla být
nádorového původu, je nutno provést histologické
vyšetření: pomocí biopsie se odebere malý
vzorek tkáně, který se pak prohlíží pod mikroskopem.
Histologické vyšetření se provádí i u
"podezřelých" tkání odstraněných při
chirurgickém zákroku. Podle tvaru, velikosti a dalších
chararakteristik buněk lze zpravidla rozeznat, zda se jedná o
benigní či maligní tkáň a jakého druhu příp. nádorové
buňky jsou (jak bylo zmíněno výše). Všechny tyto
makroskopické a mikroskopické diagnostické informace
rozhodují o optimálním způsobu léčby nádorového
onemocnění.
× Diagnostika pro plánování
nádorové terapie
Pokud je při primární diagnostice potvrzeno nádorové
onemocnění, nastupuje etapa přípravy terapie - rozhodnutí o
základní strategii a metodice terapie: zda se bude jednat o
chirurgické řešení, chemoterapii, radioterapii, resp. o jaké
jejich kombinace (viz níže "Terapie nádorových
onemocnění"). Pokud se naplánuje radioterapie, mohou
obrazy získané z rtg CT, NMRI a gamagrafie (zvláště PET)
sloužit pro stanovení přesné lokalizace a rozsahu
nádorového ložiska a pro zakreslení zájmových
oblastí (ROI) ozařovaného objemu - GTV, CTV a nakonec
PTV do ozařovacího plánu (viz níže část "Plánování
radioterapie"). Jako
základ nyní slouží obrazy CT, popř. NMRI; ty však
odrážejí především morfologickou stránku, ale nezachycují
biologické chování tkáně. Je proto užitečné provést i
gamagrafické zobrazení, především PET obrazy distribuce 18FDG nebo 18FLT, popř. 18F-cholinu. Analýzou
těchto PET obrazů (např. stanovením úrovní SUV - viz §4.2,
část "Kvalita scintigrafického obrazu a detekovatelnost
lézí") můžeme stanovit "biologický
cílový objem" (BTV - Biological Target Volume)
nádorové tkáně, tvořený viabilními proliferujícími
buňkami. Pomocí přenesení těchto obrazů do
radioterapeutického plánovacího systému a počítačové
fúze obrazů (CT,NMRI)+PET můžeme pak zpřesnit
volum cílového ložiska, především CTV pro
radioterapii IMRT. Podle distribuce viability nádorových buněk
dále můžeme modulovat dávku uvnitř nádorového ložiska a
navýšit (eskalace, boost) dávky na rizikové oblasti uvnitř
nádoru.
l
Predikce odezvy na nádorovou terapii
Předpovědět biologickou odpověď na plánovanou léčbu je v
medicíně obecně úkol velmi nesnadný. U nádorové terapie
mohou určité základní informace přinést již výsledky z
primární zobrazovací a histologické diagnostiky. Existují
však možnosti, jak přímo posoudit konkrétní chování
nádorové tkáně na plánovaný druh léčby pomocí gamagrafických
zobrazovacích metod, především PET.
l
Monitorování distribuce cytostatik a
monoklonálních protilátek
Úspěšnost chemoterapie závisí m.j. na tom, zda se použitá
cytostatika či monoklonální protilátky dostatečně
akumulují (vychytávají) v nádorových ložiscích. K predikci
chemoterapeutického efektu může posloužit nukleární
medicína. Byly vyvinuty metody radionuklidového
označení některých chemoterapeutik: po
"zkušební" diagnostické aplikaci malého množství
takto označeného radioindikátoru můžeme zobrazit jeho
distribuci a posoudit, nakolik se selektivně vychytává v
nádorové tkáni (jakož i ve zdravých tkáních, které by
mohly být takto nežádoucím způsobem zatíženy) - takto se
pak bude vychytávat i příslušné chemoterapeutikum při
vlastní terapeutické aplikaci. Podobnou "zkušební"
diagnostickou aplikaci menšího množství g-radioindikátoru lze
použít i u radioisotopové terapie (viz
níže část "Radioisotopová terapie").
l
Zobrazení migrace dendritických buněk
Jedním ze základních předpokladů úspěšnosti imunoterapie
pomocí dendritických buněk, aktivovaných antigeny konkrétní
nádorové tkáně (viz níže "Terapie nádorových
onemocnění", pasáž "Imunoterapie"),
je jejich migrace do periferních lymfatických uzlin a pak do
nádorového ložiska. Označíme-li tyto aktivované
dendritické buňky před jejich opětovnou aplikací do
organismu pomocí vhodného radioindikátoru (zkouší se 111In-oxin), při
zachování jejich viability, můžeme po jejich aplikaci
scintigraficky mapovat jejich migraci do lymfatických uzlin.
O prediktivní úloze zobrazení buněčné apoptózy je
pojednáno v následujícím odstavci.
× Monitorování biologické odezvy
na nádorovou terapii
Kromě primární diagnostiky je žádoucí sledovat, nakolik je
terapie úspěšná a jaké jsou její vedlejší účinky na
zdravé tkáně, orgány a celý organismus. Z hlediska časové
relace vzhledem k terapii můžeme monitorování biologické
odezvy rozdělit na predikci biologického
efektu před terapií (zmíněnou výše) nebo na začátku
terapie, monitorování časné odezvy během
terapie a sledování pozdní odezvy a
celkového dlouhodobého vývoje onemocnění po
proběhnuté terapii. Pro posouzení pozdní nádorové odpovědi
je základem sledování nádorového ložiska na obrazech CT či
NMRI - srovnání velikosti (objemu) zobrazené
nádorové léze před terapií a po terapii pro posouzení
redukce nádorové hmoty. Obrazy CT a NMRI však zachycují jen morfologickou
situaci, nikoli biologický vývoj nádorové tkáně a
metabolickou aktivitu buněk - nerozeznáme na nich, jaká část
zobrazené léze rozdílné hustoty je tvořena viabilními
nádorovými buňkami a jaká část nekrotizovanou či vazivovou
tkání. Pro spolehlivé monitorování nádorové odezvy je
proto užitečné použít "molekulární" zobrazení
gamagrafickými metodami SPECT a PET. Jsou to především již
zmíněné obrazy distribuce 18FDG nebo 18FLT, provedené před terapií a po terapii (příp.
během terapie), na nichž příp. porovnáme hodnoty SUV.
Molekulární gamagrafické zobrazení umožňuje vizualizaci
důležitých faktorů, ovlivňujících odezvu nádorů na
terapii. Po jiné "linii" - radiobiologického
modelování - jde posuzování radioterapeutického
účinku pomocí veličin TCP, NTCP, UTCP, rozebíraných níže
v části "Predikce
radioterapeutického efektu - pravděpodobnost vyléčení
nádoru TCP a poškození normální tkáně NTCP".
Bezprostředně po skončení radioterapie nelze v
ozářeném nádoru zjistit žádnou makroskopickou změnu -
změny probíhají nejprve na molekulární úrovni. Až s
odstupem několika týdnů až měsíců tyto nitrocelulární
procesy vyústí v zánik větší části buněk v nádorové
populaci, což teprve může být doprovázeno pozorovatelnými
morfologickými změnami.
l Raná nádorová odpověď - zobrazení
buněčné apoptózy
Funkční molekulární zobrazení v gamagrafii však poskytuje i
další unikátní možnosti. Byly vyvinuty radioindikátory
umožňující monitorovat jeden z hlavních radiobiologických
mechanismů nádorové terapie (týká se radioterapie i
chemoterapie): apoptózu buněk. Při apoptóze
buněk (viz §5.2, část "Účinek záření na buňky", pasáž "Apoptóza buněk") dochází v rané fázi m.j. k ireverzibilní membránové
depolarizaci, k odkrytí fosfolipidů na povrchu
buněk, ke zvýšené permeabilitě plasmatické membrány,
posléze v pozdější fázi k porušení integrity buněčné
stěny a nakonec k rozpadu buněk a jejich fagocytóze. Právě v
rané fázi apoptózy zmíněná radiofarmaka jeví afintu
k apoptickým buňkám *): buď se navazují na
fosfolipidy na povrchu, nebo pronikají buněčnou membránou a
dochází k jejich akumulaci v cytoplasmě apoptických buněk.
Výsledkem je selektivní akumulace radioindikátoru v
apoptických buňkách a tkáních, zatímco do tkání
tvořených normálními viabilními buňkami, ani do tkání
nekrotických, téměř nevstupují.
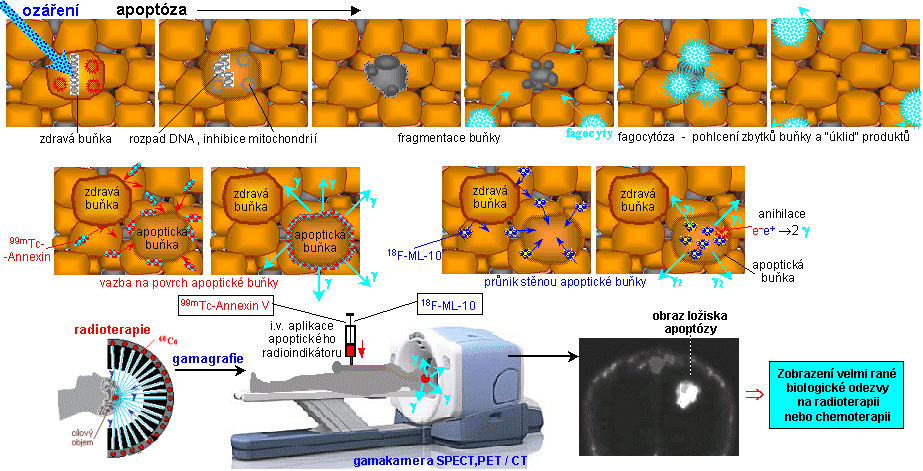
Gamagrafickým zobrazením distribuce těchto radioindikátorů (je vhodné použít dynamickou gamagrafii -
časový faktor akumulace) získáme
pozitivní obrazy těch míst, kde nejintenzívněji dochází k
apoptóze - ať již v důsledku ozáření, vlivem
cytotoxických látek, či ischemie. Molekulárním zobrazením
distribuce buněčné apoptózy můžeme tak monitorovat velmi
ranou odezvu buněk a tkání na terapii (radioterapii
či chemoterapii), již na začátku a v průběhu terapie.
Umožňuje v zásadě i predikci nádorové odpovědi:
aplikujeme "zkušebně" jednu či dvě frakce a na
gamagrafických obrazech můžeme posoudit, zda v cílové tkáni
probíhá dostatečně intenzívně apoptóza, příp. zda se v
heterogenním nádoru vyskytují oblasti apoptické rezistence.
Rané zobrazení apoptózy může hrát významnou úlohu v
biologicky individuální ("personalizované")
terapii konkrétního pacienta.
*) Ve stádiu laboratorního vývoje a
preklinických studií jsou tři typy radioindikátorů apoptózy
(viz též §4.8 "Radionuklidy a radiofarmaka pro
scintigrafii"):
- Protein
99mTc-Annexin V (pro
SPECT zobrazení) - navazuje se na fosfolipidy na povrchu
apoptických buněk;
- 18F-ML-10
[2-(5-Fluoro pentyl)-2-metyl malonic acid] - malá molekula,
která proniká stěnou apoptických buněk a hromadí se v
jejich cytoplasmě. Aplikuje se cca 400MBq .
- Peptid
18F-CP18
[pentapeptid obsahující triazol] - mapuje Caspase-3 aktivitu,
akumuluje se v apoptických buňkách.
Kombinace diagnostiky a
terapie - teranostika
Nové diagnostické zobrazovací metody, zvláště molekulární
zobrazení v nukleární medicíně, umožňují integrovat
individuální (personalizovanou) diagnostiku a cílenou terapii
(příp. i prevenci) závažných onemocnění do společného
oboru, pro který se nově začal používat název teranostika
(vzniklý složením názvů: terapie
+ diagnostika => teranostika,
angl. theranostics).
Scintigrafie umožňuje stanovit koncentrace biologicky
účinných látek přímo v místech jejich cíleného
působení, což umožňuje optimální a individuální
dávkování, s možností predikce účinků a monitorování
vysledků terapie - je podrobněji diskutováno v §4.9, pasáž
"Teranostika".
Terapie nádorových onemocnění
Z hlediska cíle a účinnosti obecně rozeznáváme dva druhy
léčby: Kurativní terapie (lat. cura=léčení) s
cílem úplného vyléčení nádorového onemocnění,
zvláště v lokalizovaném stádiu. V těžších a
pokročilejších případech pak paliativní terapie
(lat. pallium=plášť), zmírňující a zpomalující průběh onemocnění a
jeho obtíží. Z hlediska časové návaznosti rozeznáváme
rovněž dva postupy: Indukční terapie -
počáteční léčba s cílem dosáhnout remisi onemocnění. Po
této primoterapii (příp. i současně) se často aplikuje adjuvantní
terapie - pomocná, podporující či zajišťovací
léčba (lat. adiuvo = podporovat,
pomáhat), především pro snížení
rizika recidivy v důsledku možného mikrorozsevu v okolí
původního nádoru.
Léčení nádorových onemocnění se v
současné době opírá o tři hlavní metody: chirurgie,
chemoterapie a radioterapie,
přičemž tyto tři hlavní terapeutické postupy se často kombinují
- multimodální léčba. Při chirurgické
léčbě nádorových onemocnění se provádí fyzické
odstranění - resekce či ablace
(lat. ablatio = odstranění,
oddálení) nádorové tkáně. Je
žádoucí odstranit nejen primární nádor s
"bezpečnostním lemem", ale pokud je to možné i
další tkáně, do kterých by mohly být infiltrovány
nádorové buňky: jsou to především okolní mízní uzliny,
ležící v lymfatickém "povodí" dané lokalizace
tumoru (viz též výše §3.5, pasáž
"Radiačně
navigovaná chirurgie - sentinelové uzliny"). Vedle klasických
chrurgických technik se používá i radiofrekvenční
ablace a stereotaktická ablativní radiochirurgie
SRS (sterotactic radiosurgery) - viz víže "Stereotaktická
radioterapie".
Pro nechirurgickou léčbu
nádorových onemocnění bychom v ideálním případě
potřebovali nějaké "magické střely", které by
pronikly do organismu neinvazívním způsobem, zasahovaly a
likvidovaly cíleně jen nádorové buňky a
přitom zachovávaly nepoškozenou zdravou okolní tkáň.
Jelikož nádorová tkáň je tvořena buňkami, které se
příliš neliší od zdravých buněk okolních tkání, takovou
ideální a selektivní "střelu" nemáme: léčba
zaměřená proti nádorovým buňkám bude vždy více či
méně postihovat i některé zdravé buňky, tkáně a orgány.
Existují však určité fyzikální a biologické faktory,
které aspoň částečně podporují cílenou likvidaci
nádorových buněk a minimalizují poškození zdravých
tkání.
Z hlediska místa působení v organismu můžeme
terapii nádorových onemocnění rozdělit do dvou metodických
přístupů:
l Lokální
kontrola tumoru, při níž se snažíme zastavit
nádorové bujení a zlikvidovat buňky v konkrétním
nádorovém ložisku známé lokalizace a rozsahu. Provádí se
především metodou radioterapie - cíleným dopravením vysoké
radiační dávky do nádorového ložiska. Tento přístup je
účinný v případě dobře ohraničených nádorů menších
nebo středních velikostí, bez vzdálených metastáz.
l Systémová
terapie prováděná aplikací vhodných farmak do
organismu, které vstupují do nádorových ložisek a tam
zastavují proliferaci nebo likvidují nádorové buňky. Patří
sem chemoterapie cytostatiky a biologická léčba, částečně
i cílená radionuklidová terapie. Systémové působení má
své výhody i nevýhody. Výhodou je působení na vícečetná
nádorová ložiska a skryté metastázy, jejichž přítomnost a
lokalizaci někdy ani neznáme. Nevýhodou jsou nežádoucí
účinky na zdravé buňky a tkáně. Systémová terapie se
volí v případech rozsáhlejších nádorových onemocnění s
metastatickou infiltrací. A též jako adjuvantní terapie pro
snížení rizika recidivy a vzniku metastáz.
Níže budou nejprve stručně popsány metody
systémové i cílené chemoterapie a
biologické léčby, dále pak podrobněji metody cílené radioterapie
s využitím fyzikálních i radiobiologických aspektů.
Chemoterapie
a biologická léčba
Pod chemoterapií se obecně rozumí léčení
nemocí podáváním chemických látek - léků, které jsou
produktem chemické syntézy, nebo jsou izolovány z
přírodních materiálů (především rostlin) - a které
vyvolávají v organismu žádoucí (bio)chemické reakce.
Chemoterapie nádorových onemocnění se nejčastěji provádí
pomocí cytostatik - látek zastavujících nebo
tlumících růst a dělení buněk (řec. kytos=dutina,buňka,
statikos=zastavující). Jejich
přednostně protinádorový účinek je dán tím, že působí
především na rychle se dělící buňky. Zasahují však v
organismu i zdravé fyziologicky se dělící buňky, což vede k
nežádoucím vedlejším účinkům. Je známa celá řada
cytostatik, působících různými mechanismy a v různých
fázích buněčného cyklu. Jsou dva základní mechanismy
působení cytostatik:
1. Působení na DNA, což porušuje
buněčnou funkci, znemožňuje replikaci, může být
kontrolními uzly buněčného cyklu vyhodnoceno jako
neopravitelné poškození ® aktivace vnitřní signální dráhy apoptózy
(v tomto ohledu je mechanismus podobný jako u ionizujícího
záření).
2. Působení na jiné buněčné struktury,
především na mikrotubuly, což porušuje vlastní akt
dělení buněk - působí jako "mitotický jed".
Buňky jsou tím inaktivovány, nemohou se dále dělit,
podléhají apoptóze buď přímo, nebo následně po
"mitotické katastrofě" (viz §5.2, pasáž"Mechanismy
buněčné smrti").
Podrobněji se rozlišují čtyři různé
mechanismy působení cytostatik, podle nichž se tyto látky
rozdělují:
l
Alkylační
cytostatika - reagují s
bazemi v DNA, např. guaninu, jejich alkylací -
přenesením uhlíkaté radikálové skupiny C2nH2n+1 (alkylu).
Vede to k rozštěpení DNA nebo ke vzniku spojení dvou
řetězců. Toto poškození DNA inaktivuje buňky, znemožňuje
jejich dělení (vlákna DNA se nemohou rozplést a separovat),
vede nakonec k apoptóze. Cytostatický účinek byl
již dávno pozorován u analogů dusíkatého yperitu.
Z této skupiny se používá chlorambucil, cyklofosamid
či ifosfamid (vlastní cytostatický účinek má až
metabolit oxycyklofosfamid vznikající v jádře),
dále fludarabin a bendamustin.
Do této skupiny patří i platinová cytostatika.
Nejdéle používaným cytostatikem tohoto druhu je cisplatina
(cis-[PtCl2(NH3)2]), anorganická molekula která se váže na guaninové
baze v molekule DNA; novější jsou organické sloučeniny karboplatina
a oxaliplatina, kde jsou atomy platiny vázané na
cyklické ("aromatické") uhlovodíky.
l
Mikrotubulové
inhibitory - reagují s mikrotubuly
v buňkách, zabraňují vzniku mitotického vřeténka - mitotické
jedy. Jedná se o dva druhy chemických látek, které mají
vzájemně opačné mechanismy mikrotubulárního působení,
avšak vyúsťují v podobné cytotoxické účinky:
- terpenidy tisu - taxany. Používají
se alkaloidy paclitaxel (obsažený v
tisu Taxus brevifolia) a docetaxel (z tisu Taxus braccata), které
stabilizují polymery mikrotubulů (inhibice depolymerace
mikrotubulů) a zabraňují separaci chromosomů
při anafázi.
- alkaloidy barvínku (Vinca) - vinkristin,
vinblastin, vinorelbin, které se váží na tubulin a
zabraňují jeho polymeraci do mikrotubulů.
l
Antimetabolity blokující syntézu purinových a pyrimidinových
bazí DNA, potřebnou při buněčné replikaci. Používají se
látky se strukturou podobnou purinům a pirimidinům - fluoropirimidiny,
především preparáty metotrexát nebo
5-fluorouracil (5-FU). Nověji se s výhodou používá
prekurzor 5-FU, kapecitabin (capecitabine), z něhož
účinná látka 5-fluorouracil vzniká enzymatickými
přeměnami až v organismu, a to přednostně v nádorové
tkáni (enzym thimidinfosfortiláza,
která se účastní poslední fáze přeměny neúčinného
kapecitabinu na účinný 5-FU, je obsažen v nádorových
buňkách většinou v podstatně vyšší koncentraci než v
buňkách zdravé tkáně - selektivní účinek).
l
Inhibitory
topoizomerázy v S-fázi
buněčného cyklu zabraňují rozvinování dvoušroubovice DNA
při procesu replikace (kterého se účastní enzym topoizomeráza).
Vede to k indukci jednovláknových zlomů DNA, které mohou
způsobit buněčnou smrt. Původní látkou tohoto druhu byl kamptotecin,
alkaloid izolovaný z čínského stromu Camptotheca
acuminata. Vhodnější farmakologické vlastnosti však
mají jeho syntetické deriváty topotekan a irinotekan.
l
Protinádorová
antibiotika jsou původně
látky inhibující růst a rozmnožování mikroorganismů,
používané proto při léčbě infekčních nemocí, dále jako
protiplísňové prostředky a pod. Jsou sekundárními
metabolity mikroorganismů (bakterie, plísně), řada z nich se
nyní připravuje uměle (syntetickými nebo polosyntetickými
postupy). Jelikož většina z nich ve své chemické struktuře
obsahuje několik skupin cyklických uhlovodíků
("benzenových jader") charakteristických pro
antracen, nazývají se též antracyklinová antibiotika.
Vedle antibiotického účinku u některých těchto látek byl
zjištěn i imunosupresivní účinek a účinek cytostatický,
protinádorový, antiproliferativní. Mechanismem
cytostatického účinku je patrně vazba na DNA - jejich
molekuly mají schopnost se včleňovat mezi páry bazí DNA;
dochází ke zlomům DNA, vznikají interkalační vazby s
poruchou transkripce (pevné spojení obou vláken DNA
znemožňuje její kopírování před dělením buňky a
transkripci do RNA), DNA se rozpadá (účinek je podobný jako u
záření nebo alkylačních cytostatik). Dochází též k
blokádě enzymu topoizomerázy, která se podílí na
změnách v prostorovém uspořádání DNA při replikaci před
dělením buňky; při její blokádě se nespojují jednotlivé
části DNA, která se rozpadá. Příkladem je doxorubicin,
bleomycin, epirubicin, idarubicin, mitomycin C.
Do
této skupiny částečně patří i rapamycin,
původně izolovaný z bakterie Streptomyces hygroscopicus
objevené v půdě na Velikonočním ostrově Rapa Nui;
nazývá se též sirolimus (lat. siro
= jáma vykopaná v půdě, limus = bahno, kal). Řadí se mezi makrolidní antibiotika,
blokující syntézu proteinů v mikroorganismech vazbou v
ribosomech. Pro jeho imunosupresivní účinky se používá při
transplantacích jako ochrana proti nežádoucím imunitním
reakcím, které mohou vést až k rejekci transplantátu.
Inhibicí proteinkinázy mTOR *) blokuje řadu
nitrobuněčných procesů, což vede k útlumu proliferační
aktivity buněk. Brání přechodu buněk z fáze G1 buněčného
cyklu do fáze S, čímž způsobuje zástavu buněčného cyklu.
Zvyšuje citlivost nádorových buněk k radioterapii i
účinnost chemoterapie. Rapamycin tak patří současně i do
níže uvedené skupiny inhibitorů kináz, kde se
používají jeho nové deriváty temsirolimus a everolimus.
*) Rapamycin,
mTOR
mTOR (mammalian Target Of Rapamycin) - tento
značně zavádějící název pochází z toho, že
příslušná proteinkináza byla poprve objevena při aplikaci
rapamycinu na ca prsu. Alternativní název je "mechanistic
target of rapamycin". Později se ukázalo, že mTOR
působí i v dalších typech nádorových buněk. Signální
kaskáda PI3K/Akt/mTOR se totiž významě podílí na procesu
kancerogeneze, její inhibice může být důležitým faktorem
nádorové terapie.
l
Antioxidanty
jsou známé především
jako prevence nádorových onemocnění. Ukázalo se však, že
některé antioxidanty (jako je reveratrol, genistein,
baikalein) poškozují DNA a zabíjejí dělící se buňky.
Toho by se dalo využít v protinádorové terapii. Jejich
výhodou je, že navzdory své genotoxicitě nemají mutagenní
účinky. Zatím je to ve stádiu biologického výzkumu.
l
Bifosfonáty
působí jako inhibitory
osteoklastické resorpce kostní tkáně. Lze je proto využít k
sekundární léčbě kostních nádorů,
především metastáz, kde působí především proti erozi
kostní tkáně; nejedná se o cytostatikum. Účinným
dusíkatým bifosfonátem je především kyselina
zoledronová. V kombinaci např. s docetaxelem se projevuje
aditivní synergický protinádorový účinek - potenciace
účinku cytostatika.
Jednotlivá cytostatika se někdy kombinují,
např. FOLFOX (oxaliplatina+5-florouracil+kys.listová), XELOX
(kapecitabin+oxaliplatina), FOLFIRI (5-florouracil+irinotekan) a
další. Společnou nevýhodou klasických cytostatik je jejich
systémový nespecifický účinek -
působí nejen na nádorové buňky, ale i na zdravé
fyziologicky se dělící buňky. To vede k řadě často
závažných vedlejších nežádoucích (toxických) účinků.
Zkouší se proto nová varianta cílené "dopravy"
vhodného cytostatického preparátu přímo do míst zhoubného
nádoru, za použití mikrokapslí o velikosti do 5mm. Takové
drobounké kapsle, vytvořené z vhodné organické látky a
uvnitř nesoucí cytostatikum, po aplikaci procházejí cévním
systémem i jemnými krevními vlásečnicemi. Lze je sledovat
sonograficky nebo magnetickou rezonancí; v okamžiku, kdy
dorazí k nádoru, mohou být pomocí ultrazvukové vlny
rozrušeny, čímž se cytostatikum uvolní v potřebném místě
- v nádoru.
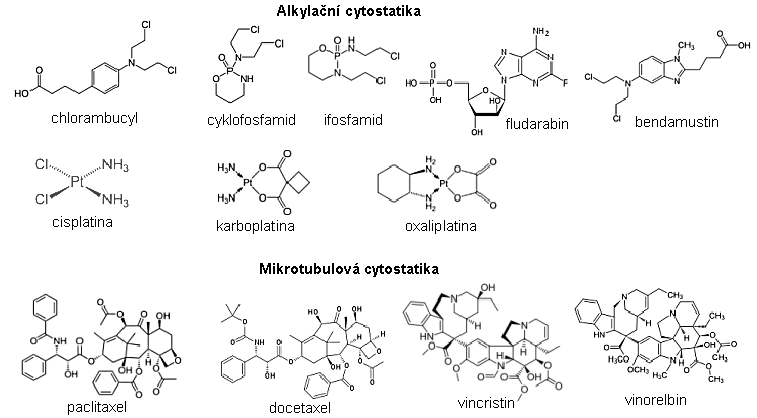
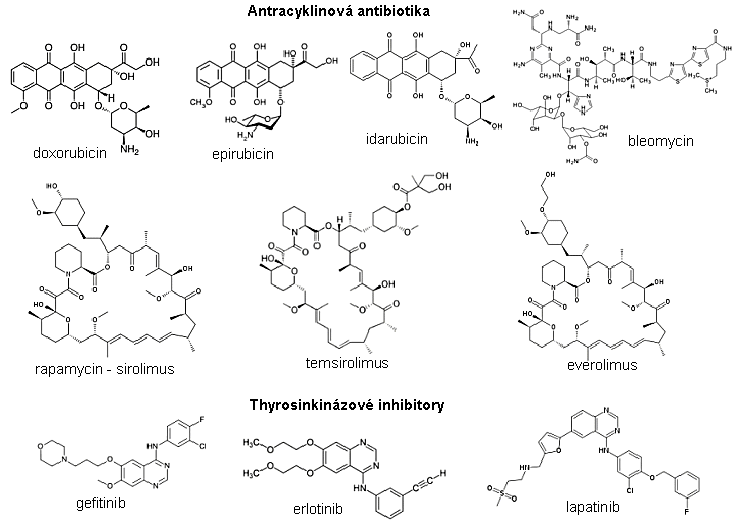
Chemická struktura některých cytostatik používaných při
chemoterapii nádorových onemocnění
Cílená
biologická léčba
V posledních letech se rychle rozvíjejejí poznatky molekulární
biologie a genetiky, které m.j. odhalují
složité mechanismy buněčné komunikace a specifické
molekuly, které jsou významné pro maligní transformaci
buněk. Ty by se mohly stát cílem specifických léčebných
zásahů: identifikovat a cíleně ovlivňovat některé
struktury v nádorových buňkách za účelem zabránění
další proliferace nádorové tkáně. Na těchto mechanismech
je založena cílená biologická léčba,
jejíž strategie je zaměřena proti vybraným druhům molekul a
jejich signálních drah, podílejích se na maligním chování
buněk příslušných druhů nádorů. Spolu s účinnější
terapií tyto postupy umožňují omezit nežádoucí
vedlejší účinky.V současné době se hlavní zájem
soustřeďuje na tzv. růstové faktory (stimulující
růst a dělení buněk) a jejich receptory, především EGFR,
HER2 a VEGF (viz níže).
Vyvíjí se nová skupina preparátů, které selektivně
blokují činnost těchto onkogenních proteinů, s minimálním
poškozením normálních buněk. Jedná se především o dvě
skupiny látek s různým mechanismem působení :
l Monoklonální
protilátky
jsou speciální proteiny ze skupiny imunoglobulinu (příp. jejich fragmenty), které
se získávají z klonované populace jednoho
druhu aktivovaného B-lymfocytu z plasmy imunizovaného
organismu. Monoklonální protilátka má proto přesně
definované vlastnosti a specificky se váže na
příslušné receptory. Některé monoklonální protilátky se
snaží přiblížit ideálnímu terapeutiku -
"magickému šípu", který
by zasahoval jen cílové patologické buňky a
neměl škodlivé účinky na ostatní zdravé buňky. Toto však
zatím nelze 100% dosáhnout..!..
Struktura monoklonálních
protilátek
Molekulová hmotnost monoklonálních protilátek se pohybuje
kolem 150 kDa. Struktura bílkovinných molekul
imonoglobulinů se často schématicky znázorňuje tvarem
písmene "Y" (na obrázku vlevo - a). Větvená část -
raménka - se skládají ze dvou heterodimerů, je tvořeny
čtyřmi polypeptidickými částmi, uspořádaných do dvou
zrcadlově identických párů "těžkých"
H a "lehkých" L řetězců. Jsou
vnitřně propojeny disulfidovou vazbou (S-S). Lehké a těžké
řetězce obsahují konstantní a variabilní
oblasti.Variabilní oblasti, umístěné na koncích, obsahují
krátké aminokyselinové sekvence (zvané
někdy "hepervariabilní"),
které učují vazbovou antigenní specifitu
protilátky. Proto se tato raménka označují jako Fab (Fragment antigen binding).
"Nožička" ve schématu protilátky je tvořena dvěma
těžšími řetězci, označuje se jako Fc
(krystalizující fragment). Tento konstantní úsek Fc odpovídá za efektorové
funkce protilátky (interakci s T-lymfocyty, makrofágy)
- aktivaci systémů vedoucích ke zničení cílových buněk.
Příprava monoklonálních
protilátek - hybridomová technologie
Jelikož nedovedeme dostatečně účinně kultivovat přímo
požadované klony aktivovaných B-lymfocytů, je příprava
monoklonálních protilátek složitou biochemickou
technologií. Velmi vhodnými "pomocnými nosiči " pro
přípravu monoklonálních protilátek se ukázaly být myelomové
buňky (jsou to jinak
nádorové buňky myelomu, hematoonkologického
onemocnění kostní dřeně, vznikající nekontrovatelným
množením myelomových buněk), které
svými neomezenými replikačními schopnostmi a dlouhou
životností jsou velmi vhodné pro kultivaci a fúzování in
vitro. Nejdříve se tedy indukuje tvorba těchto
"pomocných" myelomových buněk u
pokusných laboratorních zvířat. Ty se pak odeberou a
kultivují se in vitro. Mezitím se u jiného laboratorního
zvířete injekcí konkrétního antigenu vyvolá imunitní
reakce s aktivací B-lymfocytů a následnou produkcí
protilátek. Tyto B-lymfocyty se odebírají z lymfatického
systému (většinou ze vzorku sleziny) použitého zvířete a in vitro se pak zfúzují
s kolonií myelomových buněk. Z této fúze vznikají hybribní
buňky (zvané hybridomy), které si zachovávají vlastnosti myelomových buněk
i požadovaného klonu B-lymfocytů, rychle se dělí a produkují
protilátky B-lymfocytů, použitých při fúzi.
Pomocí speciálních separačních metod se z nich vyselektují
pouze hybridomy produkující jen jeden
požadovaný klon protilátek - monoklonální
protilátku.
Tuto důmyslnou biotechnologii poprve
vyvinuli v r.1975 G.F.Kohler a C.Milstein v laboratořích
Molekulární biologie university Cambridge a Institutu
imunoloogie v Basileji (za tuto metodu obdrželi Nobelovu cenu v
r.1984).
 |
Monoklonální
protilátky.
a,b) Schématické znázornění a
ilustrace základní struktury. c)
Myší monoklonální protilátka. d,e,f)
Chimérická, humanizovaná a lidská protilátka. |
Laboratorními zvířaty, používanými v
procesu přípravy monoklonálních protilátek, jsou téměř
vždy myši, takže primárně vzniká myší
monoklonální protilátka (c). Při jejím humánním
použití může někdy docházet k nežádoucím
imunitním reakcím - imunogenicita
v důsledku vzniku lidských-anti-myších protilátek HAMA
(human anti-mouse antibodies). To jednak znemožňuje
navázání monoklonální protilátky na cílový antigen a
dále též může vést k imunitním anafylaktickým reakcím.
Proto je snaha nahrazovat části molekul (které nekódují
oblasti vazby antigenu) úseky lidského
imunoglobulinu - humanizovat protilátky pomocí
sofistikovaných biochemicko-genetických metod ("genetického inženýrství"). Z původní hybridonové linie, produkující myší
protilátky daného zacílení, se připraví RNA a dále v
reakci, katalyzované enzymovou reverzní transkryptázou, komplementární
cRNA - . Polymerázovou reakcí se namnoží úsek,
kódující vazebné místo pro antigen. Touto genetickou
sekvencí se nahradí odpovídající úsek v genu pro lidský
imunoglobulin. Takto vzniklý nový gen se vloží do vhodné
recipientní savčí buňky, která pak syntetizuje
monoklonální protilátku s převládajícím obsahem
lidského imunoglobulinu. Humanizovaná monoklonální
protilátka má konstantní úseky z lidského imunoglobulinu a
pouze variabilní úsek, kódující antigenní specifitu,
pochází z myší protilátky. Takto transformované protilátky
mají požadovanou antigenni specifitu a vykazují jen
minimální imonogenicitu. Tímto způsobem se vytvářejí chimérické
(zkřížené) protilátky (obsah cca 60% lidské protilátky), humanizované
(obsah více než 90% lidské protilátky), či 100% humánní
protilátky - na obr. d),e),f). Čím více je protilátka
"zvířecí", tím větší riziko imunogenicity lze
očekávat. Humanizace monoklonálních protilátek naopak vede
ke snížení nežádoucí inunogenicity, na druhé straně však
i k možnému snížení jejich účinnosti...
Fragmenty protilátek
Čím větší je molekula bílkoviny, tím pomalejší a
obtížnější je její průnik do cílových tkání. Proto se
místo "celých" protilátek připravují vhodné fragmenty
protilátek, obsahující jen úseky se zachovanou antigenní
specifitou. Nejčastěji to jsou Fab´ fragmenty,
obsahující domény nezbytné pro vazbu na antigen, nikoli však
část Fc interagující efektorově.
Nano-protilátky - Nanobody
Nejdůslednější "miniaturizací"
monoklonálních protilátek jsou tzv. nanobody,
sestávající pouze z variabilní domény protilátky s
těžkým řetězcem Fab H, bez domény lehkého řetězce a
samozřejmě bez části Fc. Název "nanobody" pochází z její
namometrické velikosti - délky cca 4 nm a šířky cca 2 nm,
molekulová hmotnost je pouze kolem 15 kDa. Schopnost
nano-protilátek vázat příslušný antigen však zůstává
zachována jako u konvenčních protilátek. Navíc
nanoprotilátky vykazují lepší stabilitu, hydrofilitu a
rozpustnost ve vodě, hloubkovou penetraci tkání a rychlé
odstranění z krevního řečiště, což napomáhá jejich
velmi dobré výsledné vazebné afinitě v různých
podmínkách.
Nanobody mají výborné vlastnosti především v
diagnostickém zobrazování nádorových tkání.
Obrazy s vysokým poměrem signál-šum lze získat již v
časném období po aplikaci, díky rychlé akumulaci nanobody a
rychlému úbytku v krvi.
Terapeutická účinnost samotných nanobody je
však omezena nepřítomností efektorového Fc fragmentu. Pokud jsou
však nanobody cheletačně konjugované s terapeutickým
radionuklidem beta či gama, je terapeutický potenciál
zachován - biologicky cílená radionuklidová terapie.
Názvosloví monoklonálních
protilátek
Nomenklatura monoklonálních protilátek je propracována tak,
aby již z názvu bylo možno poznat základní
typ a nejdůležitější vlastnosti
(zacílení) konkrétního preparátu (protilátky). Název se
skládá ze 4 částí : předpona - označení cílové
struktury - biologický typ (původ) - přípona (ta je vždy -mab:
monoclonal antibody)
:
| Název
monoklonární protilátky : |
| předpona - |
- cílová
struktura - |
-
biologický původ - |
- přípona |
variabilní
(individuální) |
-
ci(r) - cévní systém
- tu(m) - nádor
- li(m) - imunitní systém
|
-
m(o) - myší
- xi - chimérický
- zu - humanizovaný
- u - humánní |
- mab
(monoclonal
antibody) |
Jako příklad můžeme uvést ......, nebo rituximab
- chimérická monoklonální protilátka (-xi-), jejíž
variabilní část, zprostředkovávávající kontakt s
antigenem CD20 tumorových buněk (-tu-), je myšího původu a
zbytek protilátky je lidského původu.
V literatuře se někdy uvádějí i další
podrobnější dělení - v cílové struktuře pro konkrétní
typy nádorů (-co(l)- nádor tlustého
střeva, -go(v)- nádor vaječníku, -ma(r)- nádor prsu, -me(l)-
melanom, -neu(r)- nervový systém, -pr(o)- nádor prostaty,
-vi(r)- viry. .....), v biologickém
původu další možnosti (-a- krysa, -e-
křeček, -i- primáti, .....); s těmito
názvy se však v praxi nesetkáváme... U některých
preparátů se kromě samotné monoklonální protilátky uvádí
i název biochemicky konjugované látky (např.
ibritumomab tiuxetan - ......).
Biologické účinky
monoklonálních protilátek
Aby se mohl navodit požadovaný efekt (terapeutický
či diagnostický), musí se nejprve
protilátka dostat k cílovým tkáním a buňkám.
Monoklonální protilátky se aplikují intravenózně pomalou
infuzí roztoku. .... Monoklonální protilátky mají poměrně
velké molekuly o hmotnostech kolem 150kDa, min. 100-krát
větší než běžná cytostatika. Proto mají pomalejší
distribuční kinetiku a hůře pronikají do nádorové tkáně,
s pomalou difuzí přes intersticiální prostor. Jejich
distribuce v nádoru bývá nehomogenní, zvláště u větších
nádorů.
Monoklonální protilátky mají schopnost
reagovat s konkrétním antigenem, proti němuž jsou zacíleny.
Pokud je cílovou struturou receptorový ligand, dochází k
neutralizaci tohoto ligandu. Je-li cílová struktura receptorem
na povrchu buněčné membrány, dochází k zablokování
signální cesty, která je s ním spojena. Řada
monoklonálních protilátek má tak inhibiční účinky
pro určité ligandy a signální dráhy
(či někdy i stimulační).
Častým cílem léčby je likvidace
určitého druhu buněk - depleční proces. Podmínkou
vazby na cílové buňky je přítomnost příslušných receptorů.
Vazbová antigenní komplementarita protilátky je dána
variabilními úseky na koncích řetězců Fab, zatímco fixní
úsek Fc zprostředkovává následné efektorové funkce na
cílové buňky. Po úspěšném navázání protilátky může
docházet ke třem různým mechanismům výsledného
cytocidního účinku :
- Aktivace komplementů - membránových
glykoproteinů C1-C9, které svými proteolytickými účinky
atakují cytoplasmatické buněčné membrány a způsobují
jejich penetraci. Buňka zaniká
a uvolněné chemické látky způsobují zánětlivou reakci s
kumulací leukocytů (srov. s §5.2,
pasáž "Mechanismy
buněčné smrti").
- Indukce fagocytózy - fixní Fc oblast
navázané protilátky (dolní část
písmene "Y" ve schématu) se specificky
váže na Fc receptor některých typů leukocytů, zejména
makrofágů, které tak rozpoznávají a následně fagocytují
nádorové buňky.
- Indukce apoptózy po vazbě protilátky na
buněčný povrch, s destrukcí mitochondrií a proteolytickým
kaspázovým řetězcem (podrobný výklad
v §5.2., pasáž "Apoptóza";
na obrázku vpravo nahoře "Vnější signální
cesta apoptózy").
Imunogenicita
monoklonálních protilátek
Monoklonální protilátky, jakožto imunitně aktivní agens,
mohou po aplikaci do organismu vytvářet "protilátky
proti protilátkám", které mohou jejich účinek neutralizovat
a navíc způsobovat nežádoucí anafylaktické účinky
- bylo již diskutováno výše. Nejčastěji se imunogecita
vyskytuje u myších protilátek (HAMA, ve cca 10%), ojediněle u
chimérických, velmi vzácně i u hamanizovaných. Před
použitím myších protilátek je proto žádoucí provést
laboratorní biochemický test na HAMA
protilátky, jeho příp. pozitivita by pak měla být kontraindikací
k použití těchto přípravků.
Použití monoklonálních
protilátek
Vedle onkologie (viz níže) se monoklonální protilátky
používají i proti autoimunitním onemocněním, proti rejekci
transplantovaných orgánů, zánětlivým onemocněním. Též
jako antibakteriální a protivirové.
Monoklonální protilátky se v onkologii
používají především k samostatné cílené
biologické terapii nádorových onemocnění (viz
níže). Kromě toho se na ně mohou navázat cytotoxické látky
či radioisotopy, které tyto protilátky pouze
"navádějí", přibližují nebo vázají k cílovým
buňkám - vznikají protilátkové konjugáty s
vhodnými efektorovými složkami.
Radioaktivně značené protilátky
- radioimunokonjugáty
Důležitou novou metodou biologicky cílené terapie
nádorových onemocnění je spojení cílené vazby
monoklonálních protilátek s biologickými účinky ionizujícíího
záření z radionuklidů. Radioimunokonjugáty
mají v molekule protilátky navázán beta či alfa radionuklid
k biologicky cílené radionuklidové terapii -
viz níže "Radioisotopová
terapie otevřenými zářiči".
Monoklonální protilátka zde neslouží jako primární
terapeutikum, ale zajišťuje "dopravení" a
přiblížení radioaktivní látky k nádorovým buňkám.
Výhodou těchto radioimunokonjugátů je, že pro dosažení
biologického účinku není potřeba jejich navázání na
každou nádorovou buňku, ale emitované záření efektem
"křížové palby" má akční rádius
několik desítek buněčných průměrů (viz níže obr.3.6.8 v
části "Radioisotopová terapie").
Mohou být proto účinné i v okolních buňkách, které
nemají dostatečnou expresi nádorového antigenu.
Některé monoklonální protilátky, označené gama nebo
pozitronovými radionuklidy, se používají v nukleární
medicíně jako radioindikátory při scintigrafické
diagnostice - §4.8 "Radionuklidy a radiofarmaka pro
scintigrafii", pasáž
"Imunoscintigrafie". Je to především v nádorové
diagnostice, ale i např. v diagnostice zánětlivých
ložisek pomocí antigranulocytárních
monoklonálních protilátek.
Monoklonální protilátky v
onkologii
V onkologické terapii se používá řada
monoklonálních protilátek, některé z nich stručně
vyjmenujeme :
Cetuximab - chimérická
monoklonální protilátka, která se kompetitivně váže na
extracelulární doménu epidermálního růstového faktoru EGFR
(HER1) a inhibuje vazbu dalších možných aktivátorů růstu
tumoru; podobné účinky má panitumumab.
Trastuzumab (herceptin)
funguje jako monoklonální protilátka proti HER2 (Human
Epidermal Receptor), váže se na extracelulární doménu HER2 a
blokuje tím přístup epidermálního růstového faktoru k jeho
receptoru; tím se zabrání aktivaci signální dráhy
buněčných pochodů a růstu nádoru (HER2 -
pozitivního). Podobné účinky má pertuzumab,
který se váže na dimerizační doménu HER2 a tím brání
jeho dimerizaci s dalšími receptory skupiny HER. Pro zvýšení
účinku blokády HER2-signalizace se zkouší kombinace trastuzumab+pertuzumab
(příp. +docetaxel), která vykazuje synergní aktivitu. U
hormonálně dependentních nádorů se zkouší i kombinace
herceptinu s inhibitory aromatázy (jako je anastrozol nebo
ietrozol). A obecně herceptin v kombinaci s chemoteraputiky kapecitabinem
nebo 5-fluorouracielem a cisplatinou je
indikován u různých HER2-pozitivních metastazujících
nádorů.
Bevacizumab (Avastin)
je humanizovaná monoklonální protilátka proti vaskulárnímu
endotelovému růstovému faktoru VEGF (Vascular Endothelial
Growth Factor - odtud "ci"), která vychytává
cirkulující VEGF v plazmě a tím vede k inhibici nádorové
neoangiogeneze. Podobné účinky má ranibizumab
(Lucentis), který se
používá v oftalmologii u terapie vaskulárně
podmíněné makularní degenerace sítnice.
Rituximab - chimerická monoklonální
protilátka typu IgG1, specificky namířená proti CD20
antigenu, je často používaným preparátem u maligních
B-lymfomů.
Ipilimumab je monoklonální
protilátka způsobující aktivaci cílení
CTLA-4, kde cytotoxické T-lymfocyty mohou rozpoznat a ničit
nádorové buňky (vypíná inhibiční mechanismus a umožní T
lymfocytům fungovat). Používá se pro léčbu melanomu,
nemalobuněčného plicního karcinomu, ca močového měchýře
a ca prostaty.
Nivolumab je lidská IgG4 anti-PD-1 monoklonální
protilátka, rovněž fungující jako inhibitor kontrolního
uzlu, blokujícího aktivovaným T-lymfocytům
útok na nádorové buňky. Používá se rovněž u maligního
melanomu (v kombinaci s ipilumomabem), ca plic a ca
ledvin.
Atezolizumab působí jako inhibitor
ligandu PDL1 programované buněčné smrti. Používá se
především u nemalobuněčného ca plic.
Dalším možným mechanismem, spolupodílejícím
se na protinádorovém účinku některých monoklonálních
protilátek, je "označení" buňky, na jejímž
povrchu je přítomen příslušný receptor; takto označené
buňky jsou pak napadány a likvidovány imunitními procesy
organismu. Účinnost monoklonálních protilátek v nádorové
léčbě je závislá na přítomnosti a funkčnosti
příslušných receptorů na membránách
nádorových buněk. Pokud je těchto receptorů málo, nebo jsou
nefunkční či zmutované, je protilátka neúčinná...
Monoklonální protilátky též mohou být "nositeli",
na něž se naváže vhodné chemoterapeutikum či radionuklid.
Dlouho používaným radioaktivním preparátem tohoto druhu je Ibritumomab
Tiuxetan značený 90Y (Zevalin) proti CD20 u non-hodgkinovských
lymfomů. Nověji se zde používá Lilotomab
značený 177Lu, zacílený proti CD37. Nejperspektivnějším se zde
však jeví 177Lu nebo 225Ac značený ligand anti-PSMA (PSMA-617)
u karcinomu prostaty, který je schopen vyléčit i pokročilý
metastatický hormonálně indepedentní ca prostaty.
Další podrobnosti viz níže "Radioisotopová
terapie", pasáž
"Radioimunoterapie".
Duálně
zacílené (bispecifické) monoklonální
protilátky
Na nádorových onemocněních (i na některých dalších
závažných onemocněních - zánětlivých, autoimunitních,
degenerativních) se podílejí různé faktory a probíhá zde
řada složitých procesů s mnohočetnými signálními drahami
mezi buňkami. I když monoklonální protilátky (MAb) dokážou
účinně ovlivňovat konkrétní signální dráhy, je často
obtížné dosáhnout uspokojivých kurativních výsledků s
jedním daným preparátem. Někdy se proto kombinují různé
druhy chemoterapeutik. To však může přinášet další
problémy s nežádoucími interferencemi, vedlejšími účinky,
možností nežádoucích imunitních odpovědí.
V
oblasti monoklonálních protilátek je však v principu možné
i alternativní "elegantnější" řešení:
Vyvinout takové molekuly protilátek, které mají dvě
vazebná místa zaměřená na dva různé
antigeny daného procesu. Tyto tzv. bispecifické
protilátky (BsAb) s dvojím zacílením
("dva v jednom") pak mohou vykazovat lepší
terapeutické účinky než klasické jednosměrně zacílené
monoklonální protilátky. Dva mediátory jsou zacíleny jedinou
molekulou.
Začlenit
různé specifické ligandy s vazbou na různé receptory do
ramének Fab molekul protilátek lze několika způsoby. Buď
křížovým propojením dvou protilátek s dvěma různými
dvojicemi variabilních Fab fragmentů s různými antigenními
vazbami. Nebo se do raménka Fab místo jednoho z řetězců,
např. "b", chemicky naváže jiný "b' " s
odlišným zacílením - vznikne fragment Fab'.
Případně se v protilátce IgG vytvoří variabilní oblasti
těžkého a lehkého řetězce, klonovaných ze dvou různých
protilátek. Jsou ještě další komplikovanější možnosti...
Stručně
vyjmenujeme některé bispecifické protilátky, které již
našly klinické uplatnění :
-> Blinatumomab
u maligních B-lymfoidních buněk u non-Hodkinsonového lymfomu,
specifiický pro CD19 a CD3 na efektorových T-lymfocytech.
-> .Mosunetuzumab
je monoklonální protilátka používaná k léčbě
folikulárního lymfomu. Bispecificky se váže na CD20
obsaženou v B-lymfocytech a na CD3 nacházející se v
T-buňkách. T-buňky se tím stimulují k ničení nádorových
buněk lymfomu.
->
Emicizumab je bispecifická protilátka pro léčbu
hemofilie A. Váže se jak na aktivovaný koagulační faktor IX,
tak na faktor X jehož aktivaci zprostředkovává.
-> Amivantamab
je bispecifická monoklonální protilátka používaná k
léčbě nemalobuněčného karcinomu plic (speciálního
druhu s inzerční mutací exonu 20 receptoru epidermálního
růstového faktoru EGFR). Zaměřuje se na receptor
epidermálního růstového faktoru (EGF) a receptor
mezenchymálně-epiteliálního přechodu (MET).
-> Cadonilimab
se váže simultánně na antigeny PD-1 a CTLA-4, které jsou v
nádorových tkáních exprimovány v mnohem vyšších
hladinách ve srovnání s normálními tkáněmi. Tato dvě
zacílení zprostředkovávají zvýšenou buněčnou cytotoxitu
a buněčnou fagocytózu. Bispecifický cadonilimab (který nahrazuje kombinací nivolumabu a ipilimumabu)
vykazuje slibnou účinnost u karcinomu děložního čípku,
žaludku, hepatocelulárního karcinomu.
-> Faricimab
(RG7716) se používá v oftalmoloii u terapie vaskulárně
podmíněné makularní degenerace. Zaměřuje se jak na
vaskulární endoteliální růstový faktor VEGF-A, tak i na
inhibitor angioproteinu ANG-2. Stabilizuje tím krevní cévy v
sítnici a vykazuje lepší účinky než zatím používaný
aptamer pegaptanib (Macugen) nebo
monoklonální protilátka ranibizumab (Lucentis).
l Mimetické protilátky,
Affibody
Vedle "pravých" monoklonálních protilátek se
používají i tzv. mimetické protilátky -
peptidy nebo malé bílkoviny (s molekulovou hmotností cca 3-20
kDa), které se stejně jako protilátky mohou vázat na
antigeny, ale které strukturně nejsou podobné příslušným
protilátkám (název pochází z řec. mimesis
= mimikry, napodobit, imitovat).
Hlavním představitelem těchto látek jsou tzv. affibody
skládající se ze tří šroubovic s 58 aminokyselinami s
molekulovou hmotností cca 6kDa. Ve fázi vývoje je jejich
použití pro diagnostické zobrazování a cílenou terapii.
l
Inhibitory
kináz (thyrosinkinázové
inhibitory) jsou látky, které blokují signální dráhy
určitých kináz (jedné nebo několika), čímž
tlumí buněčné dělení a stimulují apoptózu. Může to
vést ke zpomalení růstu tumoru a útlumu nádorové
angiogeneze. Kinázy jsou enzymy (§5.2,
část "Buňky - základní jednotky živých
organismů", pasáž "Proteiny,
enzymy, kinázy"),
které přenášejí fosfátovou skupinu z adenozintrifosfátu
ATP na akceptor, který má OH-skupinu - vznikne fosforester
akceptorové molekuly. Tyrozinkináza přenáší
fosfát na hydroxylovou skupinu cyklické aminokyseliny tyrosinu
vázaného v proteinu, čímž aktivuje příslušnou bílkovinu.
Inhibitory tyrozinkináz (tiniby) jsou malé
molekuly, které se váží na příslušné místo v
ATP (adenozintrifosfát) a zabraňují tím fosforylaci látek,
které jsou součástí intracelulárních signálních drah,
kterými se chemický signál, zachycený receptorem na povrchu
buňky přenáší k cílovým strukturám v cytoplasmě nebo v
jádře. Jedním z důležitých cílů biologické léčby je
signální dráha receptoru epidermálního růstového
faktoru EGFR (Epidermal Growth Factor
Receptor), označovaného též jako lidský epidermální
receptor Her-1 (Human Epidermal Receptor 1),
což je transmembránový glykoprotein (relativní molekulové
hmotnosti cca 170000). Další kináza, ovlivňující regulaci
buněčného růstu včetně angiogeneze, je serin/threoninová
kináza mTOR (mammalian target of rapamycin).
Inhibitory mTOR tak mohou spolupůsobit zvláště útlumem
angiogeneze.
Inhibice kináz, podílejících se na onkogenních signálních
drahách, může potlačit proliferaci daného klonu nádorových
buněk. Určitou výhodou těchto látek je, že (na rozdíl od
velkých molekul proteinů) mohou do buněk pronikat pasivním
transportem, takže jejich účinnost
není vázána na přítomnost příslušných
receptorů na membránách nádorových buněk.
Gefitinib je derivát
chinazolinu, inhibující tyrozinkinázovou aktivitu růstového
receptoru EGFR (zvláště při aktivační mutaci EGFR), podobný účinek má erlotinib. Lapatinib se váže na na nitrobuněčné
části růstového receptoru HER2 a inhibuje jeho
tyrozinkinázovou aktivitu; funguje i jako duální inhibitor
- kromě HER2 působí i na intracelulární aktivitu receptoru
HER1 (tj. EGFR). Imatinib blokuje především
BCR-ABL tyrozinkinázu u některých druhů
leukemie; novější a účinnější inhibitory tohoto druhu
jsou nilotinib a dasatinib. Multikinázové
inhibitory sunitinib a sorafenib potlačují
kinázovou aktivitu receptorů pro destičkový růstový faktor,
pro VEGFR a další (KIT, FLT3,...) - působí jako inhibitory
angiogeneze. Pro tento účel se zkoušejí i nové
inhibitory mTOR kinázy temsirolimus a everolimus
(jsou to deriváty rapamycinu - sirolimu zmíněného
výše v kategorii "antracyklinová antibiotika"),
které blokují signální dráhu
fosfatidylinositol-3-kinázy Pl3K/Akt/mTOR. Zkouší se
též kinázový inhibitor vemurafenib, který cíleně
inhibituje V600-mutovanou formu B-raf proteinu; vykazuje slibné
výsledky v terapii maligního melanomu.
V některých případech je užitečné kombinovat
terapii monoklonální protilátkou a příslušným
tyrosinkinázovým inhibitorem - např. u HER2 pozitivního
tumoru aplikovat trastuzumab a následně lapatinib.
l
Aptamery (lat. aptus=schopný,
řec. meros=díl) jsou krátké
fragmenty RNA nebo DNA (oligonukleotidy, peptidy, molekulové
hmotnosti 3-18 kDa) - speciálně připravené a sekvenované
ligandy s vysokou vazebnou afinitou ke specifickým cílovým
molekulám. Nabývají různé trojrozměrné struktury, jsou
schopné se navázat na různé biomolekuly
(protilátky, růstové faktory, hormony, enzymy, aminokyseliny).
Mohou fungovat jako cílené inhibitory a též
jako "nosiče" vhodné léčebné látky - "eskortní"
aptamery. Jejich použití, zatím
experimentální, je alternativní k monoklonálním
protilátkám. Aptamery lze v širokém sortimentu vyrábět
uměle biochemickými metodami: RNA slouží jako
"knihovna" nukleotidů, z nichž se opakovanými
kombinacemi s nádorovými antigeny a selekcemi připravují
ligandy požadovaných vlastností (metoda SELEX - Systematic
Evolution of Ligands by EXponential enrichment).
S trochou nadsázky lze říci, že zde uměle
"napodobujeme" přírodní evoluční proces
přirozeného výběru (ten výběr však
nedělá příroda, ale výzkumník - biochemik). Takto vytvořené vyselektované aptamery lze pak
sekvenovat a vyrábět je uměle biochemickými metodami; v tom
mají výhodu oproti monoklonálním protilátkám (které se
připravují imunizací laboratorních zvířat). Aptamery lze v
jistém smyslu považovat za uměle vytvořené, syntetické
chemické protilátky.
Příkladem je pegaptanib, který se
váže na vaskulární růstový faktor VEGF a zabraňuje mu tak
ve stimulaci angiogeneze. Aptamer peaptanib se zatím používá
v oftalmologii (pod názvem Macugen,
navázaný na polymer polyethylenglykol)
pro potlačení nežádoucí nadměrné angiogeneze u makulární
degenerace sítnice; nyní je však postupně nahrazován
monoklonální protilátkou ranibizumab (Lucentis),
nebo nejnověji bispecifickou monoklonální protilátkou faricimab.
Perspektivní by mohlo být označení
aptamerů radionuklidy - buď g-radionuklidy pro
scintigrafickou diagnostiku, nebo b či a radionuklidy pro biologicky
cílenou radionuklidovou terapii. Zkouší se např. Anti-tenascin-C
aptamer značený 99mTc a 111In (pro glioblastom), nebo Anti-MUC1 aptamer
značený 99mTc či 186Re (pro ca prsu).
Značným problémem u
aptamerů je způsob, jak v organismu "dopravit"
aptamery ke konkrétním patologickým tkáním a buňkám - tak,
aby při cestě organismem nebyly poškozeny či rozloženy,
zničeny *). Aptamery mají krátkou životnost (několik minut
až hodin) a jsou z krevního oběhu rychle odbourávány v
ledvinách. Provádějí se experimenty s navázáním aptamerů
na povrch nanočástic. Po kontaktu nanočástice s
buňkou aptamery reagují se specifickými receptory na
buněčné membráně a ovlivňují procesy v buňce.
*) Tato nevýhoda se netýká
pegaptanibu, který se nepoužívá systémově, ale
aplikuje se přímo do oka (nitrooční injekcí do sklivce) a je
tudíž lokálně biologicky dobře dostupný v cévním systému
sítnice.
Biologická
léčba nádorových onemocnění zahrnuje i několik dalších
speciálních postupů :
l
Genová
terapie nádorů je zatím ve
stádiu laboratorního vývoje, avšak lze očekávat její
výraznější uplatnění v blízké budoucnosti .
Rozpracovávají se dvě odlišné cesty genové nádorové
terapie :
-> Přímočarý
postup se uvnitř nádorových buněk snaží cílenou změnou
"napravit" genetickou odchylku, která vedla k maligní
transformaci buněk. Obtížnost tohoto přístupu spočívá
nejen v laboratorní biochemické náročnosti zavedení
konkrétní genetické informace pomocí vhodného RNA-vektoru a
reverzní transkriptázy, ale i ve skutečnosti, že na maligní
transformaci buněk se podílí několik různých genetických
změn (mutací). A to pravděpodobně nejen změny ve známých
kódujících sekvencích DNA, ale i v dosud neprobádaném
"genetickém smetí", "zbytečné" DNA.
-> V
alternativním přístupu cílem genové terapie nejsou přímo
nádorové buňky, ale jiné buňky a tkáně, které pod vlivem
cíleného genetického zásahu se modifikují tak, že mohou
začít produkovat určité aktivní látky, které efektivně
blokují nádorový růst.
l Inhibice telomerázy je zatím experimentální metoda, namířená proti
jednomu ze shora zmíněných faktorů karcinogeneze:
překonání Hayflickova limitu dělení buněk - jejich
immortilizace - v důsledku aktivní telomerázy,
působící v nádorových buňkách. Antitelomerová
vakcinace se provádí aplikací telomerázy do organismu, s
cílem vyvolat imunitní reakci, která by likvidovala
telomerázu v nádorových buňkách a zabránila by tak jejich
neomezenému dělení. Bohužel však inhibice telomerázy
zasáhne i jiné buňky, jako je krvetvorba, kde telomeráza
plní svou fyziologickou funkci. Experimentuje se i s
kombinovanou inhibicí telomerázy spolu s inhibicí tankyrázy
pro potenciaci efektu (telomeráza a tankyráza pracují
"synergicky v tandemové kooperaci"). Terapie
založená na inhibici telomerázy může být úspěšná pouze
tam, kde je aktivní telomeráza. V poslední době však bylo
zjištěno, že telomeráza není jediným faktorem immortilizace
nádorových buněk, ale podobně fungují i mechanismy homologní
rekombinace sekvencí telomerů (je diskutováno v §5.2,
část "DNA,
chromosomy, telomery"). Tato
"špatná zpráva" poněkud snižuje slibný
terapeutický potenciál telomerázy...
l
Hormonální
terapie nádorů je založena
na skutečnosti, že některé druhy nádorových buněk
obsahují receptory na hormony - jsou hormonálně
dependentní, jejich vznik a rozvoj je závislý na
hladině určitých hormonů. V nádorových buňkách ca prsu
jsou receptory pro estrogeny, v nádorech prostaty pro androgeny.
Růst nádorových buněk mohou inhibitovat hormony s opačným
účinkem (antagonisté hormonů), nebo zamezení syntézy
hormonů (kastrace u ca prostaty, ovariektomie u ca mamy); oba
postupy se často kombinují. Další možností je zablokování
receptorů u hormon-dependentních forem nádorů
(zvláště ca prsu), které vede k zastavení množení
nádorových buněk. Pro tento účel se používají selektivní
modulátory estrogenových receptorů, jako je tamoxifen.
Inhibitory aromatázy (enzym
účastnící se syntézy estrogenů z testosteronu, vzniká
estradiol) jako je anastrazol,
ietrezol, formestan, rovněž blokují tvorbu estrogenů.
l Imunoterapie obecně představuje cílený zásah do imunitního
systému organismu za léčebným účelem - obnovit, posílit,
nebo modifikovat funkce imunitního systému. Při rozvinutém
onkologickém onemocnění imunitní systém na nádorové buňky
vlastního těla bohužel zpravidla nereaguje (imunosuprese).
Jedním z cílů nádorové imunoterapie je
označit a "zviditelnit" nádorové buňky pro
imunitní systém organismu, který se pak může
"postarat" o jejich likvidaci. Genetické změny v
nádorových buňkách mají m.j. za následek vznik nových
antigenů, odlišných od buněk nenádorových. Tyto nádorové
antigeny se mohou stát žádoucím terčem pro imunitní reakce,
ovšem jen tehdy, když je imunitnímu systému vhodně
"naservírujeme".
Jako vektor pro tento účel imunitní
protinádorové vakcinace jsou zvláště vhodné
speciální buňky ze skupiny bílých krvinek, tzv. dendritické
buňky imunitního systému s četnými výběžky
na povrchu (řec. dendron = strom,
buňky mají stromečkovitě větvené výběžky - dendrity). Tyto buňky zahajují imunitní reakce, rozlišují
cizí a organismu vlastní látky (mohou rozpoznat různé
antigeny, včetně nádorových buněk), jsou schopné
fagocytózy cizorodých částic. Následně dozrávají,
vystavují na svém povrchu části z pohlcených proteinů (v
našem případě nádorové antigeny) a tím mohou aktivovat efektorové
T-lymfocyty, které dokončí "likvidační"
imunitní odpověď za účasti monocytů, transformujících se
v makrofágy. Dendritické buňky se tak mohou stát účinným
nástrojem autologní buněčné imunoterapie,
která stimuluje vlastní imunitní systém organismu tak, aby se
"zapojil do boje" proti nádorovému onemocnění.
 |
Postup protinádorové
imunitní vakcinace sestává z několika etap:
- Odběr vzorku nádorové tkáně,
izolace a kultivace buněk nádorové linie;
- Odběr periferní krve, separace
leukocytů a monocytů leukoferézou;
- Vypěstování kultivací in
vitro nativních (nezralých) dendritických buněk;
- Aktivace dendritických buněk
pohlcením buňek dané nádorové linie (jejich
antigeny);
- Z aktivovaných (zralých)
dendritických buněk, které na svém povrchu vystavují
nádorové antigeny, se připraví výsledná vakcína,
která se aplikuje zpět do organismu;
- Aktivované dendritické buňky
migrují do lymfatických uzlin, kde aktivují
efektorové T-lymfocyty;
- Aktivované cytotoxické
T-lymfocyty rozpoznávají a likvidují nádorové buňky
(N). |
Dendritické buňky lze získat několikadenní
kultivací z monocytů, extrahovaných z periferní krve pacienta
*). Kromě toho se odebere vzorek nádorové tkáně.
Jestliže pak necháme (in vitro, s použitím
rozrušených či apoptických nádorových buněk) pohltit
dendritickým buňkám nádorové antigeny z dané nádorové
tkáně a takto stimulované je následně vpravíme zpět do
organismu, mají schopnost vybudit imunitní systém tak, aby
"bojoval" i proti původním nádorovým buňkám.
Následně aktivované efektorové T-lymfocyty se vydají do
nádorového ložiska a selektivně napadají nádorové buňky.
Metoda je zatím ve stádiu experimentálních klinických
studií.
*) Pro získání většího množství
leukocytů a monocytů se používá speciální odběrová
separační metoda zvaná leukoferéza či leukaferéza
(řec. leukos=bílý, jedná se o bílé krvinky - leukocyty;
afairesis=odebrat): krev cirkuluje přes odstředivou
separační jednotku, kde jsou oddělovány leukocyty, zatímco
ostatní složky krve (především plasma) se vrací
zpět do oběhu pacienta.
I když nádorové buňky produkují antigeny,
které v zásadě imunitní systém může použít k jejich
identifikaci a následné cílené likvidaci pomocí
cytotoxických T-lymfocytů (CTL), uplatňuje se zde inhibiční
mechanismus antigenu asociovaného s proteinem CTLA-4,
jehož vazba na receptor CTL vypne cytotoxickou reakci. Tento
mechanismus na jedné straně zabraňuje nadměrným
nepříznivým imunitním reakcím (autoimunita), na druhé
straně však umožňuje aby nádorové buňky mohly přežít. K
posílení protinádorové CTL imunity se osvědčila
monoklonální protilátka anti-CTLA-4 ipilimumab (MDX-010),
která se váže na CTLA-4, blokuje jeho inhibiční funkci a
umožňuje CTL i nadále ničit nádorové buňky.
Další nově zkoušenou metodou založenou na
imunitním systému je blokátor proteinu CD47 - anti-CD47.
Protein CD47 se fyziologicky vyskytuje na povrchu krevních
buněk a jeho úkolem je chránit je před vlastními bílými
krvinkami. I mnohé nádorové buňky však mají na svém
povrchu protein CD47, který je chrání před bílými krvinkami
a imunitní systém je proto nemůže zlikvidovat. Aplikací
blokátoru anti-CD47 se imunitní systém vybudí k
likvidaci nádorových buněk. Dochází sice také k úbytku
krevních buněk, které je třeba doplnit...
Do
kategorie imunoterapie ostatně patří i shora uvedené
monoklonální protilátky. Molekulární biologickou
chemoterapii (imunoterapie, monoklonální protilátky) je často
vhodné kombinovat s
klasickými cytostatiky - pro posílení terapeutického
účinku. Používá se např. kombinace docetaxel s trastuzamabem,
5-fluorouracil+oxaliplatina (FOLFOX), nebo 5-fluorouracil+irinotekan
(FOLFIRI), s bevacizumabem nebo cetuximabem,
kapecitabin s trastuzumabem nebo lapatinibem
a řada dalších. V poslední době se zkouší aplikace
cytostatik a monoklonálních protilátek značených terapeutickými
beta-radionuklidy, což představuje kombinovanou
molekulární chemo-radioterapii. Některé takové
metody a preparáty jsou zmíněny níže v části "Radioisotopová
terapie", pasáž "Radionuklidová
terapie nádorů a metastáz" a "Radioimunoterapie".
Abskopální efekt
V některých případech se pozoruje synergický efekt
imunoterapie a radioterapie. Vzácně se vyskytuje tzv. abskopální
efekt (tj. mimocílový
- lat. ab = mimo,pryč; scopium = terč, cíl, úhel pohledu), kdy po lokální radioterapii určité nádorové
léze ustoupí systémově i další léze, které nebyly
ozářeny. Radioterapie může navodit imunoefekt
proti dalším metastázám téhož nádoru (podrobněji v §5.2,
pasáž "Bystander-Abscopal efekt").
Alternativní
metody
Vedle chemoterapie a radioterapie se občas používají nebo
zkoušejí i některé alternativní metody nádorové terapie.
Zmíníme dvě založené na teplotě :
¨ Hypertermie
- lokální zahřátí cílové tkáně na teplotu vyšší než
43°C, způsobující inhibici tvorby DNA a proteinů, spolu se
snížením vaskularizace tumoru. Nádorové tkáně reagují na
zahřátí zpravidla citlivěji než normální zdravé tkáně.
Ve zdravé (normálně perfundované) tkáni dochází při
zahřátí k vazodilataci, čímž je teplo krví
účinněji odváděno a ohřev je nižší. Neoangiogenezí
vzniklé cévy v nádoru jsou chaotické, funkčně nedokonalé a
příp. stlačené masou nádoru. Nádorové cévy nejsou schopny
účinně regulovat průtok krve, takže při zahřátí nádoru
nedochází k vazodilataci a nádor se zahřívá více než
okolní zdravé tkáně. Především objemné a hypoxické
nádory, které jsou málo citlivé na radioterapii, jsou proto
vhodné k léčbě hypertermií.
Při teplotách vyšších než 43°C začíná docházet k
denaturaci proteinů (m.j. i proteinů
buněčných membrán a mikrotubulů, způsobující změny
membránových potenciálů a koncentrací iontů), což vede k buněčné smrti,
převážně nekrózou. Kromě toho při tepelném
stresu dochází k expresi proteinů teplotního stresu HSP (Heat
Shock Protein), nejčastější je Hsp70, které kromě
svého protistresového účinku (vážou
se na hydrofobní sekvence aminokyselin částečně
poškozených proteinů, kterým umožňují opravu do
správného prostorového uspořádání; dále podporují
odbourávání poškozených proteinů)
svou "chaperonovou" aktivitou umožňují vazbu na
antigeny a jejich transport na membrány buněk, kde jsou tyto
antigeny prezentovány (prostřednictvím
transmembránového glykoproteinu MHC 1) a
tím stimulují imunitní systém - vznik
cytotoxických T-lymfocytů specifických pro daný typ nádoru.
Dále, enzymatické reparační mechanismy
buněk (jako je excizní reparace,
homologní rekombinace, non-homologní end-joining - viz §5.2,
pasáž "Reparační procesy") jsou tepelně citlivé - termolabilní.
Toho může být využito pro synergetický účinek
kombinace hypertermie s radioterapií či chemoterapií - termoradioterapie
(hypertermická radioterapie) či termochemoterapie.
Neivazivní zahřátí nádoru uvnitř těla se dá
dosáhnout elektromagnetickými vlnami nebo ultrazvukem. V
poslední době se jeví perspektivní metoda vysoce
intenzívního fokusovaného ultrazvuku HIFU (High-Intensity
Focused Ultrasound). Fokusace ultrazvukových vln se
dosahuje pomocí speciálně tvarovaného (konkávně
zakřiveného) transduktoru. Ultrazvuk o vysoké intenzitě se
cíleně zaměří na nádor, uvnitř něhož se energie
přemění na teplo. Teplota tkáně se zvýší až na 65°C,
při níž dochází k termální ablaci -
teplota usmrcuje nádorové buňky, ale při správném
zacílení nepoškozuje okolní zdravé tkáně. Rychlé a
krátkodobé zvýšení lokální teploty (během 2-3 sekund)
ničí cílovou tkáň koagulační nekrózou - nádor
doslova "uvaříme", přičemž okolní struktury
nejsou poškozeny. HIFU terapie je vhodné provádět při navigaci
magnetickou rezonancí MRI.
Hypertermická metoda by dále mohla
aktivovat chemoterapeutické léky přímo v nádorech.
Chemoterapeutikum se "zabalí" do mikroskopických
částic (liposomů - částic obalených tukovou
vrstvou), které jsou citlivé na teplo, a aplikují se do
krevního oběhu. Při normální teplotě organismu cca 37°C
procházejí částečky nerušeně krevními cévami a nemají
na organismus žádné toxické účinky. Když se takto dostanou
do nádoru, mohou být fokusovanými vlnami HIFU lokálně
zahřáty na teplotu vyšší než 42°C, při níž se
liposomový obal stává porézním a léčebná látka se
uvolňuje přímo do nádoru. Terapeutický účinek medikamentu
se tak cíleně uplatňuje v nádoru, s minimalizací
nežádoucích vedlejších účinků v ostatních částech
organismu.
¨ Kryoterapie (řec. kryos=chlad)
(zvaná též kryochirurgie) spočívá v aplikaci velmi
nízkých teplot za účelem destrukce cílové tkáně (kryodestrukce).
Používá se v různých medicínských oborech (dermatologie,
oftalmologie, gynekologie, chirurgie) i pro léčení
nemaligních onemocnění. V onkologických indikacích se jedná
o destrukci nádoru zmrazením pomocí zavedené
mrazicí sondy - kryokauteru, chlazeného
většinou kapalným dusíkem. Prudké zmrazení tkáně způsobuje její poškození
tvorbou ledových krystalků uvnitř i vně buněk, s následnou
nekrózou zmrazených buněk. Pro dosažení žádoucího efektu
je nutno cílovou tkáň ochladit na teplotu pod -20°C vysokou
mrazicí rychlostí cca 30°C/sec. Při pomalém
zmrazování by docházelo k dehydrataci buněk, které by po
rozmrazení mohly přežít. Následující rozmrazení by naopak
mělo probíhat podstatně pomaleji, aby buňky byly po delší
čas vystaveny mechanickému poškozování rekrystalizujícím
ledem a též toxickému působení intracelulární tekutiny, v
níž prudce vzrostla koncentrace solí a iontů. Metoda
kryoterapie se používá u nádorů přístupných přímému
přiložení kryokauteru, nejčastěji u kožních nárorů.
Pozn.:
Problematiku chemoterapie a dalších neradiačních
metod jsme zde nastínili jen stručně a okrajově, pro
komplexnost výkladu pricipů a současných možností
nádorové terapie; další podrobnosti složitých
biochemických reakcí (často dosud ne zcela prozkoumaných)
při chemoterapii a biologické léčbě leží již mimo rámec
našeho pojednání o radioterapii, navíc
fyzikálně zaměřeného...
Riziko
šarlatánské terapie
?
Vedle vědecky prokázaných poznatků a fungujících metod (přinejmenším relativně) se ve
všech oborech lidské činnosti občas vyskytují neprokázaná
a mylná tvrzení a propagace metod které sice nefungují, ale
řada lidí jim věří - viz "Šarlatánství versus věda". Často se to vyskytuje i v oblasti našeho
zdraví a života - v medicíně. Biologické a psychosomatické
faktory bývají natolik složité a různorodé, že vedle
seriózního vědeckého výzkumu a odhalování skutečných
příčin to poskytuje značný prostor i nekvalifikovaným
výmyslům a někdy i podvodům.
Někteří lidé nemají důvěru v moderní
medicínu - někdy i z vlastní zkušenosti (lékařům se
nepodařilo najít příčinu, někde udělali chybu,
nedostatečná komunikace,...), nebo z vyprávění svých
známých (bývá tendence negativní zkušenosti zveličovat a
generalizovat). Či proto, že uvěřili ("nalétli")
zázračným slibům šarlatánů. Pokud člověk s takovou
mentalitou dostane nádorové onemocnění, může se stát, že
místo terapie na
onkologickém oddělení ověřenými medicínskými prostředky
(podle současného stavu vědy a techniky), se rozhodne
navštěvovat nějakou pyramidu která nádorové bujení
zastaví, či se nechá léčit zaříkáváním nějaké vědmy
se zázračnými schopnostmi (připouštím že i to někdy v důsledku
placebo-efektu může být v ojedinělých případech
pozitivní). Když takový
pacient posléze po delším čase sám na sobě pozná že je to
neúčinné, na skutečnou kauzální léčbu může již být
pozdě..!..
K podobnému riziku může vést i důvěra k
samospasitelným účinkům některých zázračných léků,
propagovaných podvodnými distributory.
Radioterapie
nádorových onemocnění je založena na účincích
ionizujícího záření na živou tkáň (mechanismy
těchto účinků jsou podrobně popsány v §5.2 "Biologické účinky ionizujícího
záření").
Může záření
uzdravovat buňky ?
Název "Radioterapie" může vzbuzovat dojem,
že snad "záření může léčit poškozené či
zmutované buňky?". Nikoli -
ionizující záření může jen buňky zabíjet !
Terapeutický efekt zde spočívá v cílené likvidaci
nádorových buněk v organismu.
Dostatečně vysoké dávky
ionizujícího záření jsou schopny inaktivovat a usmrcovat
buňky, v tomto případě buňky nádorové. V
nádorové tkáni je potřeba zlikvidovat především kmenové
klonogenní buňky, jejichž neomezené dělení způsobuje
nádorové onemocnění. Významný podíl na zastavení
nádorového růstu může mít i radiační poškození
cévního zásobení nádoru. Radioterapie tak může být
účinnou lokální (resp.
lokálně-regionální) metodou terapie nádorových onemocnění
(a příp. i některých jiných
ložiskových onemocnění a poruch).
Cílem klasické radioterapie je reprodukční
sterilizace klonogenních nádorových buněk pomocí
radiačně indukované apoptózy. Stereotaktická radioterapie
navíc umožňuje i ablativní přístup -
okamžitou likvidaci buněk nekrózou, vyvolanou vysokou
jednorázovou dávkou záření.
Radioterapie
- lokální terapie
Na rozdíl od shora probírané systémové chemoterapie
a biologické léčby ("Chemoterapie a biologická léčba"), vnější radioterapie je lokální
metodou, která je schopna úspěšně zlikvidovat
konkrétní nádorové léze ve známých lokalizacích. Pokud je
nádorové onemocnění diseminované - metastatické,
je konečný výsledek vnější radioterapie problematický:
po úspěšném vyléčení jedné léze může docházet k progresi
v jiných místech...
Radiační likvidace nádorových buněk může
být součástí účinné kurativní terapie s
cílem úplného vyléčení nádorového onemocnění,
zvláště v lokalizovaném stádiu. V těžších a
pokročilejších případech pak paliativní terapie,
zmírňující a zpomalující průběh onemocnění a jeho
obtíží. Po chirurgickém odstranění nádorového ložiska se
často aplikuje tzv. adjuvantní radioterapie -
pomocná, podporující či zajišťovací léčba po operaci,
pro snížení rizika recidivy v důsledku možného mikrorozsevu
v okolí původního nádoru. V určitých případech se
používá i preoperační tzv. neoadjuvantní
radioterapie před chirurgickým výkonem - pro redukci rozsahu
nádoru ("downstaging") a tím zlepšení jeho operability, jakož i pro
omezení viability nádorových buněk a tím snížení rizika
lokální či metastatické infiltrace (při operaci nádoru se
mohou uvolňovat nádorové buňky do okolí, lymfatického
systému a do krevního oběhu). Chirurgický výkon se pak
provádí asi za 6 týdnů po radioterapii, kdy již odezní
akutní radiační příznaky a ještě nenastoupí pozdní
změny (viz níže "Vedlejší
účinky radioterapie - radiotoxicita").
Ojediněle se používá peroperační
(intraoperační) radioterapie - přímé ozáření
nádorového ložiska nebo jeho zbytku, obnaženého při
operaci. Tato metoda je komplikovaná tím, že je potřeba buď
instalovat ozařovací přístroj na operační sál, nebo mít
možnost rychlého transportu pacienta na ozařovnu a pak zpět
na operační sál. Z tohoto hlediska jsou výhodné mobilní
přístroje s miniaturizovanou rentgenkou či elektronovým
dělem a terčíkem, který se přikládá k cílovému ložisku
(např. dutině po resekci vlastního nádoru) a ozařuje jej
nízkoenergetickým X-zářením (o energii několika desítek
keV) s vysokou dávkou a ionizační hustotou. Lze v principu
použít i při laparoskopických operacích.
Radioterapii nádorových
onemocnění bude věnována převážná část tohoto §3.6.
Kombinovaná
chemo-radioterapie
Pro zlepšení výsledků nádorové léčby je v některých
případech užitečné obě shora zmíněné terapeutické
modality kombinovat (konkomitantní
- průvodní, doplňující terapie, speciální případ multimodální
léčby). Přínos simultánní aplikace chemoterapie s
radioterapií může být v zásadě trojího druhu:
l
Aditivní účinek -
účinek radioterapie a chemoterapie pro likvidaci nádorových
buněk se sčítá (bez přímé vzájemné závislosti).
Aditivní efekt chemoterapie nastává jednak u ozařovaných
buněk cílového objemu, jednak může chemoterapie způsobovat
i eliminaci a útlum mikrometastáz mimo ozařovaný objem.
l
Radiosenzibilizační účinek -
chemoterapie zesiluje biologický účinek ionizujícího
záření na buňky (zvýšenou fragilitou DNA v důsledu
chemicky navázaných cytostatik, inhibicí reparačních
mechanismů DNA, či vhodným časovým ovlivněním buňečného
cyklu do fáze citlivější k záření, např. G2) - potenciace
radioterapie. Jedním z takových cytostatik, které zvyšuje
citlivost nádorových buněk k radioterapii, je sirolimus
(rapamycin - byl zmíněn výše jako antracyklinové
antibiotikum); kombinace sirolimus+radioterapie je z hlediska
nežádoucích účinků lépe tolerována, než kombinace
radioterapie s většinou jiných chemoterapeutik.
U nádorů se zvýšenou expresí růstových receptorů EGFR
(=HER1) a HER2 je zpravidla zvýšená radiorezistence, neboť
vnitřní signální dráhy těchto receptorů se podílejí na
aktivaci reparačních procesů DNA při poškození
ionizujícím zářením. Aplikací cílené biologické léčby
proti receptorům růstových faktorů - cetuximabu,
trastuzumabu, gefitinibu, lapatinibu a pod., se přeruší
signální dráhy růstových faktorů, sníží se reparační
kapacita DNA a tím lze očekávat zvýšení
radiosenzitivity nádoru.
l Anti-repopulační
účinek - cytostatika a zvláště některé
preparáty cílené biologické léčby, jako jsou monoklonální
protilátky proti růstovým faktorům, snižují repopulaci
nádorových buněk během časově protrahované frakcionované
radioterapie, což vede k účinnější likvidaci větší
frakce nádorových buněk účinkem záření.
U chemosenzitivních nádorů může chemoterapie
též způsobit zmenšení objemu,
jakési "scvrknutí", nádoru (podobný efekt jako u neoadjuvantní
chemoterapie). Takový zmenšený nádor je pak snadněji
léčitelný radioterapií jednak samotným zmenšením počtu
nádorových buněk, jednak příp. zlepšeným prokrvením a oxygenací,
což vede ke zvýšené radiosenzitivitě v důsledku kyslíkového
efektu. Výsledné efekty chemo-radioterapie jsou
podrobněji analyzovány níže v části "Predikce
radioterapeutického efektu".
Fyzikální
a radiobiologické faktory v radioterapii
Optimálního terapeutického účinku záření se dosahuje
koprodukcí dvou druhů faktorů:
¨ Fyzikální faktory - selektivní
zavedení dostatečně vysoké dávky záření do patologického
ložiska vhodnou ozařovací technikou, s využitím
fyzikálních vlastností záření. Tyto
fyzikální aspekty budeme podrobně rozebírat ve většině
textu této kapitoly; zde nejprve stručně rozebereme aspekty
radiobiologické:
¨ Biologické faktory - druh nádoru a
vlastnosti okolní zdravé tkáně. Pro radioterapii je velmi
důležitá radiosenzitivita konkrétního druhu
nádoru, jakož i rozdíl v citlivosti na záření mezi
nádorovou a zdravou tkání *). Vysoce radiosenzitivní jsou
lymfomy, leukemie, seminom. Středně radiosenzitivní jsou
karcinomy, např. adenokarcionom prostaty. Radiorezistentní jsou
gliomy, sarkomy, melanom, spinocelulární karcinom kůže.
*) Právě riziko poškození
okolních zdravých tkání a orgánů je hlavním
limitujícím faktorem dopravení dostatečně vysoké dávky do
nádorového ložiska. Rizikovým - kritickým orgánem
či tkání rozumíme takovou strukturu v organismu, jejíž
radiační poškození by mělo vážné zdravotní následky,
či v případě životně důležitých orgánů dokonce smrt.
Při radioterapii proto nesmí být překročena určitá tzv. toleranční
dávka v těchto kritických orgánech, aby nedošlo k
jejich ireverzibilnímu poškození.
Terapeutický poměr
Pro možnost dosažení dobrého kurativního efektu
radioterapie často tedy není nejdůležitější vlastní
radiosenzitivita nádorové tkáně, jako spíš poměr
radiosenzitivity nádorové a okolní zdravé tkáně - tzv. terapeutický
poměr TR (Therapeutic Ratio). Lze jej
kvantifikovat různým způsobem *): srovnáním křivek
dávkové závislosti buněčného přežití N/N0 (obr.5.2.3c) pro
nádorovou a okolní zdravou tkáň (z poměru gradientů či
ploch pod těmito křivkami), nebo s pomocí biologické
efektivní dávky BED, popř. pomocí srovnání
pravděpodobnostních veličin TCP a NTCP (viz níže "Predikce radioterapeutického efektu - TCP, NTCP"). Pro kvantifikaci terapeutického poměru TR tak
dostáváme různé indexy TRN/No , TRBED , TRTCP , jejichž číselné hodnoty jsou odlišné a je třeba
je posuzovat zvlášť. Terapeutický poměr lze zlepšit
frakcionací ozáření, kombinací s chemoterapií, zlepšením
oxidace nádorového ložiska (překonáním hypoxie, použitím
hustě ionizujícího záření s vysokým LET) - je rozebíráno
níže.
*) Terapeutické možnosti se dříve
hodnotily pomocí tzv. Patersonova grafu, který
znázorňuje závislost relativního počtu usmrcených
nádorových buněk na dávce záření. Do téhož grafu se
vynáší i závislost rizika ireverzibilního poškození
okolní zdravé tkáně na dávce. V příznivém případě je
křivka pro nádorovou tkáň vlevo, křivka pravděpodobnosti
komplikací zdravé tkáně je posunuta vpravo. Šířka mezery
mezi těmito dvěma esovitými křivkami se někdy nazývá terapeutická
šíře. Složitější hodnocení se nyní provádí
pomocí speciálních grafů TCP a NTCP - viz
níže "Predikce radioterapeutického
efektu - TCP, NTCP".
Časová
frakcionace ozařování
Nádorová tkáň, která je ve stavu intenzívního
(patologického) buněčného dělení, je zpravidla citlivější
k záření než tkáň zdravá (je
podrobněji diskutováno v §5.2 "Biologické
účinky záření"). Používá se většinou frakcionované
ozařování, kdy se celková dávka rozdělí do
většího počtu menších denních dávek *), aplikovaných po
řadu dní (cca 3-5 týdnů, viz níže
"Frakcionace v praxi").
*) Jednorázové ozáření
malých lézí vysokou dávkou (nebo podstatné snížení počtu
frakcí na 2-5) umožňuje sterotaktická
radioterapie díky možnosti
velmi přesného zacílení kanceroletální (či radioablační)
dávky s menším zatížením okolních rizikových -
kritických tkání a orgánů.
Pro časovou frakcionaci radiační dávky jsou v zásadě dva
důvody :
1. Buňky zdravých tkání mají zpravidla vyšší
schopnost opravit radiační poškození, než buňky
nádorové. Při rozdělení dávky do většího počtu
menších frakcí, aplikovaných jednotlivě po ukončení
reparačních procesů v buňkách, je výsledný kumulativní
biologický účinek na nádorovou tkáň zpravidla vyšší než
na zdravou tkáň, která má větší regenerační schopnost. Radiobiologické aspekty frakcionace ozáření jsou
diskutovány níže. Radioterapeutický účinek na vlastní
nádorovou tkáň se někdy vyjadřuje pomocí
pravděpodobnostní veličiny TCP, definované
níže.
2.
V každé tkáni, tedy i
nádorové, jsou buňky v různých stádiích
buněčného cyklu, v nichž mají různou radiobiologickou
citlivost. Jediná dávka záření proto nemusí mít
optimální účinnost pro všechny buňky, které se nemusejí
nacházet v nejcitlivější fázi. Pokud se celková dávka
rozdělí na několik frakcí s vhodným časovým odstupem, pak
po každé takové dávce může být nejúčinněji likvidována
ta část buněk, která právě v daném čase dospěla do
nejcitlivější fáze.
Závislost radiačně-biologického účinku
na dávce a jejím časovém rozvržení - LQ model
Závislost deterministického radiačního účinku na dávce a
jejím časovém rozvržení je podrobně analyzována v §5.2
"Biologické účinky
ionizujícího záření",
část "Vztah dávky a biologického účinku",
kde je zaveden tzv. lineárně-kvadratický model
(LQ) - viz část "LQ
model", obr.5.2.3c. Je
tam též odvozena základní rovnice závislosti mezi dávkou D
a přežívající frakcí buněk N/No v (semi)logaritmickém měřítku:
-ln(N/No) = a.D + {2.[(1-e-l.T).(1-1/l.T)]/l.T}.b.D2 -
ln2.T/T2r ,
kde a a
b jsou
faktory udávající pravděpodobnosti poškození a a b-procesy, T je
ozařovací doba, l je rychlost buněčné reparace, T2r doba zdvojení
počtu buněk repopulací. Koeficient v lomené závorce {...} je tzv. Lea-Catchesidův
faktor, zachycující vliv buněčné reparace během
ozařování. Lineární člen a.D je dominantní pro
časně reagující tkáně (s vyšší buněčnou proliferací),
kvadratický člen b.D2 se výrazněji uplatňuje u pozdně
reagujících tkání. Základní lineárně-kvadratická
závislost N/Nona dávce (D) je ve zmenšeném měřítku pro ilustraci
zobrazena i níže, na obr.3.6.0.a. Obecné rovnice LQ modelu
mají spíše teoretický význam, pro praktické
aplikace v radioterapii se z nich odvozují jednodušší speciální
vztahy pro konkrétní ozařovací podmínky a techniky (viz
níže "Frakcionace ozáření"). K těmto obecným
radiačně-biologickým mechanismům přistupují v praxi i
některé další individuální biologické vlivy,
které je někdy obtížné zahrnout do jednoho LQ modelu.
Individuální
biologické faktory - " 6 R "
Biologický účinek ionizujícího záření ve
vztahu k radiační dávce, jejímu časovém rozvržení a
příp. objemové distribuci, je ovlivňován několika faktory
a biologickými pochody v průběhu ozařování
(jejichž názvy lze formulovat tak, aby začínaly písmenem
"R"):
× Radiosenzitivita
ozařované tkáně je dána citlivostí jednotlivých buněk na
radiační poškození; ta se obecně značně liší pro různé
druhy tkání. V lineárně-kvadratickém modelu je
radiosenzitivita implicitně obsažena v koeficientech a a b. Každá tkáň je
však ve skutečnosti heterogenní buněčnou populací,
obsahující buňky s různou radiosenzitivitou
- s různými koeficienty a,b: výsledná křivka přežití [ln(N/N0)](D) je pak
superpozicí několika různých LQ křivek.
× Reparace
je schopnost buněk opravit své důležité struktury,
především DNA, poškozené ionizujícím zářením, či
jinými vlivy (procesy buněčné reparace
jsou podrobněji popsány v §5.2, část "Reparační procesy"). Reparační procesy mají časovou dimenzi:
trvají určitou dobu (danou koeficientem l - rychlostí buněčné
reparace), přičemž oprava musí být uskutečněna dříve,
než další poškození úspěšnou reparaci znemožní.
Reparační procesy, kontinuálně probíhající během
ozařování, tak vedou k "efektu dávkového příkonu".
V LQ modelu je reparace obsažena v dodatečném koeficientu RGş{...} u b-členu.
× Repopulace
Při expozici ionizujícím zářením část buněk hyne, avšak
další buňky se normálně dělí a mohou příp. nahrazovat
zničené buňky. Tuto buněčnou repopulaci a regeneraci
tkáně zajišťují kmenové klonogenní buňky. Repopulace
se kvantifikuje pomocí rychlosti obnovení určitého počtu
buněk, nebo času T2r zdvojení počtu buněk. V LQ modelu je repopulace
zachycena v aditivním členu RPşln2.T/T2r.
Předpokládá se zde exponenciální nádorový růst,
což je přibližně splněno jen v počátečních fázích
růstu miniaturních nádorů, se zvětšováním nádoru se
rychlost růstu zpomaluje.
× Redistribuce
Různé druhy buněk v různých stádiích buněčného
cyklu jsou různě citlivé k ionizujícímu záření. Během
vlastní expozice tak může nastávat tzv. redistribuce
buněk - změna zastoupení různých druhů
buněk v tkáni *). Během ozařování více ubývá kmenových
klonogenních buněk a buněk ve fázi G1 a G2 buněčného
cyklu, zatímco efektorových dceřinných buněk a obecně
buněk ve fázi M a S bude relativně větší zastoupení.
Kmenové buňky jsou přitom radiačně citlivější než buňky
mateřské (viz též §5.2); cílem radioterapie je právě likvidace kmenových
nádorových buněk. Efekt redistribuce vede ke změnám
intratumorózní radiosenzitivity během ozařování,
jakož i ke specifickým vedlejším účinkům na zdravou tkáň
*).
*) Složitá
časová dynamika redistribuce buněk
Procesy redistribuce buněk během ozařování mají složitou časovou
dynamiku a dochází k nim jak u nádorové cílové
tkáně, tak u zářením zasažených okolních zdravých
tkání. V první části expozice rychleji ubývají kmenové
klonogenní buňky, které jsou (vzhledem k rychlejšímu
buněčnému cyklu) citlivější. Následuje pozvolný úbytek
dceřinných efektorových buněk, čímž se snižuje funkce
ozařované tkáně. Nastupuje regulační mechanismus pro
zachování funkčnosti tkáně, který vede k částečné ztrátě
asymetričnosti dělení kmenových buněk, které se
začínají dělit symetricky vždy na dvě buňky efektorové;
tím je (za cenu úbytku kmenových buněk) dočasně zachována
funkčnost tkáně. Pokud expozice pokračuje, při poklesu
počtu klonogenních buněk pod určitou kritickou mez (hrozící
vymizením kmenových buněk a následným zánikem tkáně)
nastává další regulační mechanismus spuštění zrychlené
repopulace kmenových buněk, aby byla zachována jejich
populace nutná pro regeneraci tkáně. Tím poklesne produkce
efektorových dceřinných buněk, které již nestačí pokrýt
funkční potřebu tkáně - nastává klinická manifestace
deterministického radiačního účinku u zdravé tkáně,
akutní radiotoxicita (srov. pasáž "Akutní nemoc
z ozáření" v §5.2; o vedlejších účincích radioteratie - časné a
pozdní radiotoxicitě, je stručně pojednáno níže - "Strategický
cíl radioterapie"). Pokud expozice pokračuje
(frakcionované ozařování) a není překročena toleranční
dávka dané tkáně, mohou zmnožené kmenové buňky produkovat
efektorové buňky v počtu dostatečném pro zajištění
základní (byť snížené) funkčnosti tkáně; může dojít k
určitému "nouzovému rovnovážnému stavu" se
snížením či vymizením předchozích akutních potíží ve
zdravé rizikové - kritické tkáni. U nádorového ložiska je
naopak žádoucí dodat dostatečně vysokou dávku k
překonání repopulace klonogenních nádorových buněk - k
jejich redukci až na nulovou úroveň, vedoucí k zániku
nádorové tkáně.
× Reoxygenace
- kyslíkový efekt
Atomy kyslíku, obsažené ve vodě a dalších
molekulách v tkáni, mají dominantní úlohu v
radiobiologickém účinku - ozářením vzniklé kyslíkové
radikály a peroxidy účinně poškozují DNA v
buňkách. Během nádorového růstu, se zvětšováním
nádorové masy, často dochází k nedostatku kyslíku v
buňkách, k tzv. hypoxii. K hypoxii
dochází zvláště tehdy, když nádor roste rychleji než
kapilární cévní síť nádorové neoangiogeneze. V
hypoxických nádorových buňkách pak probíhá mnohem
pomalejší metabolismus (často zůstávají v G0 fázi buněčného
cyklu) a při ozáření dochází k nižší tvorbě
kyslíkových radikálů - tyto buňky mají proto sníženou
radiosenzitivitu, jsou radiorezistentní.
Přežívající frakce těchto radiorezistentních hypoxických
buněk může být potenciálním rizikem recidivy nádorového
onemocnění.
Vlivem
ozařování může dojít k určité reoxygenaci
(snížení hypoxie) buněk nádorového ložiska: redukcí
počtu nádorových buněk se sníží celková spotřeba
kyslíku a zmenšením tumoru se též může snížit
intratumorózní tlak, uvolní se kapiláry a dojde k lepšímu
prokrvení a zásobení zbylých buněk. Efekt reoxygenace je pro
radioterapii pozitivní - zvyšuje radiosenzitivitu
nádorové tkáně *) a tím zlepšuje terapeutický efekt
při použití dávek limitovaných tolerancí zdravých tkání.
Kyslíkový efekt je významný především při použití
řídce ionizujícího záření (nejčastěji se používá
fotonové záření g či X), kde převládá nepřímý radikálový
mechanismus radiačního účinku. U hustě ionizujícího
záření, kde je zvýšený podíl přímého zásahového
mechanismu (a též zvýšená rekombinace radikálů), je vliv
kyslíku (oxygenace) na radiobiologické účinky méně
významný (viz "Hadronová radioterapie")
*) Vliv obsahu kyslíku na radiosenzitivitu
- tzv. kyslíkový efekt - se někdy vyjadřuje
pomocí faktoru OER (oxygen enhacement ratio),
udávajícího poměrné zvýšení biologické účinnosti
záření za přítomnosti kyslíku (normooxidaci) ve
srovnání s jeho nepřítomností. Mezi zcela anoxickou a
normoxickou tkání poměr OER dosahuje hodnoty cca 2,5.
Procesy
redistribuce a reoxygenace se velmi liší mezi různymi
nádorovými tkáněmi a jsou těžko předvídatelné. Je proto
obtížné zavést je do LQ modelu, zpravidla se uvažují
zvlášť. Všechny tyto individuální vlivy mohou mít za
následek změny v radiační citlivosti buněk
a tkání během ozařování, což vede k dalším
odchylkám od závislostí ideálního LQ modelu.
V poslední době se diskutuje i vliv tzv. bystander efektu
(viz §5.2 "Biologické
účinky ionizujícího záření",
pasáž "Bystander-Abscopal efekt"), který by snad mohl poněkud korigovat vliv
mírných nehomogenit v prozáření nádorové tkáně -
zvyšovat účinek v podexponovaných částech cílové tkáně.
× Objemový faktor - Radiační volum
Šestým faktorem, který je někdy důležitý pro výsledný
radiobiologický efekt v nádorové tkáni a hlavně v
rizikových - kritických orgánech, je objemová distribuce
radiační dávky - velikost ozářeného objemu (Radiated
volume). Na buněčné úrovni je biologický účinek dán
především velikostí dávky; stejně je tomu u lokálních
tkáňových účinků. Proto u orgánů se sériovým
uspořádáním funkčních částí (mícha, jícen, střevo,
zrakový nerv) je výsledný radiobiologický dopad závislý na
maximální lokální dávce: při vysoké lokální dávce
může být sériový orgán radiačně "přerušen" s
nevratným poškozením jeho funkce. Naproti tomu objemové
orgány s paralelním uspořádáním funkčních
částí (plíce, játra a pod.) dobře tolerují vysoké
lokální ozáření, třebas i nad 80Gy (způsobující výpadek
jen zanedbatelné funkční části), avšak i poměrně slabší
ozáření (cca 20Gy) celého jejich objemu může výrazně
porušit jejich funkci - výsledný orgánový účinek závisí
na průměrné dávce na celý orgán.

O různé radiační citlivosti tkání a orgánů a jejich
rozdělení na sériové a paralelní
viz §5.2,
pasáž "Lokální radiační účinky tkáňové a
orgánové".
Frakcionace
ozáření podle LQ modelu
Parametry a,b,l,T2r v rovnici závislosti přežívající frakce buněk na
dávce D a ozařovacím čase T podle lineárně-kvadratického
modelu, jakož i další biologické faktory redistribuce a
reoxygenace, jsou různé pro jednotlivé druhy tkání,
speciálně pro zdravé a nádorové tkáně. Této závislosti
lze využít pro optimalizaci výsledné
radiační odezvy nádorové tkáně vzhledem ke zdravé tkáni
pomocí vhodného časového rozvržení - frakcionace
- radiační dávky. Celková radiační dávka D se
rozloží na jednotlivé frakce di (i=1,2,...,n) s dobami ozařování ti. Při podrobné
analýze lze v rovnicích LQ modelu použít obecný Lea-Catchesidův
dávkově-časový integrál (odvozený v §5.2, "LQ
model"). Pokud se však jedná o rovnoměrně
rozložené frakce di ş d (D =n.d), jejichž
trvání ti=
t je krátké ve srovnání s celkovou dobou T
radioterapeutické léčby, lze tuto rovnici použít na celkovou
terapii, přičemž za dávkové a časové proměnné
dosadíme následující hodnoty:
l V lineárním a-členu dosadíme celkovou dávku D =n.d, které je
úměrný počet poškození dvojným a-procesem (a-procesy v
jednotlivých frakcích vzájemně neinteragují, skládají se
lineárně).
l V kvadratickém b-členu je důležitá okolnost, že druhá mocnina
dávky D2
v LQ modelu při frakcionaci není D2=n2.d2 (jak by přímočaře
plynulo z umocnění vztahu D=n.d), ale počet frakcí n
vystupuje v 1.mocnině: b.D2=b.n.d2. Exaktní odvození této skutečnosti spočívá v
řešení obecného Lea-Catchesidova integrálu. Plyne však i z
fyzikálně-biologického mechanismu: podle teorie duální
radiační akce (viz §5.2, část "Zásahová a
radikálová teorie radiačního účinku") se kvadratická
závislost na dávce vztahuje na jednorázově
absorbovanou dávku, v tomto případě tedy na dávku d jedné
frakce - b.d2; celkový efekt je tvořen součtem n nezávislých
frakcí, tj. n.b.d2. Jednotlivé frakce spolu neinteragují.
l Čas T v Lea-Catchesidově koeficientu u
kvadratického b-členu nahradíme expozičním časem ozařovací
frakce t (během něhož dochází k buněčné reparaci).
l Za čas T v aditivním repopulačním členu
vezmeme celkový čas T dané radioterapie (za
předpokladu, že ke kontinuální repopulaci buněk dochází
během celé terapie s přibližně konstantní rychlostí).
Výsledná
rovnice LQ modelu pro (pravidelně) frakcionované ozáření
celkovou dávkou D=n.d během celkové doby T, rozdělenou
na n frakcí o dílčích dávkách d a dobách
expozice t, pak bude:
-ln(N/No) = a.D + n.{2.[1-(1-e-l.t/l.t)]/l.t}.b.d - ln2.T/T2r .
Reparační mechanismus se může výrazněji uplatnit u LDR
brachyterapie, zvláště pak v pozdních fázích permanentní
brachyterapie (viz níže "Brachyradioterapie"). U teleterapie EBRT je expoziční čas
jednotlivých frakcí t krátký (cca desítky sekund až
minuty) vzhledem rychlosti buněčné reparace: t<<1/l, takže
Lea-Catchesidův faktor {...} můžeme položit rovný 1
(nedochází k interakcím mezi jednotlivými frakcemi) a
výsledný efekt bude: -ln(N/No) = a.D + b.n.d2 - ln2.T/T2r = (a + b.d).D - ln2.T/T2r . Při
jednorázovém krátkodobém ozáření (t=T<<T2r ) se
zase neuplatní aditivní repopulační člen (ln2.T/T2r)®0.
Pro základní
analýzu frakcionované radioterapie můžeme zanedbat časové
efekty reparace a repopulace - můžeme vyjít ze základní
rovnice LQ modelu:
E ş -ln(N/No) = a.D + b.D2 ,
kde logaritmus přežívající frakce buněk N/No je pro stručnost
označen E (jakási "efektivita ozáření").
Při pravidelně frakcionovaném ozáření je D = n.d, takže
jednoduché algebraické úpravy postupně dávají (odůvodnění první mocniny n u b.D2 bylo podáno výše) :
E = a.n.d + b.n.d2 = n.d.(a + b.d) = D.a.[1+(b/a).d] = D.a.[1+d/(a/b)].
Vidíme, že radiobiologický účinek roste se zvyšující se
dávkou na frakci d a závisí též na hodnotě poměru a/b pro ozařovanou
tkáň. Při vysokých dávkách na frakci je radiační účinek
výrazně vyšší; při dané dávce D je účinek nejvyššší
tehdy, když je aplikována jednorázově, v jedné frakci (n=1,
d=D). Aplikujeme-li větší počet frakcí n s nižší
dávkou d na frakci, musíme pro dosažení stejného
biologického účinku zvýšit celkovou dávku D.
Biologická efektivní dávka BED
Logaritmická efektivita ozáření E je tedy úměrná
celkové dávce D s koeficienty a a [1+d/(a/b)]; právě tento
druhý koeficient vyjadřuje vztah biologického účinku k
frakcionaci dávky a poměru a/b dané tkáně. Pro
vyjádření závislosti biologického účinku záření na
frakcionaci dávky se zavádí odvozená biofyzikální dávková
veličina biologická efektivní dávka BED (biologický
ekvivalent dávky):
BED ş E/a = D.[1+d/(a/b)] .
Lze říci, že BED = (fyzikální dávka)´(koeficient
úměrnosti); tento koeficient úměrnosti [1+d/(a/b)] (relativní
účinnost) ukazuje, jak biologický účinek ozáření závisí
na frakcionaci a poměru a/b pro konkrétní ozařovanou tkáň. Jelikož platí limd®0BED = D, představuje
BED jakousi fiktivní dávku, která by vedla k témuž
biologickému účinku, kdyby celková dávka D byla dodávána v
nekonečně velkém počtu nekonečně malých frakcí (nebo po
nekonečně dlouhou dobu s nekonečně malým dávkovým
příkonem - pokud ovšem zanedbáme časový faktor buněčné
reparace a repopulace).
Konkrétní
hodnoty BED se vyjadřují v dávkových jednotkách
[Gy] opatřených indexem daným numerickou hodnotou
poměru a/b pro konkrétní tkáň - BEDa/b. Např. dávka
60Gy, aplikovaná v 30 frakcích po 2Gy, vytvoří v časně
reagující tkáni (rychle rostoucí nádorová tkáň, kůže) s
a/b=10
biologickou efektivní dávku BED10 = 60.(1+2/10) = 72Gy10 , zatímco v pozdně reagující tkáni (plíce,
játra, ledviny) s a/b=3 je BED3 = 60.(1+2/3) = 100Gy3.
Koncepce BED má
význam především jako užitečný nástroj pro vzájemné porovnávání
účinků různých frakcionačních režimů: celková
dávka D1,
aplikovaná v n1 frakcích d1, dává stejný (ekvivalentní) biologický efekt jako
dávka D2
v n2
frakcích velikosti d2, pokud vede ke stejné hodnotě BED: D1.[1+d1/(a/b)] = D2.[1+d2/(a/b)]. Rovněž
výše zmíněný terapeutický poměr TR radiační
citlivosti nádorové tkáně a okolní zdravé tkáně lze
kvantifikovat jako poměr BED pro nádorovou tkáň
"TU" a normální zdravou tkáň "NT": TRBED = BEDTU/BEDNT .
LQL model
Při hypofrakcionačních režimech s vysokými
dávkami na frakci (d > 5 , 10 i více Gy/frakci),
které umožňují níže popsané pokročilé konformní
techniky stereotaktické radioterapie a HDR brachyterapie, se
ukázal určitý nesoulad mezi očekávanými a
pozorovanými účinky: klasický LQ model při těchto
vyšších dávkách na frakci poněkud nadhodnocuje biologický
účinek radioterapie, předpovídá vyšší poškození
normální tkáně NTCP. Jako kdyby zde křivky přežívající
frakce buněk -ln(N/No) (v log-lineárním měřítku) při vyšších
dávkách ve skutečnosti vykazovaly zvýšený podíl lineární
složky než kvadratické. Pro zachycení těchto klinických
poznatků se někdy používá empirická modifikace LQ modelu,
tzv. LQ-L model
(lineárně-kvadraticko-lineární), který pro vyšší
dávky/frakci (vyšší než 2.a/b, v praxi > cca 6Gy)
přidává dodatečnou lineární složku zvyšující
přežívající frakci buněk. K obdobným výsledkům vedou
další modifikace LQ modelu - zobecněný gLQ model, USC
(univerzální křivka přežití), KN (Kavahagh-Newman) model,
PLQ (Pade Linear Quadratic), LQC model
(lineárně-kvadraticko-kubický), viz §5.2, část "Odchylky a modifikace LQ modelu".
Frakcionace v praxi
Stejná radiační dávka aplikovaná za kratší čas (při
vyšším dávkovém příkonu) má větší biologickou
účinnost - srov. též obr.5.2.3 v §5.2, část "LQ
model". Z radiobiologického
hlediska by tedy bylo nejúčinnější jednorázové
ozáření *) daného ložiska potřebnou dávkou
záření několika desítek Gy. Problémem by zde však byla vysoká
akutní radiotoxicita pro okolní zdravé tkáně,
které vždy dostávají určitou (byť menší) dávku záření
spolu s cílovým ložiskem. Proto je nutno kurativní radiační
dávku rozdělit do většího počtu menších
částí - frakcí. Vhodnou frakcionací lze
dosáhnout toho, že v časovém intervalu mezi frakcemi
dochází k částečné reparaci a regeneraci
zdravé tkáně, která je pak schopna tolerovat zatížení
další dávkou. Tím se ale současně zvýší i tolerance
nádorových buněk (i když zpravidla méně než u buněk
zdravé tkáně), takže je nutné zvýšit celkovou
dávku do nádorového ložiska.
*) Uvažme však ješte bod 2.
v odstavci "Časová frakcionace ozařování"..?..
Nejobvyklejší frakcionace, normofrakcionace,
spočívá v aplikaci cca 2Gy 1´denně (5 dní v týdnu),
po dobu 5-8týdnů (5w-8w), celková dávka cca 60-80Gy.
Z radiobiologického hlediska optimální frakcionační schéma
závisí na druhu nádoru, zda je pomalu nebo rychle rostoucí. U
rychle rostoucích nádorů se používá tzv. hyperfrakcionace,
kdy se aplikuje více menších dávek (cca 1,2Gy) v kratších
časových intervalech, např. 2-3´ za den, pro omezení
rychlé repopulace klonogenních nádorových buněk. Pomaleji se
dělící buňky zdravých tkání se přitom (vzhledem k
časovému intervalu mezi frakcemi) stačí regenerovat, snižuje
se riziko pozdní radiotoxicity. Celý ozařovací proces se zde
často zkracuje a urychluje - tzv. akcelerovaná
radioterapie. Používají se klasicky 2 frakce/den, dále např.
režim CHART (Continuous Hyperfractinated Accelerated
RadioTherapy), hyperfrakcionované ozařování 3´denně,
kontinuální i přes weekend. Opačný postup, tzv. hypofrakcionace,
kdy se ozařuje jen 2´ či 1´ týdně, se používá v paliativní terapii, HDR
brachyterapii a někdy též u radiorezistentních a pomalu
rostoucích nádorů.
Jednorázové ozáření
vysokou dávkou záření desítek Gy se používá u tzv. stereotaktické
radioterapie, popsané níže ("Stereotaktická
radioterapie. Gama - nůž.");
zde již radiobiologická účinnost není přesně popsána LQ
modelem (vedle apoptózy se uplatňuje i okamžitá smrt buněk
nekrózou), zavádí se tzv. LQL model či další
vysokodávkové modifikace, popsané v §5.2, část "Odchylky a modifikace LQ modelu".
Vedle pravidelných
dávek, které jsou součástí použitého frakcionačního
režimu, se někdy navíc aplikují určité přídavné či
dodatečné dávky, tzv. boost (angl. boost
= přídavné zvýšení) - "dosycení".
Důvody aplikace boostu mohou být radiobiologické
(zlepšení lokální kontroly nádoru s ohledem na
individuální podmínky nádoru a okolních tkání) nebo technické
(když ze zdravotních důvodů pacienta či pro poruchu
ozařovače neproběhne celá ozařovací série podle časového
plánu - dodatečnou dávkou je potřeba vhodně kompenzovat
časové závislosti reakcí nádorové a zdravé tkáně). Pro
stanovení dávek v boostu je vhodné použít radiobiologické
modelování vycházející z LQ modelu; často se však
vychází z empirických zkušeností. Speciální technikou je
tzv. konkomitantní boost CB (Concomitant Boost; konkomitantní = souběžný), kdy při hyperfrakcionované radioterapii se aplikují
sekvenčně 2 dávky denně: jedna na celkový cílový objem
PTV, druhá pouze na vnitřní část GTV, obsahující
makroskopický objem vlastního nádoru (viz níže "Plánování
radioterapie"). Navyšuje se tak dávka v tom podobjemu
PTV, v němž je vyšší riziko recidivy. S použitím techniky
IMRT modulované intenzity svazku pomocí kolimátoru MLC (viz
níže "Modulace ozařovacích svazků") lze
poměrně přesně dosáhnout maxima dávky v tumoru (GTV),
poněkud nižší dávky v oblasti CTV s potenciální možností
mikrorozsevu a minimalizované dávky v okolních rizikových -
kritických tkáních. Obě dávky konkomitantního boostu je pak
možno sloučit a simultánně je aplikovat v rámci jedné
denní frakce. Tato zdokonalená technika, zvaná SIB
(Simultaneous Integrated Boost), postupně nahrazuje
sekvenční konkomitantní boost.
Predikce radioterapeutického efektu -
pravděpodobnost vyléčení nádoru TCP a poškození normální
tkáně NTCP
Úspěšná radioterapie - vyléčení nádorového
onemocnění - spočívá v likvidaci pokud možno všech
klonogenních buněk v nádorovém ložisku, které by byly
schopny znovu regenerovat nádor (recidiva), pokud by přežily.
Pro kvantifikaci tohoto základního cíle radioterapie a pro
predikci úspěšnosti léčby byla zavedena veličina TCP
(Tumour Cure/Control Probability) - pravděpodobnost
vyléčení nádoru. Radiobiologický účinek i
chování buněčných populací má stochastický
(pravděpodobnostní) charakter, řídí se Poissonovou
statistikou. Pravděpodobnost, že po ozáření nedojde
k opětovnému dělení klonogenních buněk a růstu nádoru, je
dána exponenciálním vztahem TCP = e-N, kde
N je počet přežilých klonogenních buněk v ložisku
po ozáření *). Dosadíme-li za N z LQ modelu,
dostáváme pro závislost TCP na dávce D dvojitý
exponenciální vztah:
TCP(D) = e-No.e-(a.D + b.D2)
= e-No.e-a . BED
,
kde No je
původní počet klonogenních buněk v tumoru před ozářením
(No se
pohybuje řádově kolem 1010-1012 buněk). Graf této funkce má esovitý tvar -
pro nízké dávky do asi 20-30Gy je TCP blízké nule (téměř
žádný terapeutický účinek), pak stoupá přibližně
lineárně a pro dávky nad 80-100Gy se postupně dosahuje
"stavu nasycení" TCP®1 (100% účinek) -
červená křivka TCP na obr.3.6.0b; konkrétní hodnoty jsou
ovšem různé pro jednotlivé druhy nádorové tkáně,
závisejí na radiosenzitivitě (na hodnotách a,b).
*) Tento pozoruhodně jednoduchý vztah
vyplývá ze složitějších zákonitostí matematické
statistiky. Celkové přežívání buněk je stochastickou
náhodnou veličinou binomického charakteru, řídící
se Poissonovým statistikým rozdělením. Máme-li
střední počet klonogenních buněk N, pak pravděpodobnost
P(n) náhodného jevu, že přežije n buněk, je dána
vztahem P(n) = (Nn/n!).e-N. Pro
n=0 dostáváme P(0) = (N0/0!).e-N = e-N.
Právě pokles počtu zbylých klonogenních buněk na n=0 lze
považovat za záruku definitivní likvikace tumoru;
jeho pravděpodobnost tedy je TCP = e-N.
Pro vyjádření nežádoucích biologických
účinků na normální zdravou tkáň při radioterapii se dále
zavádí analogická veličina NTCP (Normal
Tissue Complication Probability) - pravděpodobnost
komplikací z poškození normální tkáně NT,
především rizikových - kritických orgánů (viz
níže). NTCP vychází ze stejných Poissonových
stochastických zákonitostí radiačního usmrcení a přežití
buněk jako TCP, aplikovaných však na okolní zdravou tkáň,
ozářenou určitým zlomkem tumorózní dávky D. Při
dosazení z LQ modelu je třeba, kromě příslušných
parametrů No,a,b,l,T2r pro danou tkáň NT, zahrnout i objemový faktor,
s ohledem na sériový či paralelní typ tkáně:
NTCP(D,V)
= e-No.V-k.e-(a.D + b.D2)
= e-No.V-k.e-a . BEDNT ,
kde V[%/100] je relativní podíl objemu
ozářené normální tkáně, parametr k popisuje objemový
efekt (k=0-1; paralelní orgány s
velkým objemovým efektem mají vyšší hodnotu k než
sériové orgány s malým objemovým efektem), BEDNT je biologická efektivní dávka pro normální tkáň
NT. V parametru No (který zde již nemá bezprostřední význam
počátečního počtu buněk, jak je tomu u TCP) je implicitně
zahrnut požadavek na minimální počet přeživších
buněk (resp. jejich procento; jedná se o kmenové
klonogenní buňky) v NT, aby jejich deficit nevedl k
překročení funkční rezervy příslušného
rizikovího kritického orgánu a zůstala zachována jeho
potřebná funkce. Závislost NTCP(D) na dávce má podobný esovitý
tvar jako TCP(D), je ale vodorovně posunuta k vyšším
dávkám D (normální tkáň obdrží jen menší část
tumorózní dávky D, resp. je ozářena jen určitá část
objemu NT) - zelená křivka NTCP na obr.3.6.0b. Při
radiobiologickém modelování v radioterapii je pak snaha
maximalizovat TCP (®1) a minimalizovat NTCP (®0), i když je to často
velmi obtížné....
Funkční modelování
TCP a NTCP
Místo primárních shora odvozených 2-exponenciálních funkcí
se sigmoidální průběh křivek dávkové závislosti
TCP(D) a NTCP(D) v praxi modeluje pomocí
"sekundárních" tzv. probit-funkcí
(z angl. probability) Gaussovského tvaru
F(D,D50,m,V) = (1/Ö2p)-Ąň[(D/D50.V-k)
- 1]/me-x2/2dx ,
kde D50 je hodnota dávky s 50% pravděpodobností
studovaného efektu (likvidace nádoru či vzniku komplikace v
normální tkáni) a m je parametr strmosti
křivky TCP(D) nebo NTCP(D) v lineárním úseku (maximální
hodnota derivace podle dávky D). D50 a m
hrají úlohu form-faktorů sigmoidálního tvaru
křivek. V je relativní podíl objemu ozářené tkáně,
k popisuje volumový efekt. Pro TCP je
parametr k=0 (takže V0=1 - volum se
neuplatňuje), v případě NTCP hodnota
parametru k>0 modeluje normalizaci dávky
D na objem, s ohledem na sériový
či paralelní typ rizikové - kritické tkáně (výše
zmíněný objemový efekt, "šesté R"). V případě
nerovnoměrného ozáření kritické tkáně NT (jak je tomu v
praxi) se pro stanovení NTCP provádí vhodná korekce - místo
dávky D se zavádí tzv. ekvivalentní uniformní dávka
EUD, přepočítávající efekt ozáření
jednotlivých sub-objemů Vi (celkového počtu N, tj.
i=1SNVi = Vtot = 1)
parciálními dávkami di na rovnoměrné (uniformní)
ozáření celého rizikového kritického orgánu: EUD = (i=1SNVi.dik)1/k (vážený součet
příspěvků parciálních volumů daného orgánu NT s
objemovým faktorem k). Modelování radioterapeutického efektu
pomocí TCP a NTCP poprve zavedli J.T.Lyman, G.J.Kutcher a
C.Burman v 80.letech (LKB model).
Metodologická poznámka: Jednotná koncepce TCP
a NTCP
Z hlediska radioterapie jsou TCP a NTCP nezávislé veličiny,
vztahující se k různým tkáním s odlišnými parametry
radiosenzitivity a s protichůdnými požadavky
radiobiologického efektu. V odborné literatuře se proto
většinou zavádějí jako oddělené modely. Základní ideové
aspekty však TCP i NTCP mají společné: stejný
radiobiologický mechanismus přežití a usmrcení buněk
(kvantifikovaný v LQ modelu) a pravděpodobnostní charakter s
Poissonovým rozdělením. Zde jsme se pokusili nastínit sjednocenou
teorii, odvozující TCP i NTCP ze stejných výchozích
"prvotních principů", kterými zde jsou
Poissonovské statistické rozdělení a LQ model dávkové
závislosti buněčného přežití. Základní přístup je pak
úplně stejný, jen u NTCP se zavede procento ozářeného
objemu NT a objemový faktor dané tkáně NT. Model TCP a NTCP
se tím sjednocuje do jedné koncepce. Otevřeným problémem v
tomto přístupu ale zůstává vyjádření minimálního
množství (procenta) klonogenních buněk v NT, které musí
přežít pro zachování dlouhodobé funkčnosti
rizikových kritických tkání a orgánů - s ohledem na
funkční rezervu příslušných NT, jejich paralelní či
sériový charakter s různou velikostí a organizací
funkčních podjednotek.
 |
Obr.3.6.0. Některé
radiobiologické aspekty v radioterapii - grafické
znázornění (modelové příklady).
a) Základní LQ model závislosti biologického
účinku na dávce. b) Grafické
znázornění závislosti TCP, NTCP a UTCP na dávce D. c)
Kvantifikace úspěšnosti radioterapie při
konvenčním ozařování (nahoře) a konformní
radioterapii IGRT (dole). |
Pro posouzení celkové radioterapeutické
optimalizace se veličiny TCP a NTCP někdy kombinují.
Zavádí se tzv. pravděpodobnost nekomplikované léčby
UTCP (Uncomplicated Tumour Cure Probability):
UTCP = TCP.(1-NTCP) ;
V případě ozáření několika rizikových kritických tkání
NT1,NT2,...,NTn, sousedících s
cílovým objemem, vystupují pravděpodobnosti NTCPi komplikací u i-tého
kritického orgánu v součinu koeficientů (1-NTCPi):
UTCP = TCP. i=1Pn(1-NTCPi) .
Křivka závislosti UTCP(D) na radiační dávce má zvonový
tvar (modrá křivka na obr.3.6.0 uprostřed) - je nulová
při malých (nedostatečných) dávkách, roste k maximu při
optimální dávce Dopt a pak klesá zase k nule pro příliš vysoké dávky,
poškozující zdravé kritické tkáně. Dávka Dopt, odpovídající
maximu UTPC, vyjadřuje optimální dávku z hlediska vztahu
dosažené pravděpodobnosti TCP likvidace nádoru a přijatelné
hladiny pravděpodobnosti NTCP poškození zdravé tkáně NT.
Poloha a výška tohoto maxima UTCP výrazně závisí na preciznosti
ozařovací metodiky: s použitím konformní radioterapie
IGRT či stereotaktické radioterapie (popsané níže) se
maximum UTCP posouvá k vyšším dávkám, díky snížení
objemu ozáření rizikových kritických tkání ® zmenšení NTCP,
lepší tolerance okolních tkání (obr.3.6.0c).
Pro optimalizaci
radioterapie se všechny uvedené odvozené dávkové funkce
získávají přepočtem z dávkově-volumových histogramů
DVH při 3D plánování radioterapie (viz níže "Plánování
radioterapie"), za
použití speciálních počítačových softwarů; plochy pod
křivkami DVH představují relativní "parciální
objemy" ozářených tkání NT. Rovněž výše zmíněný terapeutický
poměr TR se někdy vyjadřuje pomocí poměru těchto
hodnot: TRTCP = TCP/NTCP. Hodnocení všech těchto parametrů není
vždy jednoznačné, názory na "váhu" likvidace
tumoru a vedlejších účinků na zdravou tkáň se někdy
liší. Vzhledem k nebezpečnosti nádorových onemocnění je
však třeba připomenout, že (s výjimkou fatálního
poškození důležitých kritických orgánů) nejzávažnější
komplikací je recidiva nádoru!
Časový faktor - vliv buněčné reparace a repopulace
Do odvozených biofyzikálních dávkových
veličin BED a TCP, používaných v radioterapii, lze v principu
"zabudovat" i vliv časových faktorů - vliv
buněčné reparace a repopulace v průběhu ozařování na
výsledný biologický účinek. Nahrazením zjednodušené
rovnice LQ modelu -ln(N/No) = a.D + b.D2 obecnou rovnicí s Lea-Cathesidovým faktorem
buněčné reparace a aditivním repopulačním členem dostaneme
pro BED a TCP obecnější výrazy:
BED
= D.[1
+ {2.[1-(1-e-l.t/l.t)]/l.t}.d/(a/b)] - T.ln2/(a.T2r) ,® TCP = e-No.e-a . BED
.
Podobně pro NTCP. Příliš velký počet parametrů - a tím i
stupňů volnosti - však komplikuje radiobiologické
modelování a činí jej mnohdy nejednoznačným. V praxi
zpravidla vystačíme s jednoduchými zákonitostmi, doplněnými
empirickou zkušeností (srov. výše uvedenou pasáž "Frakcionace
v praxi")...
Buněčná reparace způsobuje, že aplikujeme-li dvě
radiační frakce o dávce d, je radiobiologický efekt
nižší než při jednom ozáření dávkou 2d. Např. [N/No](2´2Gy)<[N/No](4Gy).
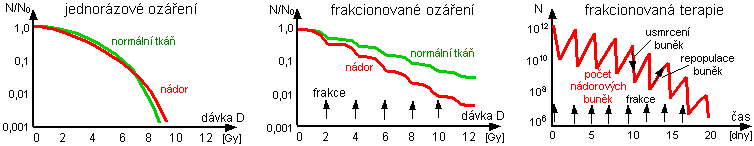
Při ozařování probíhá buněčná reparace ve zdravé
tkáni i v nádoru, avšak s rozdílnou rychlostí. Pro nižší
dávky je zpravidla usmrceno více nádorových buněk, než
buněk normální (pozdně reagující) tkáně. Při vysokých
jednorázových dávkách může dojít ke
"křížení" křivek normální a nádorové tkáně,
účinek na zdravou tkáň může být vyšší. Při
frakcionované terapii se dosahuje vyššího účinku na
nádorovou tkáň a nižšího na zdravou tkáň, přičemž
tento žádoucí rozdíl se s počtem frakcí stále zvyšuje.
U frakcionované radioterapie se dále může projevit
buněčná repopulace nádorových buněk mezi
jednotlivými frakcemi, neboť celková doba léčby je poměrně
dlouhá. Pro frakcionovanou terapii nádorové tkáně s
koeficienty a,b a zdvojovacím poločasem repopulace T2r, s celkovou dávkou D
rozdělenou na frakce d během celkové doby léčby T,
vychází pro biologickou efektivní dávku BED z LQ
modelu (bez reparace, ale s repopulací) vztah: BED = D.[1+d/(a/b)] - T.ln2/(a.T2r). Časový faktor
repopulace tedy snižuje biologický účinek
ozařování, zvláště pro rychle rostoucí nádorové buňky
(zde se snížení BED odhaduje na 0,5 Gy/den), což je potřeba
kompenzovat navýšením celkové dávky.
Model plynulé exponenciální repopulace s pevným
zdvojovacím poločasem T2r během celého ozařování je jen přibližný, ve
skutečnosti dochází v ozařované tkáni k výše zmíněnému
efektu redistribuce buněk (čtvrté "R") se
složitou časovou dynamikou, zahrnující progresívní
repopulaci. Jeho přesné zahrnutí je obtížné, aditivní
člen by měl tvar integrálu, modelově např. (ln2/T2r).0ňT(1-k.e-v.t)dt, s časově
proměnným rychlostním koeficientem v(t) změny rychlosti
repopulace. Pro praxi však postačuje jednodušší přístup.
Důležitý je čas Tacc od začátku terapie, kdy dojde k zahájení akcelerované
repopulace kmenových klonogenních buněk (označuje se někdy jako zpožďovací čas
akcelerované repopulace Tdelay). Snížení
radiobiologického efektu po uplynutí této doby lze pak
zjednodušeně zapsat pomocí vztahu E ş -ln(N/No) = D.(a+b.d) - K.(T-Tacc), kde empirický
faktor K (podle předchozího teoretického přístupu
K=ln2/(a.T2r)) vyjadřuje míru
snížení biologického účinku - zároveň má význam denní
dávky [Gy], potřebné ke zničení nově vzniklých buněk za
tento den, tj. dávky potřebné ke kompenzaci repopulace
klonogenních buněk. Pomocí BED (şE/a) lze tento vztah zapsat ve
tvaru BED = D.[a+d/(a/b)] - K.(T-Tacc)/a. U nádorů v oblasti hlavy a krku se čas Tacc pohybuje kolem asi
28 dnů, přičemž při prodlužování celkové doby terapie T
dochází ke ztrátě biologické účinnosti záření o zhruba
0,8Gy za každý den. Uvedený vztah se někdy používá i pro
kratší časy T<Tacc, kde se ekvivalentní dávka naopak relativně
zvyšuje.
Každopádně je třeba mít na paměti přibližnost
tohoto přístupu. Parametr K patrně není konstantní v
průběhu terapie, na začátku je malý a s časem se zvyšuje -
progresívní repopulace. Čas Tacc nástupu akcelerované repopulace závisí na
aplikované radiační dávce a jejím časovém rozvržení
(frakcionaci). A obě tyto veličiny jsou samozřejmě různé
pro různé druhy ozařované buněčné populace.
Kombinovaná
chemo-radioterapie
Ozařování se někdy vhodně kombinuje s chemoterapií
(konkomitantní - průvodní,
doplňující terapie, zmíněná již výše), která může mít buď aditivní efekt (nezávislé
cytotoxické zabíjení buněk), nebo za určitých okolností
může zvyšovat účinek radioterapie (tzv. potenciace)
- zvyšovat radiační citlivost ozařovaných tkání buď
inhibicí reparačních mechanismů DNA, nebo vhodným časovým
ovlivněním buňečného cyklu do fáze citlivější k
záření (např. G2). Popř. se před ozářením aplikuje neoadjuvantní
chemoterapie pro redukci rozsahu nádoru, aby bylo možno
nádorové ložisko selektivněji ozářit při dostatečném
šetření okolních rizikových - kritických tkání a
orgánů.
Biologické účinky
kombinované chemoradioterapie lze v principu rovněž
kvantifikovat pomocí vhodně modifikovaného LQ modelu. Pro
tento účel je třeba odděleně analyzovat tři základní
mechanismy biologického účinku simultánní
chemo-radioterapie:
¨ Aditivní
efekt je dán součtem radiobiologického účinku
radioterapie a cytotoxického účinku chemoterapie, které jsou
vzájemně nezávislé. Vliv konkomitantní chemoterapie na
výsledný biologický účinek můžeme pak v LQ modelu
vyjádřit přidáním nového nezávislého členu Ech, který vyjadřuje
účinnost cytotoxického zabíjení buněk při chemoterapii;
hodnota Ech
představuje logaritmus přežilé frakce buněk po samostatné
chemoterapii. Celkový aditivní efekt chemoradioterapie pak je:
E ş -ln(N/No) = a.D + b.D2 + Ech .
¨ Radiosenzibilizační
(potenciační) efekt chemoterapie, která zesiluje
biologický účinek ionizujícího záření na buňky. Do LQ
modelu se zahrne přidáním nového koeficientu - senzibilizačního
faktoru s, který vyjadřuje zvýšení radiační
citlivosti buněk vlivem chemoterapie. Tímto koeficientem se
efektivně násobí radiační dávka v a- a b-členu, takže výsledný
efekt radiochemoterapie se senzibilizací je: E ş -ln(N/No) = a.D.s + b.D2.s2 .
¨ Inhibice
repopulace cytostatiky a
zvláště některými preparáty cílené biologické léčby,
jako jsou monoklonální protilátky proti růstovým faktorům,
snižujícími repopulaci nádorových buněk během
frakcionované radioterapie, což vede k likvidaci větší
frakce nádorových buněk účinkem záření. V LQ modelu s časovým faktorem
-ln(N/No)
= a.D + {2.[(1-e-l.T).(1-1/l.T)]/l.T}.b.D2 - ln2.T/T2r lze toto
zpomalení buněčné repopulace zachytit modifikací aditivního
členu RPşln2.T/T2r - násobením zdvojovacího poločasu repopulace T2r
koeficientem větším než 1. Při stejném ozáření
radiační dávkou D během doby T se tím sníží
přežilá frakce buněk N/No v nádoru. Inhibice repopulace vlivem vhodné
chemoterapie prodlužuje jak poločas repopulace T2r, tak
čas Tacc
od začátku terapie, kdy dojde k zahájení akcelerované
repopulace klonogenních nádorových buněk. V souvislosti s
analýzou z předchozího odstavce tedy dochází k menší
ztrátě biologické účinnosti při prodlužování doby
frakcionované terapie, efektivně tedy ke zvýšení
účinku terapie.
U chemosenzitivních nádorů může chemoterapie
též způsobit zmenšení objemu,
jakési "scvrknutí", nádoru (podobný efekt jako u neoadjuvantní
chemoterapie). Takový zmenšený nádor je pak snadněji
léčitelný radioterapií jednak samotným snížením počtu
nádorových buněk, jednak příp. zlepšenou oxygenací
a tím zvýšenou radiosenzitivitou v důsledku kyslíkového
efektu. Tyto efekty však již nelze objektivně zahrnout do LQ
modelu.
Strategický cíl a
metody radioterapie
"Strategickým cílem"
radioterapie je tedy selektivní likvidace nádorového
ložiska při co nejmenším poškození okolních
zdravých tkání - tak aby nebyla ohrožena jejich funkčnost.
Ozáření okolních tkání se přitom nikdy nedá zcela
vyhnout, je však třeba dodržet tzv. toleranční
dávku v rizikových kritických tkáních a
orgánech *). Do cílové oblasti je třeba zavést dostatečně vysokou
dávku záření, pro nádorové buňky letální
- tumorózní kanceroletální dávku (cca 50-150 Gy)
takovým způsobem, aby okolní zdravé tkáně nebyly enormně
poškozeny. Úkolem radioterapie v klinické praxi je najít optimální
kompromis mezi těmito dvěma protichůdnými
požadavky. V této kapitole si z fyzikálního hlediska
stručně popíšeme, jak je základního strategického cíle
radioterapie dosahováno různými metodami ozařování.
*) Rizikovým kritickým orgánem
či tkání rozumíme takovou strukturu v organismu, jejíž
radiační poškození by mělo vážné zdravotní následky,
či v případě životně důležitých orgánů dokonce smrt.
Při radioterapii proto nesmí být překročena určitá tzv. toleranční
dávka v těchto kritických orgánech, aby nedošlo k
jejich ireverzibilnímu poškození. O různé radiační
citlivosti tkání a orgánů a jejich rozdělení na sériové
a paralelní viz §5.2, pasáž "Lokální radiační účinky
tkáňové a orgánové".
Teoreticky by všechny nádory mohly být lokálně
vyléčitelné radioterapií, avšak překážkou je limitovaná
tolerance zdravých tkání a orgánů, jejichž ozáření se
nedá vyhnout - radiotoxicita pro zdravé
tkáně.
Vedlejší účinky
radioterapie - radiotoxicita, sekundární malignita
Jak již bylo výše na několika místech zmíněno, častým
limitujícím faktorem dosažení dostatečně vysoké
kanceroletální dávky v nádorových ložiscích je radiotoxicita
(zvaná též radiační morbidita) pro okolní zdravé
tkáně a orgány, které jsou vždy částečně ozářeny spolu
s nádorovou tkání. Z časového hlediska se při radioterapii
projevují v zásadě tři druhy nežádoucích následků
radioterapie :
- Časná akutní radiotoxicita
se projevuje během několika dnů až týdnů od začátku
ozařování. Je způsobena úbytkem kmenových buněk u rychle
proliferujících tkání s krátkým buněčným cyklem, kde je
potřeba průběžná a rychlá produkce dceřinných
efektorových buněk. Úbytek těchto kmenových buněk při
ozáření záhy vede k depleci buněk efektorových, což se
projeví ve zhoršené funkci postižené tkáně či orgánu.
Složitá časová dynamika dělení rychle proliferujících
buněk při protrahovaném ozařování (asymetrické dělení,
akcelerovaná repopulace,...) byla diskutována výše v rámci LQ
modelu, pasáž "Redistribuce". Časnou
radiotoxicitou bývají postiženy sliznice (jícnu či střev),
kostní dřeň, epidermis. Klinické projevy časné
radiotoxicity, pokud nebyla příliš závažná, jsou většinou
dočasné a vlivem postupné náhrady chybějících
buněk (dělením kmenových buněk) odezní do několika
týdnů. Časná radiační toxicita může později přecházet
v pozdní toxicitu (nastává často při vysoké časné
toxicitě) - označuje se jako konsekvenční
pozdní radiotoxicita.
Velmi
časné radiotoxické účinky
Při ozáření vysokými dávkami při radioterapii se poměrně
rychle, během několika hodin, mohou objevit velmi časné
příznaky jako je únava, nevolnost, sucho v ústech. Tyto
projevy velmi časné radiotoxicity nejsou způsobeny
mechanismy radiačního usmrcování buněk - větší počet
buněk je sice poškozen, avšak toto poškození se projeví
později, až při mitóze těchto buněk. Velmi časná
radiotoxicita je zde způsobena podrážděním regulačních
center přímým působením ozářením uvolněných
iontů, radikálů a dalších zplodin radiolýzy.
- Pozdní
radiotoxicita
se projevuje se zpožděním mnoha týdnů až měsíců (někdy
i několika roků) po ozařování. Je důsledkem poškození
tkání s pomalou obnovou efektorových buněk, kde je proto i
nízká proliferační rychlost kmenových buněk. Poškození
těchto kmenových buněk (které se nedělí průběžně, ale
až při úbytku efektorových buněk a potřebě jejich
doplnění) sice nastává již při ozáření, ale projeví se
až při potřebě jejich dělení, které je neúspěšné
(mitotická smrt). To zde nastává s delším časovým odstupem
a projevuje se deplecí dceřinných efektorových buněk v
postižené tkáni. Pozdní radiotoxicita se projevuje u
vazivových tkání (podkožních, podslizničních), kostí,
svalů (myokard), oční čočky, ledvin či plic. Klinické
následky pozdní radiotoxicity jsou zpravidla trvalé.
Radiačně indukované poškození srdce - kardiotoxicita,
projevující se aterosklerózou srdečních tepen, fibrózou,
popř. poškozením srdečních chlopní, se vyskytuje při
radioterapii v oblasti hrudníku, např. při ozařování
nádorů prsu. Plicní toxicita při vyšších dávkách může
způsobovat fibrózu plicní tkáně. Zhoršení renální funkce
- nefrotoxicita - se můře vyskytovat po radioterapii v oblasti
břicha a urogenitálních nádorů.
Optimalizací ozařovacího režimu, především přesným
směrováním ozařovacích svazků a vhodnou frakcionací
radiačních dávek, lze nežádoucí poškození zdravých
tkání do značné míry minimalizovat či omezit jej na
přijalnou úroveň.
- Velmi pozdní stochastické
účinky
Velmi pozdní nísledky radioterapie se projevují s odstupem
několika let až desítek let po ozáření. Vzhledem k
dlouhému časovímu odstupu od ozáření je velmi obtížné
či nemožné určení kauzální souvislosti mezi ozařováním
a nežádoucím účinkem. Jejich klinická manifestace a
průběh nelze odlišit od spontánně vzniklých onemocnění u
osob, které zářením léčeni nebyly.
Vedle žádoucích deterministických
účinků na nádorovou tkáň, na nichž je radioterapie
založena, i nežádoucích radiotoxických účinků na zdravou
tkáň, se po delším čase mohou vyskytnout sekundární
postradiační malignity, způsobené stochastickými
účinky té části záření, která se absorbovala mimo
primární cílový tumor (včetně
rozptýleného záření) a ozářila i
další tkáně a orgány. Odlišit tuto radiačně
indukovanou karcinogenezi od spontánně vzniklých
případů je obtížné (ostatně, již vznik prvního
nádorového onemocnění ukazuje na zvýšenou predispozici
daného jedince k těmto onemocněním). Riziko či incidence
těchto sekundárních radiačně indukovaných malignit se
odhaduje na cca 3%/60Gy. Někdy se
diskutuje, zda k sekundárním malignitám může přispět i
expozice z častého verifikačního zobrazování u metod
radioterapie navigované obrazem IGRT (viz níže).
Způsoby radioterapie
Podle základního způsobu či cesty, jakou se záření
"dopravuje" do požadovaného cílového místa
(postižené tkáně či orgánu), se radioterapie metodicky
dělí na tři modality :
n Teleterapie - ozařování "na dálku" svazky
záření z vnějšího ozařovače, označuje
se též jako EBRT - external beam
radiotherapy (tato ozařovací
"vzdálenost" je jen relativní, ozařovač je obvykle
od těla vzdálen max. 80 cm).
Pozn.: Název teleterapie
zde však příliš nepoužívám pro jeho zavádějící
podobnost se šarlatánskými metodami "teleterapie"="léčení
na dálku"...
n Brachyterapie
- ozařování "na blízko" - vložení
uzavřených radionuklidových zářičů, radioforů,
do nádorové tkáně či do její těsné blízkosti.
n Radioisotopová terapie - aplikace otevřených radionuklidů ve
vhodné chemické formě přímo do organismu (nejčastěji
intravenózně, někdy perorálně). Radionuklidy se pak do
cílových nádorových tkání dostávají metabolickou
cestou a likvidují nádorové buňky "zevnitř"
- biologicky cílená radioisotopová terapie BTRT
(Biologically Targeted Radionuclide Therapy).
O těchto třech základních radioterapeutických
metodách bude níže postupně pojednáno, především z fyzikálního
hlediska.
Pozn.: V
konvenční radioterapii se většinou požaduje, aby cílové
ložisko (objem) bylo pokud možno homogenně prozářeno
dostatečně vysokou dávkou záření. Tento požadavek ale
neplatí pro brachyterapii a stereotaktickou
radioterapii, kde je dávková distribuce silně nehomogenní,
s prudkým spádem od cílového ložiska (bude popsáno níže).
Vnější
ozařování zářením gama, X a elektrony (teleradioterapie)
Nejčastější způsob radioterapie je ozařování kolimovaným
svazkem pronikavého záření z vnějšího
ozařovače. Rentgenové (X) záření vyšších energií (cca
100 keV) se používalo zvláště v minulosti *), nyní se
využívá např. pro ozařování kožních lézí. Radioterapie
vysokoenergetickými těžkými částicemi bude probrána níže
v samostatném odtavci "Hadronová radioterapie". Zde se budeme zabývat především
ozařováním vysokoenergetickým zářením gama.
*) Hlavním nedostatkem rentgenové
terapie byla nemožnost dosažení dostatečné dávky
záření v hlouběji uloženém nádorovém
ložisku, aniž by byly enormě radiačně zatíženy zdravé
mělce uložené tkáně, především kůže. Tento nedostatek
byl do značné míry vyřešen použitím pronikavého záření
o podstatně vyšších energiích několika MeV, kdy kůže a
povrchové tkáně přestaly být limitujícím faktorem,
protože maximum dávky se posunulo do hloubky. Nejprve to byly kobaltové
a cesiové ozařovače (byly zavedeny v 50.letech), později
tvrdé záření generované betatrony a posléze lineárními
urychlovači.
Terminologická poznámka: Kilovoltážní - Megavoltážní
Generátory záření se v radiologické "hantýrce" (v
souvislosti s historickým vývojem) podle produkovaných energií
záření rozdělují do dvou kategorií :
Kilovoltážní - poskytující energie kvant do
1000keV, je většinou produkováno rentgenkou;
Megavoltážní - poskytující energie kvant
nad 1MeV, je produkováno urychlovači (popř. radionuklidy s
příslušně vysokou energií záření g; výjimkou je cesium 137Cs s energií Eg 662keV, které se
zařazuje mezi "megavoltové").
Tyto slangové výrazy nejsou z fyzikálního hlediska příliš
vhodné a mohou být zavádějící. V našem pojednání je
nepoužíváme.
Intenzita záření klesá s
druhou mocninou vzdálenosti od zdroje. Při větší
vzdálenosti získáme výhodnější poměr mezi množstvím
záření, které dopadá na povrch těla a množstvím záření
pronikajícím do hloubky. Při hloubkovém ozařování se proto
ozařuje ze vzdálenosti min. 60cm od povrchu těla.
Gama -
ozařovač
Radioterapie se v současné době provádí především pronikavým
zářením gama, produkovaném buď radioisotopovými
ozařovači 137Cs (g 662 keV) a 60Co (g 1173+1322 keV) (o radionuklidech
viz §1.4 "Radionuklidy"), nebo vznikajícím jako brzdné
záření *) při dopadu vysokoenergetických elektronů
urychlených v betatronu či lineárním
urychlovači (na energie Ee cca 4-40MeV) na vhodný brzdný terčík z
těžkého kovu (obr.3.6.1b) - zde se energie záření pohybují
v jednotkách až desítkách MeV (viz
§1.5 "Elementární částice", část "Urychlovače nabitých částic"). Terčík je zhotoven
většinou z wolframu, na destičce tloušťky cca 2-3cm je v
místě dopadu elektronového svazku ztenčen na cca 3mm -
pracuje v "transmisním" režimu, využívá se brzdné
záření vycházející z terčíku ve směru původního
elektronového paprsku. Robustní provedení destičky
zajišťuje odvod tepla (většina
kinetické energie elektronů se přeměňuje v teplo).
*) Terminologická poznámka: záření
X nebo g ?
V §1.2 "Radioaktivita", část "Radioaktivita gama",
jsme uvedli terminologickou dohodu, že fotonové záření
emitované z atomových jader se nazývá záření g
(i v případě, když má nízkou energii několika keV),
zatímco záření vznikající přeskoky elektronů v atomovém
obalu a brzdné záření elektronů se nazývá záření
X (rentgenové - i tehdy, když má vyšší energii
desítky a stovky keV). U brzdného záření vznikajícího v
urychlovačích při energiích několika MeV by však taková
terminologie (jakési "megavoltové X-záření") byla zavádějící,
i když se někdy používá. Toto záření leží hluboko v g-oblasti
klasifikace elektromagnetického spektra, má dokonce podstatně
vyšší energii než obvyklé záření g z radionuklidů. Proto
budeme toto vysokoenergetické brzdné záření nazývat záření
gama.
V současné době byly betatrony již zcela
vytlačeny vysokofrekvenčními lineárními urychlovači
elektronů - LINAC, které jsou menší,
flexibilnější a poskytují vysokou intenzitu záření -
obr.3.6.1b,c (fyzikální principy a
konstrukce urychlovačů jsou podrobněji popsány v §1.5
"Elementární částice a urychlovače", část "Urychlovače
nabitých částic"). U větších urychlovačů pro energie kolem 20MeV je
z geometrických důvodů LINAC umístěn kolmo na gantry a
elektronový svazek je elektromagneticky vychylován do
transverzálního směru ozařování (obr.3.6.1b). Vychylovací
elektromagnet slouží zároveň jako energetický filtr
elektronů, který do požadovaného směru vychyluje jen
elektrony požadované energie (hybnosti) - ostatní elektrony
končí na stěnách trubice (na obr.3.6.1b
je pro jednoduchost znázorněn ohyb elektronového svazku pod
úhlem 90°, avšak většinou se používá 270°,
umožňující lepší fokusaci elektronového svazku). Menší urychlovače do 6MeV mohou mít i kompaktní
"přímočaré" provedení bez vychylování
elektronového svazku (náznakově je vidět níže na
obr.3.6.4a,c).
Ozařovače pro radioterapii, osazené
lineárními urychlovači elektronů o energii většinou 6 či
18MeV, dodávají v současné době především dva hlavní
výrobci: americký Varian (Palo Alto, California, původně výrobce klystronů a
urychlovačů) a švédská Elekta
(Stockholm, vyrábí i Leksellův
gama-nůž). K nim pak nově přistupují
firmy Tomotherapy a Accuray (které fúzovaly), vyrábějící
speciální tomoterapeutické a stereotaktické robotické
systémy, osazené kompaktními lineárními urychlovači
většinou 6MeV - viz níže "Tomoterapie; Stereotaktická
radioterapie".

Vlevo: Spojité
spektrum brzdného záření gama vznikajícího dopadem
elektronů energie Ee 6MeV a 18MeV z lineárního
urychlovače na terčík. Uprostřed: Čárové
spektrum g-záření radionuklidů 137Cs a 60Co. Vpravo: Procentuální hloubková
závislost dávky pro různé energie fotonového záření (ve
vodním fantomu).
Brzdné fotonové záření, vznikající
dopadem elektronů o energii Ee na terčík, má spojité energetické spektrum
s převahou nižších energií (do 1/3 Ee), které od svého plochého vrcholu (kolem 1/8 Ee) plynule klesá a
posléze končí u maximální energie těsně pod hodnotou
energie elektronů Ee. Je třeba si uvědomit, že střední energie tohoto
záření je podstatně nižší než původní
energie svazku elektronů z urychlovače. Např. při použití
elektronů urychlených na energii Ee=6MeV je ve spektru brzdného záření maximum kolem
500keV, střední energie cca 1,5MeV, zatímco podíl fotonů s
maximální energií blížící se 6MeV je již velmi malý
(jednotky %); obvyklé tvrzení že "ozařujeme energií
6MeV" je tedy poněkud zavádějící. Stojí za
povšimnutí, že hloubková distribuce dávky ve vodě (a
tkáni) je u g-záření 60Co a brzdného záření z urychlovače Ee=4MeV téměř
totožná; a je jen zlehka odlišná u urychlovače s Ee=6MeV. Tyto
urychlovače s nižší energií jsou proto v zásadě
zaměnitelné s kobaltovým ozařovačem (kobaltový
zdroj má poněkud větší rozměry vlastního zářiče a
tudíž větší polostín ve svazku).
Účinný průřez
pro produkci brzdného záření je obecně dán značně
komplikovaným Bethe-Heitlerovým vzorcem (odvozeným v rámci kvantové teorie záření, s
korekcí Sauterovým a Elwertovým faktorem
Coulombovského stínění elektronového obalu). Pro ne příliš široké rozmezí energií
dopadajících elektromů Ee a protonových čísel Z terčíkového
materiálu (středně těžké až těžké materiály) lze
celkovou účinnost produkce brzdného záření
h
aproximovat zjednodušeným vzorcem:
h = Ee[kev] . Z . 10-6 [fotonů/elektron] .
Jen poměrně malá část (pouze cca 1%)
původní kinetické energie dopadající částice se při
zabrzdění v látce mění na brzdné záření. Většina
energie se mnohonásobným Coulombovským rozptylem nakonec
přenáší na kinetickou energii atomů látky - mění se na teplo.
Je logické, že
účinnost produkce brzdného záření je vyšší pro vysoké Z
- v okolí takových jader působí velké elektrické
Coulombovské síly, způsobující prudké změny vektoru
rychlosti dopadajících elektronů, které se dostanou blízko k
jádru. Účinnost vzniku brzdného záření [počet
fotonů/elektron] roste i s energií Ee dopadajících elektronů. Celková energetická
účinnost - poměr sumární energie emitovaných fotonů ku
energii dopadajících elektronů - je však pro vyšší energie
nižší (vzhledem k vyššímu procentuálnímu zastoupení
nízkoenergetických fotonů). A tepelné ztráty v terčíku
jsou vyšší.
Kontaminace
fotonového svazku elektrony a neutrony
Vzniklý svazek vysokoenergetického
brzdného g-záření je vždy poněkud kontaminován
elektrony, uvolňujícími se při interakcích fotonů
s materiálem terčíku, homogenizačního filtru, clon a
kolimátorů. Dochází ke Comptonovu rozptylu, fotoefektu,
tvorbě elektron-pozitronových párů. Při všech těchto
procesech jsou z materiálu emitovány rychlé elektrony. Při
vyšších energiích, nad cca 10MeV, dochází i k fotojaderným
reakcím a uvolňování neutronů (viz níže).
Sekundární částice, kterými je kontaminován svazek
fotonového záření, snižují hloubkový efekt a zvyšují
radiační dávku i mimo směr primárního záření, podílejí
se na zvýšení radiační dávky mimo cílový objem.
Homogenita
ozařovacího svazku
Svazek brzdného g-záření, rozbíhající
se kuželovitě z interakčního místa v terčíku, má v
centrálním směru podstatně vyšší intenzitu než v
částech okrajových (vyzařovací diagram
brzdného záření má tvar "laloku" ve směru dopadu
vysokoenergetických elektronů - §1.6, část "Interakce
nabitých částic - přímo ionizující záření").
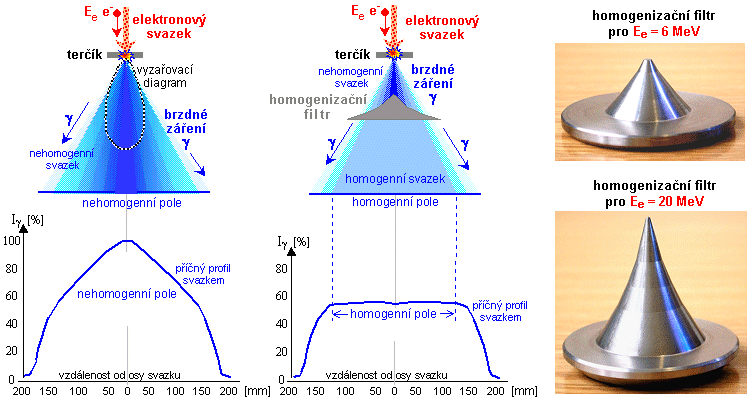
Vlevo: Směrový vyzařovací diagram brzdného
záření z terčíku vede k nehomogenní distribuci intenzity
napříč svazkem. Uprostřed: Dosažení
homogenní distribuce pomocí vhodně tvarovaného
homogenizačního filtru. Vpravo: Ukázka
homogenizačních filtrů pro různé energie.
Pro dosažení homogenní distribuce záření
v celé potřebné šířce svazku se do cesty záření vkládá
homogenizační filtr *) - rotačně symetrický
kovový absorbátor diskovitého uprostřed silně ztluštěného
tvaru (do kužele), který vyšší absorbcí v centrální
části vyrovnává intenzitu záření napříč průřezem
svazku (angl. flattening filter). Čím vyšší je
energie urychlených elektronů Ee, tím silněji je brzdné záření kolimováno ve
směru osy a tím tlustší centrální část homogenizačního
filtru je zapotřebí. Pro nižší energie bývají
homogenizační filtry zhotoveny z hliníku, pro vyšší energie
se používají i těžší kovy (železo, wolfram) a vhodné
slitiny. Homogenizační filtry jsou většinou výměnné a
každý z nich musí být přesně vytvarován v závislosti na
použité energii a též na požadované velikosti pole a na
vzdálenosti, v níž má být dosaženo homogenní intenzity
záření. Vedle homogenizace ozařovacího svazku je dalším
pozitivním faktorem odfiltrování elektronů, kterými bývá
vysokoenergetický fotonový svazek kontaminován. Rovněž
spektrum brzdného záření napříč svazkem není úplně
stejné - v centrální části je podíl tvrdšího záření
poněkud vyšší než v okrajových částech; homogenizační
filtr však tento rozdíl ještě zdůrazňuje.
*) Separátní homogenizační filtr se nepoužívá
u kybernetického gama-nože, kde se ozařuje poměrně
úzkou centrální částí svazku brzdného záření (viz
níže obr.3.6.4c), jejíž homogenitu lze zajistit vhodným
tvarováním materiálu tečíku. Ostatně, u stereotaktické
radioterapie není třeba dosáhnout homogenního ozáření
cílové tkáně. V poslední době se obecně upouští
od homogenizačních filtrů nejen u stereotaktických,
ale i u klasických ozařovačů, neboť nové sofistikované
počítačové plánovací systémy umí přesně naplánovat
dávkovou distribuci pro libovolný průběh dávkového profilu
fotonového svazku (tento průběh se dozimetricky změří a
vloží se do plánovacího systému). Pozn.:
Je však třeba počítat s poněkud vyšší
kontaminací fotonového svazku elektrony.
Kolimace a
monitorování ozařovacího svazku
Svazek brzdného záření je dále kolimován
soustavou pevných tvarovacích clon (primární
clona hned za terčíkem a sekundární clona za homogenizačním
filtrem). Součástí ozařovací hlavice
je i radiační monitorovací systém, který
pomocí ionizačních komůrek indikuje dávkové příkony v
ozařovacím poli *). Nakonec je svazek kolimován
("modulován") do požadovaného výsledného tvaru
systémem pohyblivých clon - nejdokonalejším kolimačním
systémem je tzv. MLC kolimátor (viz níže,
obr.3.6.3). Pro vizuální zaměření a nastavení ozařovaného
pole je v hlavici instalován světelný lokalizační
systém - světlo z žárovečky je optickou projekcí
vedeno přes kolimační systém ozařovače tak, aby bylo
dosaženo shody viditelného světelného pole a pole
radiačního. U moderních izocentrických ozařovačů je
naproti ozařovači v gantry zabudován detektor (zobrazovací
flat-panel, jeho princip je popsán v §3.2, pasáž "Elektronické
zobrazení X-záření"),
umožňující zobrazit svazek záření po průchodu pacientem -
vytvářet tzv. portálové snímky -
"rentgenové" snímky struktur pacienta s použitím
vysokoenergetického ("megavoltového") záření.
Tento portálový zobrazovací systém se označuje zkratkou EPID
(Electronic Portal Image Device). Tento systém též
umožňuje operativně provádět verifikační
dozimetrii "in vivo", na
svazku prošlém skrz pacienta.
*) Radiační dávky a
monitorovací jednotky
Vedle standardních jednotek radiační dávky Gray [Gy]
se, v souvislosti s fantomovým měřením (monitorováním)
radiačních svazků, v praktické radioterapii často
používají i tzv. monitorovací jednotky MU
(Monitor Unit)
- 1 MU =--> 0,01 Gy (1 "centigray").
Monitorovací komora udává dávku 100 MU, když je v izocentru
ozařovače dodána radiační dávka 1 Gy ve vodním fantomu (při
velikosti pole 10x10cm).
Hloubkový
efekt tvrdého fotonového záření
U fotonového záření je radiační dávka způsobena sekundárními
elektrony, vznikajícími fotoefektem, Comptonovým
rozptylem a při vyšších energiích i tvorbou
elektron-pozitronových párů (viz §1.6 "Ionizující
záření", část "Interakce
záření gama a X"). Při
použití vysokoenergetického záření g převažuje Comptonův
rozptyl a sekundární elektrony mají převážně směr
primárního svazku a též vysokou energii; způsobují další
a další ionizaci. Jak tedy vysokoenergetické záření
prochází tkání, zpočátku přibývá počet sekundárních
elektronů a narůstá ionizace. V určité
hloubce se ustaví rovnováha nabitých částic a poté ionizace
začne klesat, jak je svazek fotonů postupně zeslabován
absorpcí v tkáni.
Pro tvrdé fotonové záření proto maximální
radiační dávka není již na povrchu (jak je tomu u měkkého
záření), ale posunuje se poněkud do hloubky
(tzv. build-up efekt - náběh dávky s hloubkou), v
závislosti na energii záření. Hloubky maximální dávky v
tkáni pro různé energie fotonového záření jsou
přibližně: 1MeV...4mm; 5MeV...1cm; 10MeV...2,5cm; 25MeV...5cm.
Tohoto efektu samotného sice nelze použít pro selektivní
hloubkové ozařování z jednoho směru, ale má významný vliv
na šetření kůže a povrchových tkání (skin-sparing
efekt) při izocentrické radioterapii.
Ve větších hloubkách pak již nastává
rovnovážný stav ionizace a dávka D (dávkový
příkon) klesá s hloubkou d podle
standardní exponenciální závislosti D~e-m.d s lineárním
absorbčním koeficientem m(r,Eg) daným hustotou tkáně r a energií záření Eg - čím
vyšší energie, tím pomalejší pokles (je odvozeno v §1.6
"Ionizující záření", část "Absorbce
záření v látkách", obr.1.6.5).
Vysokoenergetické tvrdé záření g *) má tedy
výhodu menší absorbce (a to i v kostech) a tím lepší
"geometrickou" možnost dostat požadovanou dávku
záření selektivně do hlouběji uloženého cílového
místa, při relativně nižší absorbci a radiační
zátěži ostatních tkání, především kůže.
*) Shora je však optimální energie
fotonového záření omezena cca 20MeV, neboť při vyšších
energiích dochází k častým fotojaderným
reakcím (viz §1.6, část "Interakce
záření gama a X"), vlivem
nichž je svazek kontaminován neutrony.
Tyto neutrony se v tkáni rozptylují a způsobují radiační
zátěž i mimo směr původního svazku, tedy i mimo cílový
objem. Obecně je třeba upozornit i na to, že při energiích
vyšších než 10MeV dochází ke g-aktivaci
materiálů ozařovače, které jsou vystaveny svazku záření -
terčík, homogenizační filtry, kolimátory, lehátko a další
součásti jsou slabě radioaktivní i po
skončení expozice! V ozařovaném objemu pacienta též
vznikají krátkodobé radionuklidy (15O, 11C, 13N, ve stopovém množství dále 24Na, 29P, 34Cl, 35S, 38Ca, 38,42,43K), avšak v tak nepatrném množství, že jejich
příspěvek k radiační dávce je zcela zanedbatelný (<10-5%).
Ozařování
elektrony
Pro ozařování povrchových a mělce uložených lézí se
někdy používá i primární elektronový svazek
z urychlovače (energie jednotky MeV, cca 4-12MeV). V
uspořádání podle obr.3.6.1b elektrony z urychlovače nedopadají
na terčík, který je odsunutý (odsunutý
je samozřejmě i homogenizační filtr),
ale jsou vedeny přes kolimující tubus přímo do těla
pacienta. Primární úzký elektronový svazek (průměru cca
3mm) je, místo na terčík, veden na rozptylující fólii k rozptýlení
elektronů na celé ozařovací pole. U některých systémů je
elektronový svazek rozmítán na požadovanou
šířku pomocí elektromagnetických vychylovacích cívek (podobně jako elektronový paprsek v klasické
obrazovce). Ozařování elektrony je
vhodné u ložisek na povrchu nebo v nevelké
hloubce pod povrchem (do cca 5cm), které můžeme ozářit jen z
jednoho přímého směru (pole) a kde v hloubce pod ozařovaným
ložiskem se nacházejí tkáně či orgány, které nesmějí
být ozářeny vyšší dávkou záření. Ve srovnání se
zářením gama je u elektronového svazku prudký pokles dávky
směrem do hloubky tkáně : max. dosah elektronů v tkáni v
centimetrech je přibližně dán 1/2 použité
energie v MeV, střední dosah asi 1/3 této
energie.
Pro vysoké energie elektronů se projevuje
analogický mechanismus "hloubkového build-up
efektu" (srov. níže obr.3.6.5a), který byl výše zmíněn pro tvrdé fotonové
záření: Do určité hloubky absorbovaná dávka poněkud
roste, potom - po ustavení rovnováhy nabitých částic -
začne rychle klesat, jak je elektronový svazek brzděn a
zeslabován interakcí s tkání. Pokud je vysokoenergetickými
elektrony potřeba ozařovat povrchové vrstvy kůže, je
build-up efekt nežádoucí a k jeho potlačení se používají
tkáňově ekvivalentní tzv. bolusy (zmíněné též
níže), které vedou ke zvýšení povrchové dávky a redukci
dávky hloubkové.
"Zviditelnit neviditelné"
- zobrazení radiačních svazků
Ionizující záření používané v radioterapii je naším
zrakem neviditelné, můžeme je registrovat jen
pomocí speciálních metod detekce a spektrometrie
(kap.2 "Detekce
a spektrometrie ionizujícího záření"). Pro lepší názornost by
však bylo vhodné nějak přímo "zviditelnit"
toto záření, resp. jeho interakce s látkou. Jedna z metod
byla popsána v §2.2 - 3-D gelové dozimetry ; je to však způsob poměrně komplikovaný a
náročný, používá se jen velmi zřídka... Jsou další dva
způsoby, jak přímo a snadno "zviditelnit" průchod
ionizujícího záření látkou: Čerenkovovo záření
v opticky průhledném prostředí (i ve vodě) a scintilační záření (nejlépe v kapalném scintilátoru). Tyto metody jsme experimentálně použili u
elektronových a fotonových svazků na našem pracovišti a u protonových svazků na PTC.
.Čerenkovovo
záření
Při průchodu rychlých elektronů - ať již primárních či
sekundárních - látkovým prostředím je emitováno slabé
viditelné tzv. Čerenkovovo záření (§1.6, pasáž "Čerenkovovo záření"). Na následujícím
obrázku je ukázka "zviditelnění" ozařovacího
elektronového a fotonového svazku ve vodě pomocí tohoto
Čerenkovova záření :
 |
Čerenkovovo záření vznikající ve
vodním fantomu při ozařování elektronovými a
fotonovými radiačními svazky.
Vlevo: Válcový fantom (průměru 20cm a výšky 18cm)
naplněný vodou byl ozařován širokým (magneticky
rozmítaným) svazkem elektronů energie 9MeV z
lineárního urychlovače.
Uprostřed:. Rychlé elektrony při
průchodu horní částí fantomu vytvářely
Čerenkovovo záření až do hloubky cca 4,5cm, kdy
energie elektronů poklesla pod prahovou úroveň 260keV.
Vpravo: Při ozařování téhož fantomu
svazkem fotonového záření (max.
energie 6MeV, svazek průměru 4cm) vytvářejí
sekundární elektrony podél g
svazku Čerenkovovo záření - s hloubkovým poklesem
intenzity, jak se primární fotonový svazek zeslabuje
při průchodu vodou (těsně pod povrchem
je ale zpočátku vidět mírný hloubkový nárust
intenzity - build-up efekt do hloubky cca 1cm,
je diskutováno níže v pasáži "Sekundární záření generované při
interakcích X a g").
Pozn.: V horní a dolní části jsou
vidět optické odrazy světla od krytu a ode dna
fantomu. Vzhledem k poměrně slabší intenzitě
záření obrázky obsahují vyšší množství
rušivého šumu...
Poděkování:
Ozařování vodního fantomu na přístrojích TrueBeam
a CyberKnife bylo prováděno ve spolupráci s
kolegy: Ing.L.Knybel, Ing.L.Molenda a Ing.B.Otáhal. |
Zobrazení radiačních
svazků v kapalném scintilátoru
Další možností zobrazení průchodu svazků ionizujícího
záření látkou ve vhodném fantomu je použití kapalného
scintilátoru (o kapalných
scintilátorech a jejich použití pro vnitřní měření
beta-radioaktivních vzorků je pojednáváno v §2.6, části
"Detekce záření
beta kapalnými scintilátory").
Na našem pracovišti jsme použili kapalný
scintilátor (velmi nekonvenčním
způsobem) pro mapování a vizualizaci
ozařovacích svazků - elektronových, fotonových,
protonových - používaných v radioterapii. Skleněný
odměrný válec o průměru 6cm a výšce 44cm
jsme naplnili 1 litrem kapalného scintilátoru (použili jsme dioxanový scintilátor o
hustotě 0,95 g/ml) a postavili jej pod
ozařovací hlavici příslušného ozařovače - elektronového Varian,
fotonového CyberKnife, protonového IBA. Z
boku jsme pozorovali a fotografovali
scintilační záření, vznikající ve scintilitátoru podél
průchodu ozařovacího svazku :
 |
Obr.... Scintilační záření
vznikající ve válci (průměru 6 cm a
výšky 44 cm) naplněném kapalným
scintilátorem při ozařování elektronovými,
fotonovými a protonovými radiačními svazky.
a),b): Válcový fantom
naplněný kapalným scintilátorem byl ozařován
širokým svazkem elektronů energie 6 MeV a 18 MeV z
lineárního urychlovače.
c),d): Při ozařování téhož fantomu
svazkem fotonového záření - max.
energie 6MeV, svazek průměru1,5 cm a 3,5 cm - vytvářejí
sekundární elektrony podél g
svazku scintilační záření - s hloubkovým poklesem
intenzity, jak se primární fotonový svazek zeslabuje
při průchodu kapalinou.
Poděkování: Ozařování scintilačního
fantomu na přístrojích TrueBeam a CyberKnife
bylo prováděno ve spolupráci s kolegy: Ing.L.Knybel,
Ing.L.Molenda a Ing.B.Otáhal.
e),f),g): Při
ozařování úzkými ("pencil
beam") protonovými svazky energie 100,
170 a 226 MeV pronikají protony do různých hloubek v
závislosti na energii, s výrazným Braggovýn maximem.
Poděkování:
Ozařování protonovými svazky z cyklotronu IBA bylo
prováděno ve spolupráci s kolegy: Ing.P.Máca, Ing.M.Andrlík, Mgr.L.Zámečník,Ph.D., Ing.M.Navrátil,Ph.D. (a konzultace s kolegy
Ing.V.Vondráček a prim.MUDr. J.Kubeš,Ph.D.) z protonového centra PTC v Praze. |
Analýza a diskuse
obrázku:
¨ Při
ozáření širokým elektronovým svazkem
energie 6MeV (a) je ve
scintilátoru vidět jasná modře zářící stopa do hloubky
cca 26mm, kde se elektrony již zabrzdí.
¨ Elektrony
energie 18MeV (b) pokračují
až do hloubky cca 78mm, za scintilačního vyzařování. Při
interakci těchto vysokoenergetických elektronů s atomy
scintilátoru však vzniká i intenzívní fotonové brzdné
záření, které je pronikavé a pokračuje dále do
hloubky.
Úhlové rozdělení vysílaných fotonů
brzdného záření závisí na energii primárních nabitých
částic. Při nízkých energiích je brzdné záření
vyzařováno prakticky izotropně do všech směrů od místa
interakce. Se vzrůstající energií elektronů budících
brzdné záření je střední úhel emitovaných kvant stále
menší - při vysokých energiích dopadajících nabitých
částic je brzdné záření přednostně vysíláno v úzkém
kuželu "vpřed" ve směru dopadu
primárních částic. Směrový vyzařovací diagram
vysokoenergetického brzdného záření má tvar ostrého
"laloku" ve směru primárního svazku.
Kromě jasného scintilačního obrazu elektronů v horní
části tedy ještě pozorujeme slabší úzký paprsek
brzdného záření, pokračující až ke dnu fantomu.
¨ Při
ozařování fotonovým svazkem z CyberKnife
(úzkým a širokým - c,d) se spojitým
spektrem o max. energii 6MeV vidíme výraznou
scintilační stopu ze sekundárnách elektronů přes celý
válec - fotonový paprsek proniká do hloubky
až ke dnu (a sahal by ještě hlouběji), s mírným hloubkovým poklesem intenzity, jak se
fotony postupně absorbují při průchodu kapalinou.
Je zajímavé porovnat tyto obrázky s
výše uvedeným zobrazením těchže ozařovacích svazků
pomocí Čerenkovova záření ve vodním fantomu .
¨ Při
ozařování protonovými svazky (e,f,g)
vidíme výraznou scintilační stopu, která se s hloubkou zesiluje
a končí jasným Braggovým maximem; do
větší hloubky již záření nepokračuje.
Hloubka Braggova maxima se zvětšuje s energií protonů.
Modré "halo"
kolem protonového svazku je způsobeno sekundárními elektrony
vyráženými z látky při průchodu protonů. Při nižší
energii protonů je toto "halo" širší - elektrony
jsou méně kolimovány do směru primárního paprsku; projevuje
se to zvláště ke konci dráhy kolem Braggova píku, kde jsou
protony již značně zpomaleny.
Ozařovací
pole
Z geometrického hlediska může být záření pro radioterapii
rozděleno do jedné či několika oblastí o určitých tvarech
a intenzitách a z různých směrů - tzv. ozařovacích polí.
U povrchových lézí stačí zpravidla jedno ozařovací pole
měkčího fotonového záření (či elektronů), u lézí
uložených v hloubce se používá většího počtu vhodně
tvarovaných ozařovacích polí (sbíhavá
či protilehlá pole, "křížový oheň" čtyř polí
a řada dalších kombinací). Pro
formování tvaru svazku záření (a tím i isodosních křivek) se
často používají různé absorbční filtry, clony,
klíny (obr.3.6.1b') či speciální kolimátory (viz níže), pro ovlivnění
energetického spektra záření se používají
vhodné filtry. Pro kompenzaci nepravidelného
tvaru povrchu, či úpravu dávky na povrchu a v hloubce, se
někdy používá tzv. kompenzační bolus (řec. bolos = hrouda,chuchvalec,kus) - vhodně tvarovaný tkáňově-ekvivalentní materiál
určité tloušťky, který se přikládá do vhodného místa na
kůži, nebo se vkládá mimo povrch do ozařovacího svazku.
Pozn.:
Poddrobnější popis ozařovacích technik tohoto druhu leží
mimo rámec našeho fyzikálního pojednání. Z fyzikálního
hlediska nejsou příliš zajímavé a navíc jsou postupně
stále více vytlačovány pokročilejšími a přesnějšími
technikami IMRT a IGRT - viz níže "Modulace
ozařovacích svazků".
Nejdokonalejší hloubková ozařovací technika
je izocentrické ozařování
vysokoenergetickým zářením s vhodným tvarováním a modulací
ozařovacího svazku - IMRT, s příp.
zobrazovací navigací IGRT - a stereotaktické
ozařování úzkými ostře kolimovanými svazky
záření (s radiační navigací); nejsložitější je pak hadronová
radioterapie. Tyto metody jsou postupně popisovány
níže.
Izocentrická
radioterapie
Hlavního strategického cíle radioterapie - účinného selektivního
ozáření nádorového ložiska při co nejmenším
poškození okolních tkání - je zde dosahováno tím, že
nádorové ložislo se ozařuje kolimovaným svazkem z více
směrů *) tak, aby průsečík svazků,
tj. ohnisko čili izocentrum,
kde se dávky sčítají, bylo lokalizováno do místa tumoru -
obr.3.6.1a. Okolní zdravé tkáně pak dostávají přiměřeně
nižší dávku, rozdělenou na větší oblast.
Zjednodušeně lze říci, že zdravá tkáň (její jednotlivá
místa) je ozářena jen jednou, zatímco nádor pokaždé.
*) Ozařovač je pro tento účel upevněn
na speciálním kruhovém stojanu, tzv. gantry
(angl. gantry = portál, průchozí nosná konstrukce),
umožňujícím pomocí elektromotorků řízenou rotaci
zdroje záření kolem pacienta.
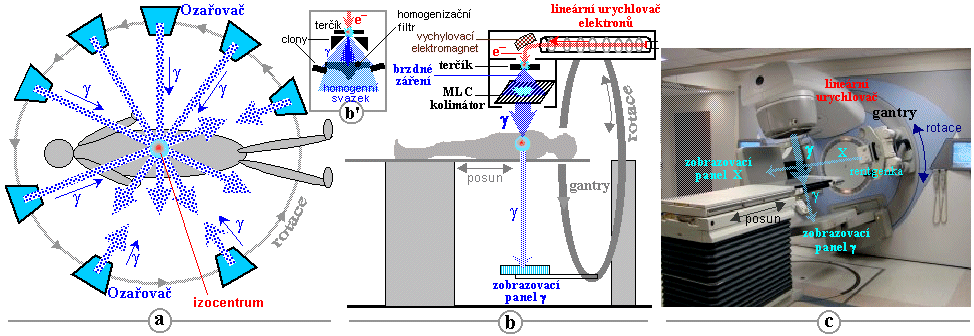
Obr.3.6.1. Pohybová izocentrická radioterapie
kolimovaným svazkem záření gama.
a) Základní ideové schéma ozařování
rotujícím ozařovačem. b) Uspořádání
ozařovače s lineárním urychlovačem. c)
Příklad moderního ozařovače IGRT.
Kolimovaná
pole a svazky záření pro radioterapii
Z obecně fyzikálního hlediska byly vlastnosti
ionizujícího záření popsány v §1.6 "Ionizující
záření" (pole a svazky záření
pak byly zmíněny v části "Pole a svazek záření, intenzita záření"). Primární záření z
urychlovače (elektronové záření, popř. protonové záření
pro hadronovou terapii) vylétá zpravidla přesně definovaným
směrem, v úzkém svazku (který se pak příp. dále upravuje,
filtruje a tvaruje). Záření g (a popř. X), vznikající
v radionuklidech (cesiu či kobaltu), nebo buzené jako
sekundární brzdné záření po dopadu primárního
elektronového svazku z urychlovače na terčík (obr.3.6.1b), je
však emitováno prakticky do všech směrů (vysokoenergetické brzdné záření má v centrálním
směru pouze vyšší intenzitu, což se koriguje
homogenizačním filtrem). Pro vznik
ozařovacího svazku pro cílenou (tele)radioterapii je třeba
naprostou většinu tohoto difuzního záření odstínit
a propustit jen záření v požadovaném směru - provést kolimaci
záření. Nejjednodušší kolimace je zhruba
znázorněna již na obr.3.6.1a - kolimátor tvaru tubusu.
Pro přesné tvarování ozařovacího svazku se používají
složitější kolimační systémy, z nichž nejdokonalejší
jsou elektronicky tvarovatelné MLC kolimátory
popsané níže ("Modulace
ozařovacích svazků").
Ve střední části (homogenizovaného) svazku
záření vymezeném kolimátorem je přibližně homogenní
distribuce intenzity. U okrajů neklesá intenzita náhle k nule,
jak by vyplývalo z idealizované geometrické konfigurace, ale
snižuje se plynule. Absolutně ostré kolimace totiž v praxi
nelze dosáhnout ze dvou důvodů:
- Geometrické
rozmazání v důsledku nenulové velikosti primárního zdroje (projevuje se zvláště u radioisotopových zdrojů).
- U
pronikavého vysokoenergetického záření g dochází v okrajových
hranách kolimátoru k částečnému prozařování.
V okrajových částech kolimovaného svazku tak vzniká jakýsi
"polostín". Vedle tohoto geometrického
polostínu se uplatňuje i rozptyl
svazku záření v tkáni (tento rozptyl je výrazný zejména u
elektronového svazku). Při vyšších energiích je fotonový
svazek v tkáni ostřejší, je zde menší rozptylový
polostín. Tyto dva efekty - geometrický a
rozptylový - vytvářejí v dávkové distribuci v tkáni
výsledný dávkový polostín v
okrajových částech svazku záření, s nímž je třeba
počítat při plánování radioterapie, může výrazně
ovlivňovat isodosní křivky.
Technická
poznámka: Ozařovací svazky jsou na obrázcích
3.6.1 a 3.6.2d pro jednoduchost znázorněny čarami (šipkami)
konstantní šířky. Ve skutečnosti však ozařovací svazky
mají rozbíhavou geometrii - se vzdáleností
od zdroje záření se rozšiřují.
Plánování radioterapie
Kombinace fyzikálních a biologických faktorů ve většině
případů umožňují dostatečně účinné a selektivní
ozáření patologického ložiska. V klinické radioterapii
vlastnímu ozařování pacienta vždy předchází velmi
důležitý a náročný proces plánování radioterapie,
jehož výsledkem je tzv. ozařovací plán,
obsahující všechny konkrétní detaily ozařovacího procesu
pro daného pacienta. Správně vytvořený ozařovací plán je
základním předpokladem úspěšné radioterapie.
Hlavním podkladem pro tvorbu ozařovacího plánu jsou
podrobné diagnostické snímky ozařované
oblasti. V současné době se jedná především o rentgenové
snímky tomografické (CT), příp.
o zobrazení nukleární magnetickou rezonancí
(MRI) a scintigrafií, zvláště pozitronovou
emisní tomografií (PET). Tyto
snímky slouží jednak pro přesnou lokalizaci
nádorového ložiska spolu se stanovením jeho velikosti a
tvaru, jednak jako podrobná anatomicko-denzitní mapa
rozložení hustot tkání a umístění orgánů.
Simulátor
radioterapie
Při exaktním plánování radioterapie se používá tzv. simulátor
- přístroj, který napodobuje celý proces ozařování a
umožňuje jeho optimalizaci. Klasický simulátor je
diagnostický rentgenový přístroj se
zesilovačem obrazu, jehož rentgenka je upevněna na otočném
izocentrickém rameni a je vybavena systémem nastavitelných
clon, umožňujících napodobení svazku záření takového,
jaký se pak bude používat na vlastním terapeutickém
ozařovači. Simulátor umožňuje lokalizaci cílového
objemu a topometrii nádorových ložisek, zaměřování
svazku paprsků a modelování geometrie polí
a ozařovacích parametrů, zakreslení orientačních a referenčních
bodů a markerů na těle pacienta.
Místo klasického simulátoru se pro pokročilé
ozařovací technologie (IMRT, IGRT) nyní často používá tzv.
virtuální simulátor - rtg zobrazovací
přístroj CT vybavený zaměřovacím systémem
a speciálním softwarem pro dávkové plánování. Plánovací
software nejdříve zkonvertuje Hounsfieldovy jednotky obrazu CT
na elektronovou denzitu jednotlivých tkání.
Dále se na obrazech vyznačí cílové objemy a
rizikové kritické orgány. Pak se obrazy
překryjí charakteristikou svazků záření (energie,
distribuce dávky - isodosní křivky). Vyznačené struktury se
pak zobrazují v transformovaném režimu BEV (Beam’s
Eye View) - z pohledu svazku
záření. Při konvenčním plánování se pak na
těchto překrytých obrazech hledají nejvýhodnější
ozařovací podmínky pro dopravení požadované dávky do
cílového objemu. Nastavuje se počet ozařovacích polí a
jejich tvar, dávkový příkon, úhly a další parametry pro
optimalizaci ozařovacího plánu. Tzv. inverzní
plánování bude zmíněno níže v souvislosti s technikou
IMRT a IGRT.
Obrazy z CT vyšetření jsou tak přímo zahrnuty
do plánování terapie - 3D-plánování, na něž navazuje tzv.
3D konformní radioterapie (3D CRT), nebo ještě dokonalejší
terapie s modulovanými svazky IMRT-IGRT. Přenos dat z CT, přes
plánovací počítač do počítače řídícího ozařovač,
poskytuje možnost tvarování ozařovacích polí
na základě přesné prostorové znalosti vnitřní anatomie v
okolí cílové tkáně daného pacienta; svazky záření jsou
tak přizpůsobeny cílovému objemu a ochraně okolních
rizikových kritických tkání.
Z těchto údajů
a z požadované dávky záření v cílové tkáni
(tato dávka závisí na druhu nádoru - na jeho radiosenzitivitě),
jakož i maximální toleranční dávky v okolních rizikových
kritických orgánech, se vypočítá intenzita, energie a
geometrické parametry svazku záření, včetně přesného
nastavení ozařovacích pozicí a úhlů. Dále se stanoví frakcionování
dávky. Celý proces plánování a následné radioterapie je
nyní již do značné míry automatizován za
použití počítačového softwaru, který pracuje v několika
základních etapách (obr.3.6.2):
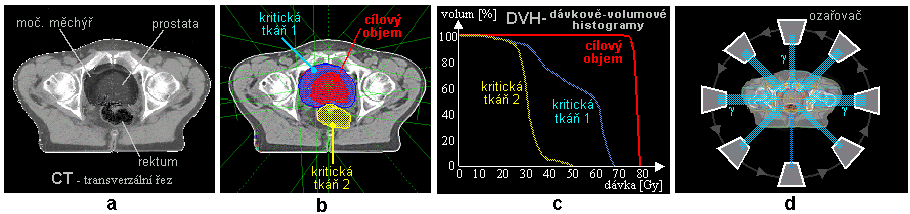
Obr.3.6.2. Některé základní etapy počítačového
plánování radioterapie.
a) Diagnostický rtg (CT) obraz ozařované
oblasti. b) Vykreslení zájmových oblastí
cílového objemu a rizikových kritických tkání, zvolení
ozařovacího postupu, počtu a tvarů svazků a intenzit
záření (polí). c) Optimalizace ozařovacího
plánu pomocí dávkově-objemových histogramů DVH. d)
Řízení funkce a pohybů ozařovače výsledným ozařovacím
předpisem.
l Analýza
diagnostických dat, volba strategie léčby -
kurativní či paliativní terapie, kombinace s chirurgií a
chemoterapií, lokalizace cílového objemu nádorového
ložiska.
l Zpracování
výchozích rtg obrazů z CT (obr.3.6.2a). Hustota
tkání (vyjádřená na CT v Hounstfieldových jednotkách) se
převádí na elektronovou denzitu. To
zohledňuje nehomogenitu tkání (různou elektronovou denzitu
měkkých tkání, vody, vzduchu, kostí) při průchodu a
interakci ozařovacího svazku. Elektronové hustotě látky je
přímo úměrný lineární přenos energie LET
(velikost ztráty energie na jednotku dráhy) a tím i lokální
ionizace v tkáni a absorbce záření - distribuce
radiační dávky. Pro zpřesnění ozařovacího plánu
je vhodné zohlednit i gamagrafické obrazy PET (např. metodou
počítačové fúze obrazů CT+PET), které mapují viabilitu
nádorové tkáně - bylo rozebíráno výše v části "Diagnostika
nádorových onemocnění".
l
Zakreslení oblastí zájmu ROI
(region of interest) do obrazu - především cílového
objemu nádorového ložiska, dále pak rizikových kritických
tkání a orgánů (obr.3.6.2b). Tyto oblasti zájmu se
kreslí v jednotlivých transverzálních řezech, program si je
spojí (s použitím interpolace) do trojrozměrného
objemu. Při kreslení ROI lze využívat i kolmé řezy
frontální a sagitální.
Cílové
ozařovací objemy
Cílovým ozařovacím objemem (Target Volume) rozumíme
oblast tkáně příslušné lokalizace a velikosti (objemu), do
níž je třeba zacílit požadovanou kanceroletální dávku.
Pro úspěšnou kurativní radioterapii je
zapotřebí aplikovat letální dávku záření nejen do
vlastního objemu makroskopicky zjištěného nádorového
ložiska, ale i do některých sousedních oblastí - do tzv. bezpečnostních
lemů (margin), snižujících riziko
nedostatečného ozáření struktur, které by mohly být
nádorově postiženy a následně způsobit recidivu
onemocnění. V souvislosti s tím máme v radioterapii tři nebo
čtyři na sebe navazující cílové objemy:
¨ Základní cílový objem GTV
(Gross Tumor Volume) představuje vlastní objem
makroskopicky zjištěného nádorového ložiska, zobrazený
pomocí příslušného zobrazení (většinou CT). K tomuto
výchozímu, základnímu či hrubému objemu se pak přidávají
některé další sousední oblasti - lem - margin.
¨ Klinický cílový objem CTV
Pro bezpečné zajištění lokální kontroly
ozařované léze je zapotřebí aplikovat letální dávku
záření nejen do vlastního objemu makroskopicky zjištěného
nádorového ložiska GTV, ale i do těch sousedních oblastí, v
nichž by podle klinických zkušeností již mohl být skrytý
mikroskopický rozsev nádorových buněk. Ozařovaný cílový
objem GTV proto zvětšujeme o klinický bezpečnostní
lem - vzniká tzv. klinický cílový objem CTV
(Clinical Target Volume). Je analogický bezpečnostnímu
lemu při chirurgickém odstraňování viditelných nádorů.
¨
Vnitřní cílový objem ITV
V důsledu vnitřních fyziologických změn polohy cílového
objemu uvnitř organismu (např. vlivem dýchání *,
variabilního naplnění měchýře a střev, peristaltiky,
polykání, pulzace srdce) je potřeba další rozšíření na vnitřní
cílový objem ITV (Internal Target
Volume), který zahrnuje veškerou dráhu vnitřního pohybu
cílové tkáně.
*) Tracking tumoru
Pokročilé metody stereotaktické radioterapie používají tzv.
tracking tumoru - sledování pohybu nádoru v
důsledku dýchání, jeho zohlednění a korekce, což
umožňuje zmenšit ITV a tím minimalizovat
ozáření okolní zdravé tkáně, příp. eskalovat dávku do
nádorového ložiska. O těchto "trackovacích"
metodách respiratory gating či respiratory
synchronization je pojednáno níže v části "Stereotaktická
radioterapie".
¨
Výsledný plánovaný cílový
objem PTV
Vzhledem k očekávané reprodukovatelnosti polohy pacienta a
ozařovače při frakcionovaném ozařování bývá někdy
potřeba dále rozšířit cílový objem o tzv. polohový
lem. Vzniká tím výsledný plánovaný cílový
objem PTV (Planning Target Volume), který se
zakresluje do ozařovacího plánu. PTV zahrnuje CTV a
rozšiřující lem pro pohyb orgánů a tkání ITV, jakož i
pro očekávané nepřesnosti nastavení ozáření. Výsledný
PTV je tedy sjednocením (vnější obálkou)
všech dílčích cílových objemů: PTV = GTV
Č CTV Č
ITV Č [polohový
lem].
l
Zadání požadované dávky záření v
cílové tkáni a maximální přípustné dávky v kritických
tkáních. Toto je založeno převážně na empirické
zkušenosti, z níž vyplývají koeficienty a,b radiosenzitivity
daného typu nádorové tkáně a tolerančních dávek pro
zdravé kritické tkáně (bylo
diskutováno výše v části "Fyzikální a radiobiologické faktory", pasáž "Predikce terapeutického efektu").
l
Zvolení základního způsobu ozařování
- počet a geometrická konfigurace ozařovacích polí, energie
a intenzita svazku - její příp. modulace, počet frakcí.
l
Výpočet distribuce lokální dávky v
takto zmapované tkáni - konstruují se tzv. isodosní
křivky (náznakově jsou vidět
na obr.3.6.2d). Svazek
záření v praxi není nikdy homogenní, stejně jako absorbce
záření v tkáni, takže prostorová distribuce intenzity
záření a radiační dávky má většinou složitý průběh (nejvyšší dávka bývá v centrální části svazku,
směrem k okrajům klesá). Prostorové
rozložení radiační dávky se často mapuje pomocí tzv. isodosních
křivek - myšlených čar, představujících spojnice
bodů se stejnou dávkou. Většinou se zakreslují isodosní
křivky pro určitá procenta z místa s maximální dávkou,
např. isodosy 80%, 50%, 20% a pod. (připomíná
to vrstevnice na mapě).
l
Optimalizace ozařovacího plánu. Pro
tento účel se často konstruují objemové histogramy dávky,
tzv. DVH - Dose Volume Histogram
(obr.3.2.6c). Tyto histogramy poskytují znázornění 3-D
dávkové distribuce pomocí přehledného 2-D zobrazení
křivkami. Každá vyznačená zájmová oblast má svou křivku
DVH. Na vodorovné ose je dávka (v Gy nebo v % max. dávky), na
svislé ose je objem (v % objemu vyznačené struktury). DVH
znázorňují dávkovou expozici cílového objemu (PTV) a
jednotlivých vyznačených rizikových kritických orgánů
(NT).
Dávkově-volumové
histogramy DVH
Dávkově-volumové histogramy udávají,
jaká část objemu cílové nebo kritické tkáně obdrží
určitou dávku. Z hlediska základní strategie radioterapie je
žádoucí, aby co největší objem cílové (nádorové)
tkáně PTV obdržel co nejvyšší procento požadované dávky
(ideálně 100%). A zároveň co nejmenší objem rizikoví
kritické zdravé tkáně NT obdržel co nejnižší část
dávky. Tato dávková expozice cílového objemu a vyznačených
kritických orgánů je přehledně znázorněna na
dávkově-objemovém histogramu DVH.
Optimalizace radioterapie zde spočívá v optimalizaci
ploch pod křivkami DVH - co největší plocha pod
křivkou cílového objemu PTV a co nejmenší plocha pod
histogramy rizikových kritických orgánů NT (podíly ploch
NT/PTV pod křivkami DVH představují relativní
"parciální objemy" ozářených tkání NT).
Při podrobnější analýze můžeme
optimalizaci radioterapie ještě zdokonalit převedením hodnot
dávky a dávkové distribuce ze standardního DVH na veličiny BED,
nebo na TCP + NTCP a z nich
odvozené UTCP (tyto veličiny byly definovány
a diskutovány výše v části "Fyzikální a
radiobiologické faktory v radioterapii", pasáž "Predikce radioterapeutického efektu - TCP, NTCP").
l
Přenesení dat do souřadnicového systému
ozařovače.
l
Vytvoření ozařovacího předpisu, podle
nějž se pak při vlastním ozařování řídí funkce
a pohyby ozařovače (symbolicky na obr.3.6.2d) -
především úhlové pozice ozařovače, časy expozice,
geometrie svazku záření pomocí modulace kolimátorem MLC.
Současné plánovací výpočetní systémy jsou
schopné realizovat i tzv. inverzní plánování
(viz níže), při kterém plánovací systém vypočítá
parametry a pohyby ozařovače tak, aby bylo dosaženo primárně
požadované dávkové distribuce v cílovém objemu (ložisku) a
nebyly překročeny toleranční dávky v okolních tkáních.
Dozimetrie a verifikace v
radioterapii
Pro zajištění potřebné přesnosti radioterapie jsou dále
zapotřebí verifikační metody,
zajišťující dodání správných terapeutických radiačních
dávek do cílových lézí a tolerančních dávek do
rizikových kritických tkání a orgánů, s ohledem na příp.
změny jejich polohy, anatomického tvaru a velikosti při
různých frakcích ozařování.
Pro dozimetrickou verifikaci se
používají nejčastěji ionizační komůrky nebo diodové
detektory. Tyto detekční elementy mohou být jednotlivé (s
mechanickým posunem), v lineárním nebo dvojrozměrném
maticovém uspořádání, popř. ve válcové struktuře pro
měření izocentrického ozařování. Umisťují se do
ozařovacího svazku buď přímo ("do vzduchu") pro
mapování intenzity svazku, nebo se vkládají do vhodných
vodních či plastových fantomů,
modelujících typické anatomické struktury pro ozařování.
Monitorování dávky se provádí též "in vivo",
přímo při ozařování pacienta, na jehož tělo se do
příslušných míst přikládají dozimetry. Elegantní metodou
verifikace a zároveň dozimetrie in
vivo je využití obrazů z portálového
flat-panelu ozařovače (princip
flat-panelu je popsán v §3.2, pasáž "Elektronické zobrazení X-záření"), jejich kvantifikace a
kalibrace - tzv. portálová dozimetrie EPID (Electronic
Portal Image Dosimetry).
Ojediněle se používají i systémy 3-D gelové
dozimetrie, umožňující stanovit prostorovou
distribuci dávky v ozařovaném objemu (gel je naplněn ve
fantomu modelujícím ozařovanou strukturu). Tato metoda je
poměrně náročná jak ve stádiu vytvoření fantomu, tak i z
hlediska vyhodnocení (podrobnější popis je v §2.1, pasáž
"3-D gelové dozimetry"), používá se jen pro výzkumné a vývojové
práce.
Pro kvantitativní posouzení souhlasu
ozařovacích plánů a distribucí dávek se někdy používá
tzv. gama-analýza, jejíž výstupní parametr g-index (0<gŁ1) je tím
bližší 1, čím je souhlas lepší.
U moderních ozařovacích systémů je
ozařovací a verifikační technologie integrována
do jednoho ozařovacího přístroje. Vysoké nároky jsou
kladeny na přesnost a reprodukovatelnost
geometrické polohy pacienta vůči svazku
záření - aby ozařovaný cílový objem byl přesně nastaven
v souřadnicovém systému ozařovače. Používají se pro to
různé značky (markery) zakreslené či umístěné na povrchu
těla a laserové zaměřovače. Naproti
ozařovači jsou v gantry zabudovány detektory (zobrazovací
flat-panely) umožňující při prozařování vytvořit tzv. portálové
snímky; ještě dokonalejší je rtg systém con-beam
CT. Tyto metody radioterapie řízené obrazem IGRT
jsou popsány níže v následující kapitole "Modulace
zobrazovacích svazků".
U klasické stereotaktické radioterapie
intrakraniálních lézí se pro přesné zaměření cílového
ložiska používá stereotaktický rám, u
kybernetických ozařovačů speciální stereoskopické rtg
zobrazovací a zaměřovací systémy - viz níže část
"Stereotaktická
radioterapie. Gama - nůž.".
Pro správnou souhru celého tohoto složitého
"technologického řetězce" je zapotřebí spolupráce
zkušeného radiologického fyzika.
Nejistoty v radioterapii
Každá fyzikální nebo technická, diagnostická i
terapeutická metoda je zatížena většími či menšími
nepřesnostmi, chybami, neurčitostmi.. Přirozeně i během
složitého řetězce radioterapie se setkáváme s řadou
nejistot. "Vstupními" primárními nejistotami jsou :
¨ Lokalizace a rozsah onemocnění,
jehož nejistota je dána přesností a citlivostí
diagnostických metod, příp. může být ovlivněna artefakty
zobrazovacích metod, nepřesností nastavení pacienta, jeho
pohyby celkovými i pohyby orgánů uvnitř těla.
¨ Radiobiologické faktory -
radiosenzitivitu nádorových i zdravých tkání (parametry a,b v LQ modelu,
rychlost buněčné reparace a repopulace) známe jen
přibližně a paušálně, může se individuálně značně
lišit. Vede to k nejistotám v základním předpisu radiační
dávky a její frakcionaci.
Během procesu plánování a realizace radioterapie na to pak
navazují další nejistoty:
¨ Nepřesnosti ve vykreslování ROI -
vymezování cílových objemů a rizikových kritických
struktur na plánovacích obrazech. Tento proces je velmi
závislý na zkušenostech příslušného odborníka
¨ Nejistoty v ozařovací technologii -
přesnost a stabilita energie a intenzity primárního
ozařovacího svazku, nejistoty v monitorovacím systému,
přesnost kolimačního systému, geometrického nastavení
vzdáleností a izocenter, přesnost přenesení parametrů
ozařovacího plánu do řídícího systému ozařovače.
¨ Nepřesnosti a rušivé vlivy během vlastního
ozařování pacenta - variabilita v polohovém
nastavování pacientů pod ozařovačem, fixace a pohyb
pacienta, pohyb tkání a orgánů uvnitř pacienta během
ozařování.
Nové poznatky v oblasti radiobiologie spolu s
pokrokem v oblasti diagnostických metod a technickým
zdokonalováním ozařovacích technologií, především jejich
integrace se zobrazovacími modalitami, umožňují postupně
zmenšovat či eliminovat tyto četné nejistoty. Zvyšuje se
tím radiobiologická, dozimetrická, geometrická i celková
přesnost radioterapie.
Modulace ozařovacích svazků
Radioterapie s modulovanou intenzitou svazku - IMRT
Pro uskutečnění dostatečně intenzívního a homogenního
ozáření nádoru a šetření okolních tkání je třeba tvarovat
svazek záření tak, aby se dosáhlo maximálního
ozáření cílového objemu o dané geometrii (velikosti a
tvaru) a dávka v okolí byla přiměřeně nižší, okolní
tkáně a orgány byly proti záření vycloněny (odstíněny).
Za tímto účelem se do svazků záření vkládají vhodně
tvarované filtry (vykrývací bloky různých
tvarů) a clony či kolimárory
vymezující velikost pole. To se dříve provádělo ručně pro
každé ozařovací pole a bylo to velmi pracné (pracoviště byla vybavena mechanickou dílnou, kde se
vykrývací bloky odlévaly, řezaly a opracovávaly). S technickým vývojem se proto přikročilo k
vytvoření univerzálnějších mechanicky pohyblivých clon.
Rozdělením těchto clon na samostatně pohyblivé segmenty byl
zkonstruován velmi flexibilní mnoholamelový kolimátor
MLC (Multi Leaf Collimator - mnoholistový
kolimátor), nasazený na výstup fotonového svazku brzdného
záření z urychlovače - obr.3.6.3.
Vynález
multi-leaf kolimátoru MLC, implikující zavedení
ozařování s modulovanou intenzitou svazku IMRT,
znamenal významnou revoluci v radioterapii :
umožnil vysoce precizní cíleně směrované
ozařování nádorových lézí různých tvarů a velikostí, s
maximálním šetřením okolních zdravých tkání a
rizikových kritických orgánů. A to relaticně snadným a
reprodukovatelným způsobem, bez pracného zhotovování
nestandardních pomůcek.
Kolimátory
MLC mají větší počet lamel (cca 60-120 listů) tloušťky
5-10cm, které se pomocí elektromotorků mohou nezávisle
posunovat. Tím je možno pro svazek záření vytvořit
otvor libovolného tvaru, popř. několik
otvorů rozdělujících svazek do několika částí. Okraje
lamel bývají vhodně tvarovány, aby kopírovaly rozbíhavý
ozařovací svazek pro omezení "polostínu". Celý
kolimátor se dále může otáčet. Elektromotorky
pohánějící lamely jsou počítačově řízeny - MLC
kolimátor je elektronicky tvarovatelný.
Ozáření
se provádí z několika směrů, přičemž se během ozáření
pomocí elektromotorků mění pozice jednotlivých lamel
kolimátoru - dochází k modulaci intenzity
napříč svazkem záření a tím i k regulaci dávky
v jednotlivých částech ozařovaného objemu. Svazek záření
je jakoby rozložen na jednotlivé paprsky s různou intenzitou.
Kombinací více takto modulovaných polí z různých směrů se
dosahuje optimálnějšího rozložení dávky, selektivního
ozáření cílové tkáně při lepším šetření okolních
tkání a rizikových kritických orgánů (které se vycloní
vhodným tvarováním MLC). Umožňuje se tak ozářit i
nepravidelné nádory při maximálním šetřením zdravých
tkání i v okolí nádoru. Metoda se označuje zkratkou IMRT
(Intensity Modulated Radio Therapy) - radioterapie
s řízenou (modulovanou) intenzitou svazku. Zajišťuje
to konstrukce speciálních kolimátorů MLC, které upravují - tvarují,
modulují - svazek záření při výstupu z ozařovače
(lineárního urychlovače). Modulace dávkové intenzity se
dosahuje pomocí superpozice překrývajících se radiačních
polí při rotaci ozařovače s různými pozicemi lamel MLC.
Okraje lamel projekčně "kopírují" tvar
ozařovaného cílového objemu, propouštějí intenzívní
svazek do nádorového ložiska a odstiňují okolní tkáně a
kritické orgány.
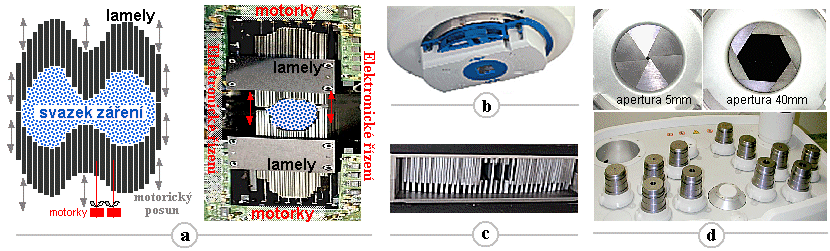 |
Obr.3.6.3. Elektronicky regulovatelné
kolimátory pro precizní radioterapii s modulovaným
svazkem IMRT.
a) Mnoholamelový kolimátor MLC pomocí
motoricky posunovaných stínících lamel umožňuje
flexibilně tvarovat (modulovat) svazek záření z
urychlovače pro radioterapii s modulovaným svazkem
IMRT. b) Mikro-MLC (mMLC) -
miniaturizovaný MLC jako nástavec ke standardní
ozařovací hlavici s MLC, pro terapii úzkými ostře
kolimovanými svazky. c) Binární
(bipolární) MLC pro tomoterapii. d)
Iris-kolimátor s elektronicky (motoricky) regulovanou
velikostí otvoru - aperturou - může nahradit celou
sadu pevných kolimátorů s kruhovými otvory různých
průměrů u kybernetického gama-nože. |
Z hlediska časového řízení může modulace ozařovacího
svazku IMRT probíhat ve dvou režimech :
l Přerušovaný
režim (step-and-shoot), kdy lamely kolimátoru
jsou v pohybu jen v přestávkách mezi ozařováním. Kolimátor
MLC vytvaruje požadovaný otvor, přes nějž se provede
ozáření. Pak se ozařování přeruší, lamely se přesunou
do další pozice (popř. se kolimátor pootočí), změní se
úhel na gantry a proběhne další dávka ozáření. Je to v
podstatě zdokonalená technika většího počtu statických
polí.
l Kontinuální
režim (dynamický, sliding windows - klouzavě
posuvné okénko) - lamely kolimátoru se plynule pohybují,
přemisťují a modulují svazek do požadovaného tvaru během
ozařování. Pohyb lamel kolimátoru v synchronizaci s
otáčením kolimátoru a celého ozařovače na gantry je
elektronicky řízen pomocí příslušného softwaru. Podle
ozařovacího plánu tak při otáčení ozařovače na gantry
(postupně až o 360°) se mění dávkový příkon a je
ozařováno modulovaným svazkem. Tento způsob se někdy
označuje jako Intensity Modulated Arc Therapy (IMAT)
- intenzitně modulovaná úhlová radioterapie.
Další zdokonalení tohoto
systému se označuje jako AMCBT (Arc-Modulated Cone
Beam Therapy) - úhlově modulovaná terapie
kuželovými svazky, nebo VMAT
(Volumetric Modulated Arc Therapy) - objemově modulovaná
oblouková terapie, či RapidArc. Obsahuje
ozařovací svazek řízeně modulovaný MLC-kolimátorem a
řízenou rotaci ozařovače kolem pacienta. U některých
systémů je průběžně modulována i primární intenzita
svazku pomocí regulace toku elektronů v lineárním
ozařovači. Je možný rovněž řízený posun lehátka, rotace
kolimátoru s pacientem a natáčení gantry ozařovače.
Technika VMAT tedy
umožňuje dynamickou změnu některých
parametrů v průběhu ozařování: - Gantry se může pohybovat
s proměnlivou rychlostí; - poloha jednotlivých lamel MLC
kolimátoru je měnitelná v průběhu rotace; - Kolimátor se
může natáčet. Dávka a geometrie svazku je tak plynule
modulovatelná v průběhu rotace ozařovače na gantra.
Díky dalšímu, úhlově-intenzitnímu
stupni volnosti (je k dispozici větší počet
jemně nastavitelných úhlů ozařovacího paprsku s
individuálně nastaveným tvarem a intenzitou svazku) se
dosahuje dalšího zlepšení selektivity radiační dávky
dopravené do cílové tkáně a též zkrácení
ozařovacího času. Modulací dávkového příkonu v
průběhu ozařování jsou lépe chráněny zdravé tkáně a
rizikové kritické orgány, dochází ke snížení
celotělové dávky.
Vedle standardního kolimátoru MLC se používají jeho dvě
modifikace :
Mikro-MLC (mMLC) - miniaturizovaný
mnoholamelový kolimátor pro ozařování úzkými ostře
kolimovanými svazky při tzv. stereotaktické
radioterapii (viz níže). Používá se většinou jako
nástavec upevněný na standardní ozařovací hlavici s MLC pro
radioterapii s modulovaným svazkem IMRT (obr.3.6.3b).
Binární či bipolární MLC
(Binary MLC) tvaru štěrbiny s větším počtem (64) lineárně
řazených lamel, které se otvírají a zavírají, čímž
modulují svazek v rovině transverzálního řezu (obr.3.6.3c).
Používá se při tzv. tomoterapii (viz níže,
obr.3.6.4a). Lamely u binárních MLC se pohánějí
elektromagneticky nebo pneumaticky, čímž se dosahuje velmi
rychlé odezvy otvírání a zavírání lamel (desetiny
sekundy).
Metoda intenzitně
modulované radioterapie, analogická IMRT, se v poslední době
zavádí i u protonové radioterapie - tzv. IMPT
(Intensity Modulated Proton Radiotherapy), viz níže
"Hadronová
radioterapie".
Radioterapie
řízená (navigovaná) obrazem - IGRT
Vysoký potenciál přesnosti, flexibilnosti a
konformity technologie IMRT (jakož i gama-nože,
viz níže) může být efektivně využit jen v koprodukci s
velmi precizní metodou verifikace zacílení
ozařovacího svazku na cílový objem. Takovouto verifikaci
cílového objemu lze provést pomocí zobrazení
oblasti ozařované léze a okolních struktur před každým
ozářením či frakcí, s následným počítačovým
srovnáním s výchozími plánovacími obrazy, vyhodnocením a
přenesením výsledků do souřadnicového systému ozařovače.
V takovém případě se jedná o on-line řízení -
navigaci - obrazem. Podle aktuálních snímků, které
se získají bezprostředně před každým jednotlivým
ozářením, se může podle potřeby upravit poloha pacienta a
zacílení nádorového ložiska. Tím se dosahuje přesného
nastavení, které se každý den léčby patřičným
způsobem aktualizuje. Teprve poté, co je poloha pacienta takto
ověřena, je spouštěno vlastní ozáření.
Takto doplněná a
zdokonalená ozařovací technologie se označuje jako IGRT
(Image-Guided Radiation Therapy) - radioterapie
řízená (navigovaná) obrazem
*), kontrolující pozici pacienta (cílového objemu a okolních
struktur) během léčebného procesu pomocí radiologických
zobrazovacích metod. Kombinuje ozařovací techniku
IMRT se zobrazovací verifikační technikou (obr.3.6.1b,c).
Umožňuje zobrazení cílového objemu a okolních struktur
pomocí zobrazovacího zařízení, spojeného s ozařovačem.
Jednodušší metodou je výše zmíněné portálové
zobrazení (dolní flat-panel na obr.3.6.1b,c), které
dobře zobrazí kostní struktury, avšak často neposkytuje
dostatečný kontrast pro zobrazení měkkých tkání včetně
samotné léze.
*) IGRT se někdy v užším
smyslu považuje jen za verifikační metodu;
avšak viz níže pasáž "Hybridní integrace
zobrazovacích a ozařovacích technologií".
Pro kvalitní zobrazení
může být ozařovač dále vybaven přídavným RTG
zobrazovacím systémem (nazývaným někdy In Room
CT - CT v místnosti ozařovny, Synergy,
či OBI - On-Board Imager System -
zobrazovací systém namontovaný přímo na ozařovači),
který se využívá pro přesnou kontrolu polohy pacienta a
cílové tkáně před ozařováním; může být provedeno před
každou ozařovací frakcí. Zobrazovací systém OBI je
namontován na gantry ozařovače (lineárního urychlovače)
kolmo k centrální ose ozařovače. Zobrazovací RTG systém se
otáčí spolu s gantry a je umístěn tak, aby měl stejné
izocentrum jako vysokoenergetický paprsek ozařovače. Před
ozářením se na ozařovači provede rentgenové
planární nebo CT zobrazení s široce
kolimovaným kónickým svazkem X-záření (cone-beam CT),
který prozařuje pacienta a dopadá na protilehlý zobrazovací flat-panel
(jeho princip je popsán v §3.2, pasáž "Elektronické
zobrazení X-záření").
Rentgenka i detektor rotují kolem pacienta na společném gantry
ozařovače. Vzniklé aktuální obrazy se
srovnají s referenčními obrazy - výchozími
CT nebo planárními snímky ze simulátoru a v případě
potřeby se provede příslušná korekce polohy,
či modifikace tvaru svazku kolimátorem MLC, při větších
rozdílech i změna v ozařovacím plánu, jeho reoptimalizace.
Umožňuje to eliminaci chyb v polohování pacienta mezi
jednotlivými ozařovacími frakcemi, příp. i změn polohy a
velikosti cílové tkáně a okolních anatomických poměrů v
průběhu radioterapie. Rtg zobrazení tak poskytuje aktuální
obrazy struktur a orgánů před ozařovací procedurou
a na jejich základě se řízenou IMRT optimalizuje
přesnost radioterapie. Nové systémy umožňují verifikaci
nejen mezi jednotlivými frakcemi, ale i intrafrakční
CT zobrazení v během rotace ozařovače s IMRT.
Velmi přesná lokalizace
nádoru a okolních struktur pomáhá zlepšit
terapeutický poměr - ozářit dostatečně vysokou
dávkou nádorové ložisko a do značné míry eliminovat
škodlivý radiobiologický účinek na okolní zdravé tkáně a
orgány. K IGRT lze v principu použít i ultrazvukové
zobrazení, avšak rozpoznávání struktur na těchto
obrazech je obtížnější a v teleterapii se prakticky
nepoužívá. Ultrazvuková navigace se používá u některých
metod brachyterapie, jak
je níže popsáno a znázorněno na obr.3.6.7 vpravo.
Perspektivní metodou IGRT je navigace pomocí nukleární magnetické
rezonance MRI - kombinace LINAC+MRI
(popsaná níže v pasáži "Hybridní
integrace zobrazovacích a ozařovacích technologií"),
která poskytuje lepší zobrazení struktur zvláště měkkých
tkání.
Verifikační metoda IGRT
se nejčastěji používá ve spojení s ozařovači s
modulovaným svazkem IMRT podle obr.3.6.1b,c *), jedná se tedy o
IMRT+IGRT. Na navigaci obrazem IGRT jsou dále
založeny vysoce precizní metody tomoterapie a stereotaktické
radioterapie gama-nožem, Leksellovým a
zvláště kybernetickým, popsané níže. IGRT může být
doplněna i systémem korekce na dýchací pohyb,
tzv. Respiratory Motion Technology či Real-Time
Position Management (RPM), umožňujícím
sledování změny polohy cílového objemu v závislosti na
dýchacím cyklu pacienta - toho se využívá pro selektivní
ozáření cílového objemu pouze ve zvolené části
dýchacího cyklu, tzv. respiratory gating, popř. při
synchronizaci pohybů ozařovače s dýchacím cyklem (respiratory
synchronization). Všechny tyto postupy se nyní integrují
do systému DART (Dynamic Adaptive
Radiotherapy), který umožňuje vyhodnocovat výsledky
získané při IGRT a na jejich základě operativně
adaptovat parametry ozařovací procedury tak, aby
distribuce dávky byla optimální.
*) Ojediněle se používala integrace CT s
lineárním ozařovačem v provedení CT-on-Rails
(CT na kolejnicích). V ozařovně je spolu s vlastním
ozařovačem instalován CT skener, namontovaný na kolejnicích.
V poloze na opačném konci místnosti se může používat pro
základní CT zobrazování. Po kolejnicích se pak CT skener
může přemístit do polohy radioterapeutické, kde se
kontrolují odchylky cílového objemu a dalších struktur v
porovnání s plánovacími snímky, s následnou korekcí polohy
pacienta. Tento systém se opět začal používat u některých
nových systémů hadronové radioterapie pomocí jader
uhlíku-12 (viz níže "Hadronová radioterapie"), kde na velice robustní a komplikované gantry
je problematické namontovat On-Board zobrazovací
systém.
Adaptivní
radioterapie řízená obrazem IGRT - "denním"
CT nebo MRI - se provádí dvěma on-line postupy reoptimalizace
ozařovacího plánu :
-->
Přizpůsobení polohy (ATP) při které se
přizpůsobení plánu provádí podle nové aktuální
pozice pacienta pod ozařovačem. Aktualizuje se poloha
izocentra a na takto upravený plán lze použít původní
kontury (ROI).
-->
Přizpůsobení tvaru (ATS) na základě nové
anatomie struktur cílové tkáně a okolních orgánů.
Reoptimalizace ozařovacího plánu se provádí změnou tvaru a
velikosti ROI (buď automaticky, nebo je upraví radiační
onkolog). ....
Biologicky
řízená radioterapie - BGRT
Do ozařovacího procesu se čím dál více zahrnují
anatomické i funkčně-biologické multimodalitní zobrazovací
metody, spolu s modelováním molekulárně-buněčné radiační
odezvy tumoru a zdravé tkáně (molekulární zobrazení,
monitorování radioterapeutického efektu včetně rané detekce
apoptózy, bylo diskutováno výše v části "Diagnostika nádorových onemocnění").
Souhrn těchto přístupů umožňuje postupně dosáhnout
"biologicky řízené" radioterapie BGRT
(Biologically Guided Radiation Therapy), přizpůsobené
individuálním podmínkám, specifickým pro daného pacienta a
tkáň - radioterapie řízená (navigovaná)
molekulárním zobrazením.
Do této oblasti patří
především níže rozebíraná biologicky cílená radioisotopová terapie otevřenými zářiči, kde se
rozvíjí komplexní teranostický přístup
diskutovaný v §4.9, pasáž "Kombinace diagnostiky a terapie -
teranostika".
Hybridní integrace zobrazovacích a
ozařovacích technologií
Přesnost lokalizace anatomických struktur při
zobrazení CT a NMRI, jakož i zacílení izocentra v
ozařovačích, je již velmi vysoká, cca 1 milimetr. Využití
této přesnosti pro reálné zacílení dávky do požadovaného
ložiska však může bránit variabilita polohy
pacienta a pohyblivost orgánů uvnitř, jakož
i změny jejich velikostí a anatomických proporcí (viz níže
"Konformní radioterapie"). Je proto
žádoucí průběžně on-line monitorovat
polohu pacienta a vnitřních anatomických struktur pomocí
zobrazovacího systému přímo na ozařovači. Vznikají tak
obrazy orgánů a anatomických struktur v souřadnicovém
systému ozařovače, na které může modulovaný ozařovací
svazek ve zpětné vazbě reagovat modifikací a korekcí
ozařovacích podmínek tak, aby bylo dosaženo přesně
požadované distribuce dávky v cílovém objemu a okolních
tkáních. Radioterapie řízená obrazem (IGRT) a tomoterapie
tedy vyžaduje sloučení zobrazovacího a
ozařovacího přístroje do jediného hybridního
systému - obr.3.6.1c a obr.3.6.4a,c. Před každým
ozářením lze pak pořídit "denní snímky"
cílové tkáně a okolí, podle nichž je možno provést
příp. korekci polohy, operativní aktualizaci ozařovacího
předpisu, či korekci ozařovacího plánu.
V systémech IGRT je
hybridní kombinace [LINAC+CT] již standardní.
Ve stádiu vývoje jsou hybridní kombinace ozařovače se
zobrazovacím systémem nukleární magnetické rezonance
NMRI (princip NMRI byl popsán výše - "Nukleární magnetická rezonance"). Od
této kombinace se očekává lepší zobrazení struktur
(cílového tumoru i okolních tkání a rizikových kritických
orgánů) - zvláště měkkých tkání - na NMRI, s jehož
pomocí by bylo možné provést dokonalejší přizpůsobení a
zacílení radiační dávky z ozařovače. Jedná se tedy o
dvoumodalitní technologii MR-IGRT. Byl již
vyzkoušen systém [60Co+NMRI]
- dva nebo tři kobaltové ozařovače (opatřené MLC
kolimátory) kombinované se současným zobrazením magnetickou
rezonancí. U velmi žádoucí kombinace [LINAC+NMRI]
je zatím značným technickým problémem vzájemné negativní
ovlivňování obou modalit - ovlivňování činnosti
lineárního urychlovače silným magnetickým polem
supravodivého elektromagnetu NMRI a rušení zobrazení NMRI
silnými elektromagnetickými signály vznikajícími při
činnosti urychlovače.
Radiační dávku v tkáni - požadovanou i nežádoucí -
způsobují rychlé sekundární elektrony, generované v tkáni
interakcí primárního fotonového (X,g)
záření. V silném magnetickém poli budou mít tyto rychlé
ekektrony své dráhy odkloněné od původního směru -
působí na ně Lorentzova síla ve směru kolmo k pohybu a kolmo
k příčnému magnetickému poli. To může pozměnit výsledný
radiační účinek ozařovacího paprsku. V hutných a
homogenních tkáních je tento vliv relativně malý (elektrony se v tkáni rychle brzdí na krátké dráze),
avšak na rozhraních mezi látkami s různou hustotou se mohou
projevit. Zvláště na rozhraních vzduch-tkáň může
docházet k výrazným změnám v dávkové distribuci - vzniká
zde tzv. efekt návratu elektronů. Rychlé elektrony,
které již na rozhraní opustily tkáň, se ve vzduchu již
nebrzdí, spirálovitě se ohnou v magnetickém poli a mohou se
navrátit zpět do tkáně; na rozhraní tím dochází ke
zvýšení dávky.
Bylo experimentálně
postaveno několik konstrukčních řešení kombinace LINAC/MRI
s různým tvarováním elektromagnetů, kolmou či podélnou
orientací magnetického pole a ozařovacího paprsku, různých
poloh či otáčení pacienta. Tyto prototypy byly většinou
značně komplikované, pro klinickou praxi suboptimální a
nedosáhly plnohodnotného on-line spojení ozařovače s MRI
navigací. Nakonec se jako nejschůdnější řešení ukázalo
to principiálně nejjednodušší: z vnější
strany supravodivého solenoidu umístit další prstencové
gantry, pomocí něhož by rotoval LINAC (s terčíkem), který
by směrem dovnitř ozařoval pacienta ležícího uvnitř tunelu
MRI :
 |
Zjednodušené schéma hybridní
kombinace lineárního urychlovače (LINAC) se
zobrazovací magnetickou rezonancí (MRI) - IGRT s
navigací nukleární magnetickou rezonancí.
(Pozn.: LINAC je zde jen jeden, v obrázku jsou
nakresleny dva pouze pro ilustraci různé polohy při
rotaci gantry) |
Speciálními metodami aktivního magnetického a
elektromagnetického stínění lze minimalizovat vzájemné
rušení a obě modality mohou pracovat nezávisle a
simultánně. Ostatní vlivy (jako jsou změny
dávkové distribuce vlivem magnetického pole) lze
korigovat softwarově a zahrnout je do ozařovacího plánu.
Podařilo se tak realizovat funkční hybridní kombinaci
LINAC/MRI. Byly vyvinuty dva typy přístrojů tohoto
druhu, které se začaly klinicky používat :
-
MRIdian od výrobce ViewRay Technologies
(MRI 0,35 T + Linac 6 MeV), dokončený v r.2014 (dříve
tento výrobce dodával výše zmíněný 60Co+MRI, později nahradil kobalt lineárním
urychlovačem).
- MR-Linac Unity,
který byl v letech 2012-18 vyvinut ve spolupráci výrobců
Electa (vyrobila Linac 7 MeV) a Philips
(MRI 1,5 T).
Navigace adaptivní
radioterapie magnetickou rezonanci MRI je nesporně velmi
zajímavá metoda jak z fyzikálního, tak z klinického
hlediska. Oprávněně se předpokládá (přinejmenším
hypoteticky...), že může výrazně přispět ke zpřesnění
a lepší úspěšnosti radioterapie zvláště v situacích složité
anatomie měkkých tkání, kdy ozařovaná nádorová
tkáň těsně sousedí s rizikovými kritickými tkáněmi a
orgány. A navíc se tyto anatomické struktury během procesu
radioterapie často vzájemně pohybují, mění tvar a
velikost. Tyto měkké tkáně - cílové i okolní zdravé -
bývá obtížné zobrazit pomocí obvyklé cone-beam
CT navigace na ozařovači. Na obrazech MRI jsou však
zobrazeny s výborným kontrastem a lze je době
zaměřit a konturovat i bez použití fiduciálních markerů.
Je to především u nádorů pankreatu, prostaty, rekta, ...
Obecně však, MRI navigace radioterapie je drahá, pracná a
časově náročná. A spektrum vhodných diagnóz je
poměrně úzké. Je třeba posoudit, v jakých případech je
tento čas a úsilí oprávněné a potřebné. Zatím jsou jen
omezené důkazy o její faktické lepší účinnosti a
nadřazenosti..?..
Pro primární nádorovou
diagnostiku je velmi vhodná scintigrafická metoda pozitronové
emisní tomografie PET (viz kap.4
"Scintigrafie", část "Kamery PET"),
především s využitím radiofarmaka 18FDG.
Zobrazuje se metabolická buněčná aktivita tkání. Tato
metoda je však vhodná i pro monitorování odezvy
nádorové tkáně na radioterapii, neboť se pomocí ní
zobrazuje metabolicky aktivní nádorová tkáň, na rozdíl od
buněk inaktivovaných. Je m.j. schopna rozpoznat recidivu
nádoru od jiných procesů (např. od následků dřívější
léčby nádoru). Toto sledování úspěšnosti radioterapie lze
provádět off-line, avšak je možná i hybridní kombinace [LINAC
+ PET] radioterapeutického ozařovače se zobrazením
PET.
Další zajímavou hybridní
kombinací, která se v budoucnu může realizovat, je kombinace
[hadronový 12C-ozařovač
+ PET], kde distribuce dávky ze svazků urychlených
uhlíkových jader je monitorována prstencově uspořádaými
detektory kamery pozitronové emisní tomografie (PET),
zobrazující anihilační fotony vznikající v oblasti Braggova
maxima z pozitronů b+-radioaktivního
11C - viz níže "Hadronová radioterapie",
pasáž "Radioterapie těžšími ionty",
obr.3.6.6. A ve vzdálenější budoucnosti možná hybridní
kombinace [antiprotonový ozařovač + PET], kde
kamera PET namontovaná na gantry antiprotonového ozařovače by
mohla monitorovat distribuci dávky v tkáni pomocí detekce
anihilačního záření z pozitronů, vznikajících
sekundárně při interakcích antiprotonů v tkáni (viz níže
"Antiprotonová radioterapie")..?..
Konformní, adaptivní
radioterapie, inverzní plánování
Všechny tyto postupně se rozvíjející
metody vedou k lepší selektivitě ozáření -
vyšší dávce v cílové tkáni a snížení dávky na
okolní zdravé tkáně. Umožňují lepší distribuci dávky v
cílovém objemu - tzv. konformní radioterapii
(conform = přizpůsobit), označované též jako třídimenzionální
konformní radioterapie (3DCRT). Při této
technice je trojrozměrně definovaný cílový objem selektivně
a homogenně ozářen požadovanou vysokou radiační dávkou,
která mimo cílový objem prudce klesá, takže okolní zdravé
tkáně jsou ozářeny podstatně nižší dávkou. Velikost a
tvar ozařované oblasti je přizpůsoben i nepravidelnému
objemu nádorového ložiska. Distribuce dávky může být
přizpůsobena pro nádorová ložiska různých tvarů, včetně
situace, kdy nádorové ložisko těsně sousedí, popř.
částečně obklopuje, rizikové kritické orgány a tkáně.
IMRT používá většího počtu ozařovacích polí pod
různými úhly, které se přizpůsobují tvaru ložiska a
"kopírují" jeho obrys. Modulace ozařovacího svazku
umožňuje částečně vykrýt určité části
cílového objemu, které interferují s kritickým orgánem, na
nějž může tumor naléhat (či jej částečně obklopovat).
Radiační dávka v cílové tkáni je přitom kompenzována
silnějším ozářením z dalších polí. Výsledně lze tak
dosáhnout dostatečné a téměř homogenní ozáření
nádorového ložiska při výrazném šetření sousedících
kritických orgánů (isodosní křivky mohou být konkávně
"zakřiveny" kolem rizikového kritického orgánu).
Tohoto výsledku je v IMRT přitom dosahováno nehomogenním
dopravením dílčích radiačních dávek do ložiska,
přizpůsobeném nepravidelnému tvaru nádoru a anatomické
situaci v okolí.
Konformní techniky radioterapie
umožňují díky zmenšení dávky v kritických orgánech selektivně
zvýšit (eskalovat) aplikované dávky záření v
cílové tkáni. Souhrn těchto metod IMRT+IGRT se též někdy
nazývá adaptivní radioterapie (ART) -
ozařování je přizpůsobeno každému
pacientovi individuálně, mění se s konkrétními
anatomickými poměry, a to i v čase u téhož pacienta *).
Operativní průběžné provádění IGRT zahrnuje kromě tří
rozměrů prostorového zobrazení i faktor
časový - označuje se někdy jako 4D-radioterapie.
*) Ozařovaný pacient totiž není
nehybný a neměnný objekt! Dochází v něm k řadě
dějů, které mohou poněkud změnit vnitřní anatomické
proporce pacienta. Probíhají dýchací pohyby, střevní
peristaltika, změny objemů tkání v důsledku dynamiky
onemocnění a vlivem vlastní terapie. Mohou tím vznikat
rozdíly v uložení cílových objemů až o jednotky
centimetrů. To může mít výrazný vliv na přesnost
selektivní radioterapie; bez korekce na tyto skutečnosti by se
při ozařování cílová léze mohla částečně
"minout" a ozářit se místo ní zdravá tkáň..!.
Korekce na dýchací
pohyby
je důležitá zvláště při ozařování nádorů v plících
a oblasti hrudníku. Jsou v zásadě dvě modifikace metody pro
eliminaci rušivého vlivu dýchacích pohybů na ozařování:
- Respiratory gating, kdy se ozařovací
svazek vypíná a zapíná tak, aby ozařování probíhalo jen
ve vybrané definované fázi dýchacího cyklu (např. v
expiriu).
- Tumor tracking, kdy snímané
dýchací pohyby se přes počítač elektronicky přenášejí
na řídící systém ozařovače, který "posunuje"
paprsek v rytmu dechu tak, aby stále směřoval do cílového
ložiska.
Vlastní monitorování dýchacích pohybů se děje pomocí
elektronického nebo optického čidla uchyceného na hrudníku
ozařovaného pacienta.
Uvedený komplexní
způsob plánování radioterapie, kdy výchozím požadavkem je
distribuce radiační dávky a počítačový plánovací systém
určí optimální tvary, intenzity a ozařovací doby
jednotlivých modulovaných ozařovacích polí, se někdy
označuje jako "inverzní plánování":
Inverzní plánování
Název "inverzní" pochází z toho, že některé
etapy jsou zde "obráceny" ve srovnání s
dřívějšími konvenčními plánovacími postupy (konvenční plánování se někdy označuje jako
"dopředné" - forward). Nejprve se
přesně vyznačí cílové objemy a struktury rizikových
kritických tkání a orgánů na jednotlivých řezech CT. Po
zadání požadované dávky do cílové tkáně a maximálně
přípustné dávky pro okolní zdravé tkáně a kritické
orgány vzniká 3D-model dávky. Plánovací
systém potom navrhne počet a tvar ozařovacích polí,
dávkové příkony, časy, úhly ozařovače na gantry; to se
při konvenčním plánování dělalo ručně. Každé dílčí
radiační pole (z daného úhlu) se virtuálně rozloží na
jednotlivé plošné elementy - pixely, jejichž
distribuce se řídí polohami lamel mnohalistového kolimátoru
MLC; tato distribuce je počítačově optimalizována tak, aby
prostorová distribuce dávky odpovídala požadovaným
hodnotám. Důležitou výstupní součástí počítačového
ozařovacího plánu jsou tedy údaje o pozici lamel a natočení
MLC kolimátoru. Všechny tyto údaje jsou přeneseny do
ozařovacího počítače, který podle nich elektronicky
řídí veškeré pohyby gantry, lamel kolimátoru,
výkon urychlovače a další ozařovací parametry. Přívlastek
"inverzní" se v budoucnu stane pravděpodobně zbytečným,
protože žádný jiný druh plánování nebude existovat...
Vedle vysoké pořizovací ceny (i
vyšších provozních nákladů) určitou nevýhodou
všech těchto pokročilých radioterapeutických metod je
větší časová náročnost ozařovacího
procesu a poněkud vyšší celotělová dávka
záření (i mimo přímo ozařovanou oblast), vznikající v
důsledku častějšího diagnostického a
monitorovacího prozařování.
Paradoxní poznámka:
Přesné ozáření vymezeného nádorového ložiska s rychlým
poklesem radiační dávky do okolí je jistě velice žádoucí
a vede k lepšímu šetření zdravých okolních tkání. Na
druhé straně může mít někdy paradoxně i určitou
nevýhodu: v případě mikrorozsevu nádorových buněk do
okolí vymezené léze může dojít po skončení radioterapie k
recidivě onemocnění snadněji, než u dřívějších metod,
kde bylo poměrně silně ozářeno i okolí cílového objemu.
Je proto potřeba věnovat zvýšenou pozornost vymezení
dostatečné oblasti lemu kolem vlastního zobrazeného ložiska
a jeho začlenění do cílového objemu.
Tomoterapie
Speciální moderní variantou IGRT-radioterapie navigované
pomocí CT snímků je tzv. tomoradioterapie. Předpona "tomo" vyjadřuje
skutečnost, že ozařování probíhá postupně v řadě
úzkých tranzverzálních řezů kolmých k
podélné ose pacienta, vymezených paprskem z obíhajícího
urychlovače (obr.3.6.4a). Diagnostická zobrazovací a
terapeutická ozařovací technologie je zde integrována
do jednoho systému. CT zobrazení poskytuje aktuální
obrazy cílové tkáně a okolních struktur před
každou ozařovací procedurou ("daily CT") a
na jejich základě se řízenou modulací intenzity svazku optimalizuje
poloha a přesnost radoioterapie.
Byla realizována zajímavá varianta tomoterapeutického
přístroje, používající tentýž lineární urychlovač jako
zdroj záření pro zobrazování i pro terapeutické
ozařování :
¨ CT zobrazení
je realizováno jako transmisní g-CT,
kde místo rentgenky je lineární urychlovač s
terčíkem, produkujícím v režinu "low dose"
(se sníženou energií a hlavně s mnohonásobně nižší
intenzitou svazku) fotonové záření
("megavoltové X-záření") vějířovitě kolimované
("Cone Beam"), které prozařuje
pacienta a je v protilehlém směru registrováno soustavou
detektorů (uspořádaných do kružnicové výseče,
nejčastěji je to multipixelová jednořadá xenonová
ionizační komora) podobně jako u klasického CT. Stejně jako
u CT diagnostiky, spolu s rotací urychlovače a detektorů se posouvá
i lehátko s pacientem (helikální či spirální
skenování), s následnou rekonstrukcí denzitních obrazů.
¨ Tentýž
lineární urychlovač po přepnutí do výkonového
"high dose" režimu (bez
použití homogenizačního filtru) rotuje kolem pacienta
a ozařuje cílovou tkáň, lokalizovanou v
předchozím diagnostickém CT kroku. Toto ozařování přitom
může probíhat s modulovaným svazkem za
použití kolimátoru MLC *): pro různé úhly může být
intenzita g-svazku větší či
menší (popř. záření zcela vypnuto), či svazek vhodně
tvarován tak, aby se dávka záření vyhýbala rizikovým
kritickým tkáním. Stejně jako v předchozím kroku, spolu s
rotací urychlovače a detektorů se řízeně posouvá i
lehátko s pacientem - je prováděna helikální či spirální
tomoterapie. Modulace dávkové intenzity se dosahuje
superpozicí při rotaci ozařovače s různými pozicemi lamel
binárního MLC, modulace v podélném směru pak
prostřednictvím superpozice při překryvu jednotlivých
řezů.
*) Jelikož tomoterapeutické ozařování
probíhá jen v úzkém paprsku rotujícím v rovině kolmé k
ose translace, stačí ozařovací svazek intenzitně modulovat
jen v jednom směru (rovině). Používá se zde proto
speciální poněkud jednodušší mnoholamelový kolimátor MLC,
zvaný někdy binární (bipolární) MLC,
který má ale rychlejší odezvu otvírání a zavírání lamel
(obr.3.6.3c). Typicky se skládá z 64 lamel s pneumatickým
mechanismem pohonu.
Během výkonového ozařování zatím
musejí být detektory CT vypnuty či odsunuty, neboť vysoký
tok záření by je zahltil a mohl je i poškodit (v dalším
vývoji se očekává, že detektory budou zapnuty i během
ozařování a budou moci průběžně modulovat intenzitu svazku
ve zpětné vazbě). Tento elegantní, přesný a vysoce
integrovaný systém se někdy označuje jako "HI-ART"
("Highly Integrated Adaptive Radiation Therapy")
- "vysoce integrovaná adaptivní radiační terapie".
První prototyp
tomoterapeutického ozařovače (Corvus system)
zkonstruovali v r.1993 M.Carol (Nomos Corp.), T.R.Mackie,
P.Reckwerdt a spol. (Univ. of Wisconsin). Pro další vývoj a
výrobu těchto zařízení byla v r.2002 založena firma Tomotherapy
Inc. se sídlem v Madisonu, Wisconsin, USA, která tyto systémy
komerčně dodává.
Tomoterapie s 60Co
Jako zdroj fotonového záření pro tomoterapii lze v
principu použít i radionuklidový zářič 60-kobalt (g 1173+1322 keV), jako náhradu za LINAC (jak bylo diskutováno výše v části "Vnější
ozařování zářením gama, X a elektrony - teleradioterapie", dávková distribuce pro g-záření 60Co je velice podobná
jako pro LINAC 4 či 6MeV). Klasický kobaltový
ozařovač se vybaví binárním multi-leaf kolimátorem a
protilehlým zobrazovacím detektorem (flat-panelem). Může
fungovat ve stejném uspořádání jako na obr.3.6.4a, nebo s
použitím dvou či tří zdrojů 60Co
- jeden pro zobrazení flat-panelem ("daily CT"),
další pro vlastní tomoterapii. Takové systémy se však
používají jen zcela ojediněle, neboť od radionuklidových
zdrojů v teleradioterapii se všeobecně ustupuje (zatím s
výjimkou Leksellova gama-nože).
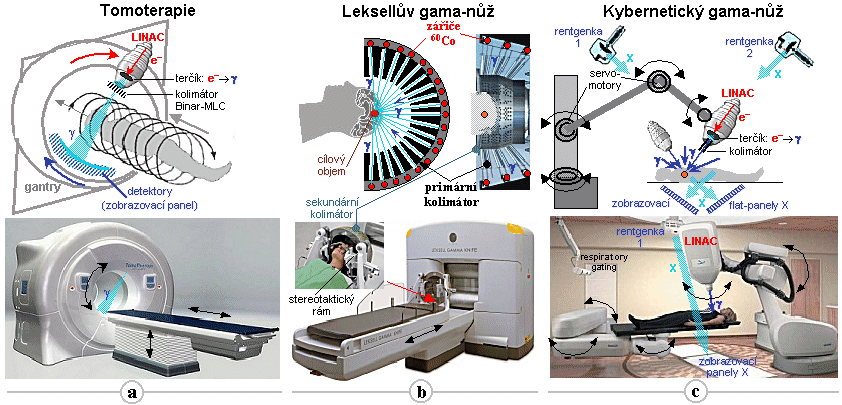
Obr.3.6.4. Některé speciální ozařovací techniky gama
(nahoře princip, dole přístroj). a)
Tomoterapie. b) Leksellův gama-nůž. c)
Kybernetický gama-nůž.
Stereotaktická
radioterapie - SBRT. Gama - nůž.
Stereotaktická radioterapie SBRT (Stereotactic
Body Radio Therapy) je velmi přesné
vysokodávkové ozáření malého cílového objemu, zpravidla
větším počtem cíleně nasměrovaných tenkých paprsků
intenzívního ionizujícího záření, se strmým
úbytkem radiační dávky mimo cílový objem (někdy se hovoří o "zónovém efektu"). Každý jednotlivý paprsek je relativně slabý a na
své cestě tkání nevyvolává výraznější radiobiologické
účinky. Avšak pokud jsou tyto paprsky nasměrovány do společného
ohniska - cílové tkáně, jejich sečtením zde
vzniká vysoká účinná dávka schopná poškodit a inaktivovat
nádorové buňky. Mimo ohnisko dávka záření prudce klesá,
takže již ve vzdálenosti několika milimetrů od ohniska
odpovídá dávka již prakticky dávce z jednoho paprsku.
Pomocí tzv. stereotaktického zaměření se
přesně prostorově vymezí cílový objem přenesením
diagnostického obrazu do 3-rozměrného souřadnicového
systému (bez přímé vizuální kontroly). Na základě
souřadnic, jež lokalizují dané místo, je možno dosáhnout
vysoce selektivního ozáření i malého cílového ložiska
vysokou dávkou záření, při relativně nízkém poškození
okolních tkání. Pro tuto svou vysokou přesnost se metoda
někdy označuje jako stereotaktická radiochirurgie SRS (sterotactic
radiosurgery) *) - umožňuje jednorázové ablační
ozáření vysokou dávkou, která likviduje danou lézi
(nádorovou nebo malformační). Tato metoda je vhodná tam, kde
klasická operace je obtížná nebo neřešitelná (např.
jemné struktury v mozku). Toto cílené ozáření
"gama-nožem" pak může nahradit klasický operační
zásah - bez operačního zatížení a chirurgických
komplikací (krvácení, infekce). Vysoká přesnost (1-2mm)
umožňuje efektivní léčbu i malých nádorů v blízkosti
důležitých center či v oblastech se složitou anatomickou
strukturou. Ozáření se provádí většinou jednorázově,
nebo s malým počtem frakcí (2-3).
*) Ostatně, tato metoda je používána
nejen pro nádorovou terapii, ale i pro "radiochirurgické"
odstranění vaskulárních malformací nebo neuro-patologických
(např. epileptických) ohnisek v mozku - jednorázové
fokální intrakraniální ozáření. Stereotaktická
radiochirurgie je neinvazivní alternativou "krvavého"
chirurgického zákroku.
Terminologická poznámka: Termín stereotaxe
vznikl spojením slov: stereo=prostorový a taxe=zásah
na správném místě (lat. tactio=dotek,hmat).
Používá se i pro přesné chirurgické zákroky.
Při klasické
radioterapii se používají standarní jednotlivé
dávky cca 2Gy aplikované ve 20-40 frakcích, radiobiologickým
mechanismem je buněčná apoptóza s cílem reprodukční
sterilizace klonogenních nádorových buněk;
výsledný účinek je popsán LQ modelem. U stereotaktické
radioterapie se do malého cílového ložiska aplikuje
vysoká jednotlivá dávka (řádově desítky Gy) buď
jednorázově nebo v několika málo frakcích (1-5 frakcí).
Při jednorázové dávce desítky Gy se vedle apoptózy již
částečně uplatňuje i okamžitá smrt buněk
v interfázi - nekróza (radiobiologický
účinek zde již není přesně popsán LQ modelem, používají
se někdy jeho vysokodávkové modifikace - LQL model,
gLQ model, USC (univerzální křivka přežití), KN
(Kavahagh-Newman) model, PLQ (Padé Linear Quadratic), viz §5.2,
pasáž "Odchylky od LQ modelu a
jeho modifikace". Nádorové buňky jsou zasaženy tak velkou radiační
dávkou (s vysokým dávkovým příkonem), že se neuskuteční
nitrocelulární reparace a neprobíhá buněčná repopulace,
všechny buňky jsou "pozabíjeny" - nádorově
sterilizační účinek zde přechází v efekt ablativní.
Vedle názvu stereotaktická radioterapie SBRT se proto
používá i termín stereotaktická ablativní
radioterapie SABR, SABRT (Stereotactic
Ablative Body RadioTherapy); někdy se
s trochou nadsázky zmiňuje i asociace s anglickým slovem sabre=šavle
- jedná se o účinnou a elegantní zbraň proti nádorům. Za zajímavost stojí, že u vysokodávkové SABRT se
ve zvýšené míře projevuje (jinak vzácný) abskopální
efekt protinádorové imunitní odpovědi (§5.2, pasáž "Bystander-Abscopal efekt").
Stereotaktická radioterapie umožňuje přesně
zacílit vysokou radiační dávku do nádorového ohniska, při
maximálním šetření zdravých tkání. Lze tím dosáhnout
vysokou lokální kontrolu - účinnou likvidaci
nádorového ložiska - i v blízkosti důležitých
rizikových kritických orgánů a složitých anatomických
struktur, s nižším rizikem vedlejších účinků a komplikaci
(nižší radiotoxicita, menší riziko
sekundárních radiačně indukovaných malignit). Stereotaktické ozařovače - Leksellův gama
nůž a CyberKnife - ozařují s cca 10-30-krát
vyšší prostorovou přesností, než klasické lineární
urychlovače.
Pozn.: Podobných
cílů poněkud jinými prostředky - svazky těžkých
částic - dosahuje níže uvedená hadronová
radioterapie.
Leksellův
gama-nůž (LGK - Leksell Gama
Knife)
Nyní již klasickým zařízením pro
velmi precizní izocentrické ozařování je Leksellův gama-nůž
(první prototyp vyvinuli v r.1967
neurochirurg L.Leksell a radiolog B.Larsson se spolupracovníky v
ústavu Karolinska ve Stocholmu).
Radioterapie se odehrává pomocí přesně zacíleného
ozáření patologického místa v mozku zářením gama z
velkého počtu pevných radioaktivních zdrojů
60Co (g
1,173+1,332 MeV), jejichž úzké kolimované paprsky z různých
směrů se kříží ve společném ohnisku, do
něhož se pomocí stereotaktické lokalizace polohuje
patologický okrsek mozkové tkáně. V ohnisku působí velké
sumární radiační dávky ze všech křížících se paprsků,
mimo toto ohnisko dávka stmně klesá a již v okolí několika
milimetrů od ohniska je 100-krát menší; odpovídá dávce z
jednotlivého paprsku. Zářiče jsou uspořádány na
polokulové ploše a jsou opatřeny kolimátory,
směřujícími (propouštějícími) svazky záření g do centra (obr.3.6.4bnahoře). V
základním typu přístroje je 201 malých
zapouzdřených kobaltových zdrojů o aktivách cca 1GBq,
rovnoměrně rozmístěných na hemisféře průměru 400mm, což
dává v izocentru dávkový příkon asi 3 Gy/min.
Definitivní přesná
kolimace se provádí sekundárními kolimátory ve speciálních
kolimačních helmicích (v příslušenství
přístrojů jich je několik typů, příp. jejich segmenty je
možno motoricky posunovat). Před vlastní radioterapií se na
hlavu pacienta pomocí čtyř šroubů upevní koordinační stereotaktický
zaměřovací rám (obr.3.6.4b dole), umožňující na
rtg či MRI snímku označit polohu patologické léze,
kontrastní značky (markery) a zobrazené struktury vztáhnout k
trojrozměrné souřadnicové soustavě ozařovače.
Výhodnější je zde zobrazení magnetickou rezonancí, která
poskytuje kontrastnější zobrazení měkkých tkání
mozkových struktur. Tomografický snímek mozku, na němž jsou
zobrazeny i značky stereotaktického rámu (fiduciální
markery), se přenese do plánovacího systému a slouží
pro přesné nastavení cílového objemu do ohniska gama-nože.
Paprsky z některých zdrojů 60Co
mohou být podle potřeby vyřazeny stínící
"zátkou" v helmici, pokud by procházely rizikovými
kritickými strukturami, které by neměly být radiačně
zatíženy (jako je optický nerv, oční čočka,
mozkový kmen). Ozařovací doba závisí na velikosti a
druhu léze, je řádu desítek minut. Tumory se ozařují
jednorázovou dávkou ca 20-25 Gy, při radiochirurgii
malformací se používá až 100Gy (nekrotizační
ablační dávka). Pokud je cílový objem větších
rozměrů nebo je nepravidelného tvaru, posunuje se lehátko s
pacientem tak, aby se ohnisko přesouvalo v lézi a došlo tak k
postupnému prozáření celého cílového objemu -
multiizocentrické ozáření. Mozkové nádory pro terapii LKG
by neměly být větší jak 3cm a jejich počet by neměl být
větší než 5. Na některých pracovištích se však ozařuje
i 20 lézí, většinou s paliativním záměrem. Terapie je v
zásadě jednorázová, avšak při recidivách
či objevení se nových metastáz se léčba opakuje, i 3-krát.
U nových typů Lexellova
gama-nože (Perfection, Icon) bylo
provedeno několik zdokonalení :
-> Byl zvětšen
ozařovací prostor (s použitím 192
kobaltových zářičů s cylindrickou geometrií, bez
kolimátorových helmic - ty jsou nahrazeny motoricky řízeným
kónickým kolimátorem s 8 nezávisle pohyblivými segmenty s
576 otvory), což vedle mozkových lézí umožňuje
ozařovat i jiné cílové objemy v oblasti hlavy a krku (až k obratlům C1,C2).
-> Byl instalován
přídavný zobrazovací rotační con-beam CT systém,
který umožňuje referenční stereotaktické zobrazení .
-> Byla doplněna
další možnost fixace hlavy pomocí termoplastické masky
a kontrolní infračervené kamery, která monitoruje
její polohu, s reprodukovatelným nastavením při více
frakcích ozáření.
Pomocí gama-nože se
léčí především mozkové nádory a metastázy, meningiomy,
neurinom sluchového nervu, oční uveální melanom, cévní a
neurologické malformace, adenom hypofýzy.
Leksellův g-nůž má tři nevýhody
:
¨ Svou konstrukcí je v
podstatě jednoúčelový - uzpůsobený pro
terapii mozkových lézí (inovovaný model
umožňuje i ozařování lézí v oblasti krku).
¨ Radioaktivní zářiče 60Co mají poločas rozpadu 5,27 let,
postupně slábnou a je třeba je vyměňovat.
To je značně složitá a nákladná záležitost.
¨ Pro pacienta nepříjemný
a nepohodlný zaměřovací stereotaktický rám,
fixovaný na hlavu (u malých dětí, jejichž
lebeční kost ještě není docela pevná, by se tato fixace
neměla používat).
Přesto však na větších
pracovištích, specializovaných na onemocnění centrálního
nervového systému, je Leksellův gama-nůž intenzívně
používán. Pro nádory v oblasti hlavy je to nejpřesnější
zařízení.
Univerzální a kybernetický
gama-nůž
S technickým zdokonalováním "klasické"
izocentrické radioterapie IGRT s použitím g-záření
je i zde umožněno precizní ozařování úzkými
svazky záření s milimetrovou přesností. Je tím
postupně dosahováno vlastností gama-nože pro
univerzální použití, pro různé ozařované
lokalizace, nejen mozek *). Vedle přesně pracujících
ozařovačů IGRT s kolimátorem MLC, resp. mMLC (mikro-multileaf
kolimátor - obr.3.6.3b) - v klasickém, VMAT, nebo
tomoterapeutickém uspořádání, byly vyvinuty i "kybernetické
(robotické)" stereotaktické ozařovače s ostře
kolimovaným svazkem.
*) Pro přesné stereotaktické ozařování je
však mozek nejvhodnějším objektem, neboť je uzavřen v
lebce, kterou lze dobře zafixovat a zajistit tak dostaečnou
přesnost (<1mm) zacílení svazků do cílového ložiska. U
ostatních lokalizací je problémem pohyblivost struktur
v důsledků dýchacích pohybů, peristaltiky, plnění a
vyprazdňování dutin, svalové pohyblivosti atd. Na některé
tyto pohyby se u pokročilých ozařovacích technologií
provádějí korekce (např. respiratory gating u
dýchacích pohybů).
Kybernetický
gama-nůž , CyberKnife
Přístroje tohoto druhu jsou precizně fungující kybernetické
obrazem navigované ozařovače. Tento složitý počítačově
řízený systém sestává z několika základních komponent
(obr.3.6.4c) :
¨ Zdroj záření g - kompaktní
lineární urychlovač (LINAC) elektronů o energii cca
6MeV, opatřený terčíkem konvertujícím energii elektronů na
brzdné g-záření. Nepoužívá se
zde homogenizační filtr.
¨ Úzké kolimátory
pro nastavení různých průměrů ozařovacího svazku.
Používá se buď sada mechanicky výměnných
kolimátorů s různě velkými otvory, nebo kolimátor
může být opatřen proměnnou irisovou clonou,
jejíž elektricky pohyblivé segmenty umožňují automatické
on-line nastavení různých apertur - průměrů ozařovacího
svazku během ozařování (obr.3.6.3d).
Některé nové typy přístrojů jsou vybaveny i mnoholamelovým
kolimátorem MLC.
¨ Kybernetické rameno,
na němž je upevněn ozařovač: pohyby ozařovače zajišťuje
speciální stojan - "kybernetická (robotická) ruka"
se servomotorky řízenými počítačem
(obr.3.6.4c), s velkou škálou možností pohybu ozařovače.
Pomocí těchto servomotorků se ozařovač flexibilně pohybuje
kolem pacienta se všemi stupni volnosti - může se posunovat,
natáčet, rotovat kolem lehátka - a cíleně ozařuje
nádorové ložisko velkým počtem úzkých paprsků, pod
nejrůznějšími úhly, příslušnými dávkami záření. U
některých nových systémů se "roboticky" pohybuje
nejen ozařovací hlavice, ale i lehátko s pacientem, které
přebírá část pohybů ("stupňů volnosti")
ozařovače (obr.3.6.4c dole).
¨ Stereotaktický RTG
zobrazovací systém, osazený dvěma ortogonálně
umístěnými rentgenkami (jedna z nich je vidět na obr.3.6.4c)
a zobrazovacími flat-panely (umístěnými buď
na stojanech pod lehátkem, nebo zapuštěnými v podlaze),
snímkuje ozařovanou oblast, přičemž stereoskopické RTG
snímky význačných struktur v těle pacienta mohou být
využity jako stereotaktická základna
(vztažná soustava). Není tedy nutný fixační vnější
stereotaktický rám (jako u klasické stereotaktické
radioterapie), jako "stereotaktický rám" slouží
určité význačné struktury v těle ozařovaného pacienta :
- Některé
části skeletu - obratle páteře (v oblasti
sakrální, lumbální, thorakální, cervikální), struktury
lebky;
- Přímo
ozařovaný nádor - pokud je dostatečně
zřetelně zobrazen rozdíl denzity mezi lézí a pozadím na rtg
snímcích;
- Pro
spolehlivou navigaci stereotaxe (zvláště v oblasti měkkých
tkání) se někdy do okolí nádoru implantují speciální tzv.
fiduciální markery ("spolehlivé"
- lat. fiduacia = víra, důvěra, spoléhání, krytí)
- snadno rozpoznatelné vztažné lokalizační
orientační značky v počtu 3-6, implantované v okolí
cílové tkáně. Používají se většinou zlatá zrna
velikosti cca 2x5mm.
Pozn.: Zlato
jako materiál pro fiduciální značky má dvě výhody: 1.
Je to inertní kov, dobře tolerovaný tkáněmi. 2.
Vzhledem k vysoké denzitě se zlatá zrna velmi kontrastně
zobrazují na navigačních rtg snímcích.
On-line tracking
tumoru
Tyto lokalizační "vztažné body" či
struktury (vlastní nebo implantované) se vyznačí na
ozařovacím plánu a rtg navigační systém na ozařovači je
pak neustále monitoruje a řídí podle nich pohyby ozařovače
nebo robotického lehátka s pacientem. Před každou dílčí
dávkou z určitého směru se udělá stereotaktický snímek,
který se v počítači porovná s výchozími obrazy, které
byly použity k vytvoření ozařovacího plánu. Pokud dojde k
odchylce polohy cílové tkáně (v důsledku pohybu pacienta
nebo pohybu cílových struktur uvnitř těla) od plánované
polohy, počítačový systém vypočítá příslušnou korekci
pro nasměrování svazku a kybernetické rameno se nastaví do
nové správné polohy pro vyzáření další dávky.
Průběžné snímkování a porovnávání aktuálních snímků
s výchozími tak umožňuje operativně korigovat polohu
ozařovače, aby i při změně polohy (např. pohyb pacienta)
ozařovací svazek stále mířil přesně na cílové ložisko. Integrace
ozařovače se zobrazovacím rtg zařízením do jednoho
systému tak zajišťuje optimální on-line obrazem
řízenou úhlově-dávkovou modulaci ozařovacích
svazků (IGRT-SBRT). Shora popsaná technika obrazem řízené
(navigované) radioterapie IGRT je zde dovedena
k úplné dokonalosti!
Korekce na dýchací pohyby
Pro přesné ozařování cílových objemů v oblasti plic,
hrudníku a částečně i břicha je užitečné vybavit systém
vybaven zařízením pro synchronizaci a korekci na
dýchací pohyby. Provádí se většinou pomocí
optického laserového systému s čidly či zrcátky uchycenými
na hrudník pacienta, který elektronicky minitoruje dýchací
pohyby. Jsou dva základní způsoby eliminace vlivu dýchacích
pohybů na geometrickou přesnost ozáření :
- Respiratory gating - je jednodušší způsob,
kdy se ozařovací svazek vypíná a zapíná tak, aby
ozařování probíhalo jen ve vybrané definované fázi
dýchacího cyklu (např. v expiriu).
- Respiratory synchronization -
opto-elektronicky monitorované dýchací pohyby se přenášejí
do počítače, který nejprve vytvoří "dýchací
křivku". S pomocí této křivky se pak snímané signály
dýchacích pohybů elektronicky přenášejí na servomotorky
ramene ozařovače, který se "kývá" v rytmu dechu,
aby ozařovací paprsek stále směřoval do cílového ložiska
- respiratory tracking.
Pozn.: Určitým
drobným problémem celého procesu "respiratory tumor
tracking" může být poziční vztah mezi sledovanými
markery (optickými odražeči či kovovými fiducialy) a
cílovým tumorem v průběhu celého dýchacího cyklu.
Plánovací CT snímek pro účely SBRT v oblasti hrudníku a
břicha je běžně pořízen při zadržení dechu a
reprezentuje cílový objem, fiduciální markery a okolní
anatomické struktury pouze při výdechu nebo nádechu;
neposkytuje informaci o možných změnách pozice mezi tumorem
(s příp. jeho deformací) a markery v ostatních fázích
dýchání. Pro řešení tohoto problému je žádoucí
pořídit dva CT snímky - při výdechu a při
nádechu, na nichž se pak vyhodnocují změny vzdálenosti mezi
jednotlivými markery a definovanými částmi tumoru na obou
snímcích.
Obecně tracking tumoru
umožňuje přesnější zacílení radioterapie
s použitím individuálního a zmenšeného pohybového lemu (margin)
v ITV, což může být využito k lepšímu šetření zdravé
tkáně nebo k eskalaci dávky ve vlastním tumoru.
Velký počet svazků, vysoká
přesnost a selektivita
I u kybernetických ozařovačů se někdy (ojediněle)
používá jejich integrace se zobrazovacím zařízením
CT do jednoho systému ("In-Room CT" -
CT v místnosti ozařovny), pro přesné zobrazení a zaměření
cílového ložiska a okolních rizikových kritických tkání
bezprostředně před vlastním ozářením (není to ale nutné,
pokud je v blízkosti plánovací CT).
Flexibilita pohybů
ozařovače umožňuje ozařovat cílový objem velkým
počtem tenkých paprsků z nejrůznějších směrů, v
úhlovém rozsahu téměř 360°(s výjimkou
směru ze zdola pod lehátkem). Dosahuje se tím vyšší
přesnosti a selektivity radiační dávky dopravené do cílové
tkáně (s vysokým spádem dávky mimo cílový objem), s
možností respektovat tvarové a anatomické anomálie - dobře
se vyhýbat rizikovým kritickým tkáním. Obecně jsou všechny
tyto precizní stereotaktické techniky vhodné pro radioterapii malých
nádorových ložisek, do cca 3-5cm, v oblastech se
složitou anatomickou strukturou. Obrazem navigované
ozařování fotonovými paprsky z lineárního urychlovače,
pohybujícího se na kybernetickém rameni, umožňuje ozářit
cílovou oblast z mnoha úhlů a minimalizovat radiační
zátěž okolních tkání.
Stojí za zmínku, že na
rozdíl od ostatních výše uvedených teleterapeutických
metod, kybernetický gama-nůž není izocentrickou
technikou: ozařovač nemá rotační gantry a jeho
paprsek může být nasměrován pod libovolnými úhly.
Izocentrického režimu však v případě potřeby lze
dosáhnout vhodně řízenými pohyby ozařovače pomocí
servomotorků kybernetického ramene. Lze říci, že
kybernetický ozařovač může pracovat v 6D polohovacím
režimu: klasický pohyb v osách x,y,z a pohyb ve třech
dalších rotacích.
U přesného
ozařování s on-line trackingem tumoru lze hovořit o 4D
radioterapii - 3 rozměry prostorové a 1 časový.
Zahrnutí radiobiologických
procesů pak představuje nový 5.rozměr - jedná se svým
způsobem o 5D radioterapii.
Pro stereotaktickou
radioterapii lze v zásadě použít i protonový svazek,
nebo svazek těžších iontů, navíc s využitím efektu
Braggova maxima hloubkové dávky (viz níže).
Velká složitost cílení protonových svazků v robustním
gantry však zatím neumožňuje přesnou stereotaxi protonů
pomocí on-line navádění obrazem.
CyberKnife
První prototypy kybernetických ozařovačů byly
vyvíjeny od konce 80.let 20.stol., především v laboratořích
Stanfordské university (J.R.Adler a spol., v
inspiraci prvním typem Leksellova gama-nože a se snahou o jeho
zdokonalení), s použitím průmyslového robotu Fanuc
(japonská firma Fanuc se vyvinula v rámci
elektro-mechanické firmy Fujitsu). Na tomto základě
byla v r.1991 založena firma Accuray (se sídlem v
Sunyvale, California), která podstatně zdokonalila tento
robotický radioterapeutický stereotaktický systém a od r.2001
jej dodává pod označením CyberKnife
(obr.3.6.4c dole). Podobný typ stereotaktického ozařovacího
systému je Novalis (vyráběný firmou Brainlab),
který má rovněž průběžné snímání pomocí X-záření,
avšak ke kolimaci fotonového svazku používá speciální
Mikro-Multi Leaf kolimátor (mMLC, zmíněný výše,
obr.3.6.3b), který pomocí počítačového řízení může
flexibilně tvarovat ozařovací svazek.
Obecně lze shrnout, že
stereotaktická radioterapie SBRT se ve srovnání s konvenční
radioterapií vyznačuje vyšší přesností vedoucí k lepší
lokální účinností a nižší radiotoxicitě. Umožňuje
aplikovat vysokou dávku záření do malého cílového objemu,
v němž se tím dosahuje vyšší biologické účinnosti. V
některých případech může být i neinvazivní alternativou k
chirurgickému výkonu.
Hadronová
radioterapie
Tvrdé elektromagnetické záření - gama či X - je
nejčastějším typem radiace používané při terapii
nádorových onemocnění. Byla vypracována řada precizních
technik, jak toto záření selektivně nasměrovat
do nádorových ložisek (tím jsme se
zabývali výše). Určitou nevýhodou je
zde však ne příliš výhodný hloubkový profil
radiační dávky :
Při konvenčním ozařování hlouběji
uložených lézí fotonovými svazky je
nejvíce energie předáváno tkáním nacházejícím se na
povrchu a v malých hloubkách v těle *), tedy
předtím, než zasáhnou vlastní nádor. S rostoucí hloubkou
průniku do tkáně dochází k pomalému exponenciálnímu
poklesu - černá křivka na obr.3.6.5a (podobně
by tomu bylo i při ozařování elektronovými svazky -
červená křivka, jejichž intenzita rychle slábne s hloubkou;
pro hloubkové ozařování se nehodí). U
hlouběji uloženého nádoru tedy fotonový svazek předává
největší dávku záření tkáním před nádorem, pak teprve
(částečně oslabené) záření prochází nádorem a
pokračuje dál i přes zdravé tkáně za nádorem. Takže
zdravé tkáně a orgány dostávají poměrně značnou
radiační dávku před i za nádorem... Vede to k riziku
poškození důležitých tkání a orgánů v oblastech aplikace
záření. V anatomicky složitějších místech tak bývá
obtížné rozhodnout, jakou nejnižší radiační dávku
použít, aby byl ještě zajištěn terapeutický účinek a
přitom nedošlo k trvalému poškození důležitých tkání a
orgánů.
*) "Hloubkový efekt"
vysokoenergetického g-záření (zmíněný výše v úvodu části
"Vnější ozařování zářením g a X") je relativně
malý a zde se jím již nezabýváme.
V každém jednotlivém fotonovém svazku z
daného směru jsou tedy místa ležící před
cílovou tkání ozařována dokonce poněkud více než vlastní
ložisko a jen o málo menší radiační zátěži jsou
vystavena i místa ležící za cílovou
oblastí. Ozařováním z více směrů sice převáží
sumární radiační dávka v cílovém místě, avšak gradient
a selektivita dávky nemusí být vždy dostatečná, zvláště
při ozařování nádorů ležících v těsné blízkosti
důležitých tkání a orgánů. Existují však fyzikální
mechanismy *), umožňující tuto selektivitu ozáření
zvýšit dosažením příznivější bilance v
hloubkovém rozložení dávky: je to ozařování těžkými
nabitými částicemi, pro které se často používá
název "hadronová terapie".
*) Uplatňují se zde i faktory radiobiologické.
Biologický efekt záření souvisí s hustotou ionizace
danou ztrátou energie záření na jednotku dráhy, tzv. lineární
přenos energie LET (§5.1 "Účinky záření na látku. Základní veličiny
dozimetrie."). Elektronové a fotonové
záření má nízký LET, je to záření řídce
ionizující. Naproti tomu rychlé protony, těžší
ionty, piony, neutrony, jakož i produkty jaderných reakcí v
tkáni, mají vysoký LET - vykazují "hustou" ionizaci
a silné radiobiologické účinky, a to i na
hypoxické tumory. Kyslíkový efekt je významný především
při použití řídce ionizujícího záření (nejčastěji se
používá fotonové záření g či X), kde převládá
nepřímý radikálový mechanismus radiačního účinku. U
hustě ionizujícího záření, kde je zvýšený podíl
přímého zásahového mechanismu (a též zvýšená
rekombinace radikálů), je vliv kyslíku (oxygenace) na
radiobiologické účinky méně významný. Dochází zde
častěji k vícečetným poškozením
zasažených buněk - buňky jsou inaktivovány, přestávají se
dělit a zanikají apoptózou. Tato vyšší radiační
účinnost je navíc doprovázena možností jejího lepšího
hloubkového "zacílení" do požadované lokalizace.
Pod hadronovou radioterapií rozumíme
ozařování těžšími částicemi - protony,
těžšími jádry (ionty), p--mezony
či neutrony (v budoucnu možná i
antiprotony), které patří souhrnně do
kategorie hadronů - částic
vykazujících silnou interakci (viz
§1.5, pasáž "Systematika elementárních částic" a "Elementární částice a jejich vlastnosti"). Při ozařování protony
a těžšími jádry se však nevyužívá silné interakce, ale
elektromagnetické interakce, kterou tyto těžké kladně
nabité částice intenzívně ionizují ozařovanou tkáň (viz níže pasáž "Společné aspekty hadronové
radioterapie"). Nejdříve popíšme protonovou radioterapii.
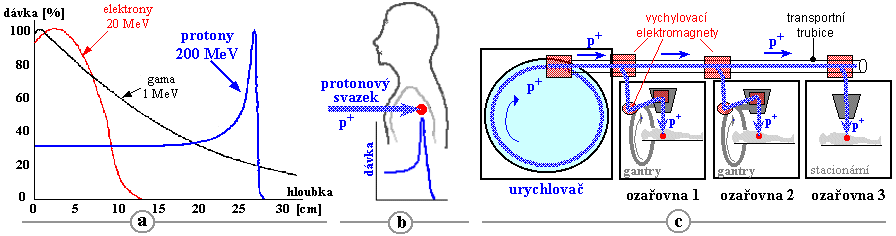
Obr.3.6.5. Hadronová radioterapie
protonovými svazky.
a) Braggovy křivky hloubkové závislosti
efektivní dávky záření v tkáni při ozařování zářením
gama, vysokoenergetickými elektrony a urychlenými protony. b)
Selektivní ozáření nádorového ložiska pomocí svazku
protonů o takové energii, při níž Braggovo maximum leží v
hloubce lokalizace tumoru. c) Principiální
schématické znázornění protonového radioterapeutického
pracoviště.
Protonová
radioterapie
Ozařujeme-li tkáň svazkem urychlených protonů
(o energii cca 100-200MeV a rychlosti asi 1/2 rychlosti světla),
má křivka hloubkové závislosti dávky, tzv. Braggova
křivka (viz §1.6 "Ionizující
záření", pasáž "Interakce nabitých částic"), zcela jiný tvar než pro
záření gama, jak je vidět na obr.3.6.5a (modrá křivka).
Rychlé protony při svém průletu interagují s látkou
především třemi způsoby :
¨ Coulombovské
interakce s elektrony v atomech
Hlavním mechanismem, kterým rychle letící nabité protony
ztrácejí svou energii, je neelastická interakce s atomovými
obaly látky - vyrážení elektronů z atomů
(obr.1.6.1 nahoře uprostřed). Tyto sekundární
elektrony jsou pak hlavním faktorem radiobiologického
účinku v tkáni. Vzhledem k tomu, že protony jsou téměř
2000-krát těžší než elektrony, interakce s jednotlivými
elektrony pohyb protonů prakticky neovlivňují - dráha
protonů zůstává přímková a ztráta
energie protonů v látce je téměř kontinuální.
Sekundární elektrony u protonového svazku
mají podstatně nižší energii než u
ozařovacích svazků fotonových (kde se
energie sekundárních elektronů může blížit energii
primárních fotonů, t.j. několika MeV).
Protony o energii řádu 100MeV jsou totiž poměrně "pomalé"
(rychlost max. c/2) - a jen na tuto max. rychlost
jsou schopny urychlit sekundární elektrony. Jednoduchá
kinematická úvaha ukazuje, že maximální energie
sekundárních elektronů zde pak může být zhruba 50keV. Ve
skutečnosti je však energie většiny elektronů ještě mnohem
nižší (protony při svém
rychlém průletu atomovým obalem stačí Coulombovsky předat
elektronům jen malou energii) - většinou
jen desítky eV (viz
spektrum u Bethe-Bloch. vzorce v §1.6 "Ionizující
záření", pasáž "Interakce nabitých částic").
¨ Coulombovské
interakce s atomovými jádry
U protonů prolétajících velmi blízko atomového jádra (s malým impaktním parametrem)
dochází k odpudivé Coulombovské síle, která vzhledem k
velké hmotnosti jádra elasticky odkloní
proton z jeho původní přímkové dráhy. Podle zákona
zachování hybnosti se na opačnou stranu pohybuje odražené
jádro. V lehkých materiálech může odražené jádro
(např. jádro vodíku - proton) získat značnou energii. Tyto efekty mohou přispívat
k částečnému bočnímu rozptylu protonového
svazku.
¨ Jaderné
reakce
Při přímém "zásahu" jádra (s
téměř nulovým impaktním parametrem)
proton vstupuje do jádra, kde může vyvolat jadernou
reakci (§1.3 "Jaderné reakce a jaderná energie", pasáž "Druhy jaderných
reakcí"). Jádro při
tom může vyzářit sekundární proton,
deuteron, alfa částici nebo těžší iont, jeden nebo několik
neutronů, fotony gama. Z takto vznikajícího sekundárního
záření z jaderných reakcí se při protonové terapii může negativně
uplatňovat jeho pronikavá složka - fotony gama a
"bludné" neutrony, které dolétají do větších
vzdáleností a mohou způsobovat nežádoucí radiační
zátěž okolních tkání mimo cílový objem.
Zajímavé využití jaderných reakcí pro zobrazení je
zmíněno níže v pasáži "Jaderné reakce při hadronové terapii
a možnosti gamagrafického monitorování", pro možné zvýšení efektivity a selektivity
protonové terapie v pasáži "Proton-bórová terapie".
¨ Brzdné
záření protonů v lehkých materiálech je prakticky zanedbatelné,
na rozdíl od elektronů (§1.6, část "Interakce nabitých částic").
Pro názornost výkladu
interakce protonového záření s tkání, v porovnání s
dalšími druhy záření, si zde z §1.6 duplicitně uvedeme
důležitý obrázek 1.6.1 (bude
nás zajímat především především vyobrazení "Protony
200MeV" nahoře uprostřed a příslušné křivky
vpravo) :
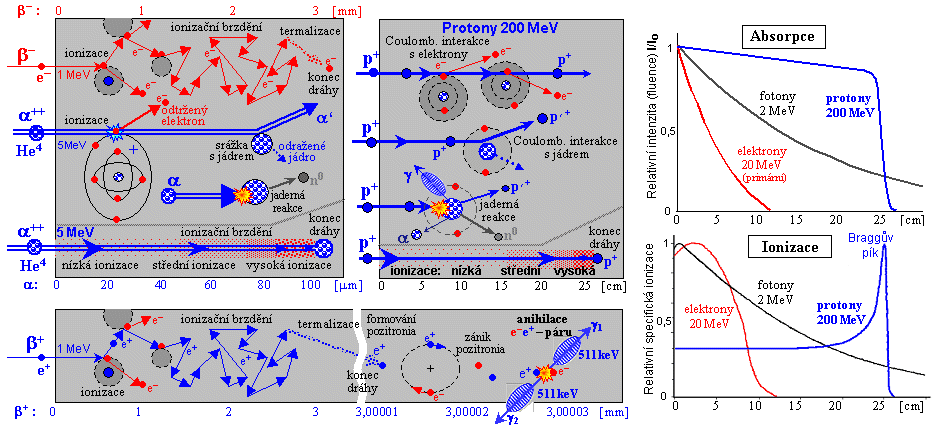 |
Obr.1.6.1. Interakce
rychlých nabitých částic s látkou.
Vlevo nahoře: Schématické
znázornění mechanismů ionizace při průchodu
částic beta- a alfa látkou.
Nahoře uprostřed: Tři
základní mechanismy interakce protonového záření s
látkou.
Dole: Interakce pozitronového
záření beta+ s látkou, končící anihilací pozitronu s
elektronem.
Vpravo: Braggovy křivky
hloubkové závislosti absorpce a specifické ionizace
podél dráhy fotonů gama, urychlených elektronů a
protonů. |
Při průletu nabité částice látkou je
lineární přenos (ionizační) energie přímo úměrný
elektronové hustotě látky (která roste
s hustotou r a protonovým číslem Z látky) a nepřímo úměrný druhé mocnině rychlosti nabité
částice, zde protonu. Rychlé protony při vstupu do tkáně
proto ionizují zpočátku poměrně málo. Jak se protony brzdí
a klesá jejich rychlost, ionizační účinky rostou
- při pomalejším pohybu protonu roste efektivní čas
elektrického Coulombovského působení na elektrony v atomech,
takže se stačí předat více energie a vytrhnout více
elektronů.
Rozložení dávky v závislosti na hloubce má
tedy charakteristický tvar: při průchodu rychlých protonů
tkání je zpočátku absorbovaná dávka poměrně nízká a
téměř konstantní, až do blízkosti konce doletu protonů v
tkáni. Ke konci doletu dávka prudce vzrůstá, dosahuje maxima
a pak následuje velmi rychlý pokles k nule. Největší část
své energie předávají urychlené protony v úzké
hloubkové oblasti tzv. Braggova píku,
těsně před svým maximálním doběhem; zde dochází k nejhustší
ionizaci a největší radiační dávce. Do oblasti
Braggova maxima se dostane cca 70% energie protonu. Tkáně
ležící před tímto maximem jsou ozářeny
výrazně menší dávkou (je
zde předáno jen cca 30% energie), tkáně
ležící za tímto maximem nedostanou dokonce
téměř žádnou radiační dávku, neboť tam
protony vůbec nedoletí; po zabrzdění je proton neutralizován
záchytem elektronu (vznikne vodík) a další ionizace již nepokračuje. Díky této
specifické hloubkové závislosti dávky s Braggovým maximem je
možné do cílového objemu aplikovat vyšší dávky
oproti standardní fotonové radioterapii a zároveň radiačně šetřit
okolní zdravé tkáně, především ty jež leží hlouběji za
cílovým objemem.
Pozn.: Absence Čerenkovova záření
Protonový svazek používané energie cca 200MeV bohužel nelze
zobrazit pomocí Čerenkovova záření ve vodě tak,
jako elektronový či fotonový svazek (obrázek
výše v pasáži "Čerenkovovo
záření"). Základním důvodem je, že tyto protony jsou
relativně "pomalé". Pro emisi
Čerenkovova záření protonů je nutná prahová energie cca
460MeV. A sekundární elektrony, vyrážené z atomů podél
protonového svazku v tkáni, mají většinou velmi
malou energii desítek eV nebo nepatrná část jednotky
keV (bylo diskutováno výše, viz též
spektrum u Bethe-Bloch. vzorce v §1.6 "Ionizující
záření", pasáž "Interakce nabitých částic"), daleko nižší než je
prahová energie 260keV pro vznik Čerenkov. záření elektronů
ve vodě... Lze jej však velmi dobře zobrazit v kapalném
scintilátoru (obrázek v pasáži "Zviditelnit neviditelné").
Hloubka, v níž nastává
Braggovo maximum v dané látce, je dána energií
protonů; pro protony energie 200MeV činí tato hloubka
v tkáni asi 25 cm. Změnou energie svazku protonů lze nastavovat
hloubku, v níž dochází k maximální
radiační dávce. Lze tím citlivě modulovat
dávkové rozložení uvnitř těla :
Modulace protonového
svazku
Protonový svazek z urychlovače je poměrně úzký a má
určitou pevnou energii. Braggovo maximum je proto poměrně velmi
ostré, takže protony by dostatečnou radiační dávku
předávaly pouze v úzce ohraničeném místě v určité
hloubce. Šířka Braggova píku pro monoenergetické protony je
jen cca 2cm, což je často mnohem méně než velikost nádoru,
který navíc bývá zpravidla nepravidelného tvaru. Pro
dostatečné prozáření celého objemu nádoru je proto
potřeba vytvarovat a rozšířit protonový
svazek, jak v příčném směru tak i do hloubky. Můžeme
postupovat v zásadě dvěma způsoby :
Pasivní modulace
Použitím vhodných "deceleračních" filtrů
(klínového nebo schodovitého průběhu tloušťky) rozptýlíme
energeticky svazek tak, abychom dosáhli rozšíření
Braggova vrcholu do požadovaných rozměrů. Podle tloušťky
filtru se sníží energie protonů v určitých částech svazku
tak, aby se dosáhlo potřebného ozáření nádoru v celé jeho
hloubce. Decelerační filtry jsou mechanicky provedeny často ve
tvaru modulačních kotoučů, které se řízeně
otáčejí ve svazku protonového záření.
K příčnému vytvarování svazku se používají tvarovací
clony a kompenzátory buď fixní, nebo vysoustružené
individuálně pro daného pacienta podle tvaru nádoru a
ozařovacího plánu.
Určitým nežádoucím vedlejším efektem filtrů a clon je
vznik sekundárních neutronů, které vznikají při interakci
vysokoenergetických protonů s atomovými jádry použitých
materiálů. Tyto parazitní neutrony kontaminují protový
svazek.
Aktivní skenování
Cílovou oblast ozařujeme z každého směru vhodným
meandrovým "skenováním", přičemž měníme
energii svazku částic a posouváme tak maximum dávky
do různých hloubek; postupně je tak ozářen celý cílový
objem. Většina používaných urychlovačů - cyklotronů
- však nemá možnost kontinuálně měnit energii svazku, mají
fixní energii. Energie protonů se mění (snižuje) externě
pomocí deceleračních filtrů, většinou grafitových
degradátorů na výstupu. Proměnnou energii mají synchrotrony,
které se však pro větší složitost a nákladnost zatím
používají ojediněle.
U nových systémů bylo vyvinuto magnetické
vychylování a skenování pomocí úzkých
protonových svazků ("pencil beam"),
které je velmi flexibilní: není nutno používat pracně
zhotovených individuálních clon a kompenzátorů a nevznikají
sekundární neutrony. Jedině této technice patří budoucnost
protonové terapie...
K ozáření větších objemů tkání se též
používá kombinace hadronového ozáření s konvenčním
fotonovým ozářením.
Sekundární částice
při protonové terapii
Vedle Coulombovských interakcí s elektronovými obaly (při
nichž jsou vyráženy elektrony způsobující radiobiologické
účinky) malá část protonů podléhá jaderným
reakcím v materiálu - vznikají další sekundární
částice protony, fotony, neutrony,
deuterony, a-částice (obr.1.6.1 nahoře
uprostřed). Sekundární neutrony a fotony
mohou "cestovat" mimo cílové tkáně a radiačně
zatěžovat vzdálenější tkáně a orgány (s příp. rizikem sekundárních malignit). Měření ukázala, že celková frakce unikající
energie sekundárním zářením činí cca 1-2% primární
energie protonů. Zajímavé využití sekundárního záření
je zmíněno níže v pasáži "Jaderné
reakce při hadronové terapii a možnosti gamagrafického
monitorování" a
"Proton-bórová terapie".
Konstrukce
protonového ozařovače
Zdrojem protonového svazku - a tedy
nejdůležitější částí hadronového terapeutického
systému (obr.3.6.5c) - je urychlovač. Je jím
nejčastěji cyklotron nebo synchrotron
(o urychlovačích viz §1.5, část "Urychlovače nabitých částic "), v budoucnu lze očekávat nasazení výkonných lineárních
urychlovačů protonů. I když podle klasifikace v §1.5.
se jedná o "malý urychlovač" *), zaujímá
laboratoř urychlovače poměrně velké prostory - jednu velkou
místnost (halu) s vlastní vakuovou urychlovací trubicí
obklopenou silnými elektromagnety, stínění, dále několik
menších místností se vzduchotechnikou, napájecí a
řídící elektronikou.
*) Cyklotrony pro energie protonů 250MeV
mívají průměr cca 4-5m, synchrotrony kolem 6-8m. Vyvíjejí
se i podstatně menší kompaktní urychlovače,
cyklotrony se supravodivými elektromagnety, které by
mohly být montovány přímo do gantry ozařovače.
Zkoušejí se dále kombinace [cyklotron
--> lineární urychlovač],
nazývané někdy "cyclinac". Za menším cyklotronem,
poskytujícím protony či těžší ionty fixní energie (cca
30MeV), je zařazen lineární urychlovač (linac)
s vysokým gradientem, který dále zvyšuje energii částic na
hodnotu pro dosažení Braggova maxima v potřebné hloubce
nádorové léze. Tato technologie by umožňovala snadnou,
rychlou a flexibilní elektronickou regulaci energie
svazku - aktivní 4D skenování pro terapii pohyblivých
orgánů.
Nadějné jsou experimenty s laserovým
urychlováním protonů - §1.5, pasáž "Laserové
urychlovače LWFA".
Intenzita je zde však zatím velmi nízká, mohou se snad
zdokonalit a uplatnit ve vzdálenější budoucnosti..?..
Urychlené protony se pomocí elektromagnetů vyvádějí
z urychlovače a vakuovou transportní trubicí
se přivádějí do ozařovny. Na jeden urychlovač může být
napojeno několik ozařoven, kam jsou
jednotlivé dílčí svazky vedeny transportními trubicemi
opatřenými vychylovacími elektromagnety -
obr.3.6.5c (je zde zakreslena jen hlavní
trubice, větvící se transportní trubice do ozařoven nejsou z
důvodu místa zakresleny). V koncové ozařovací
hlavici *) , "trysce", v ozařovně se pomocí
dalších precizně řízených elektromagnetů protonový svazek
tvaruje (jak bylo
zmíněno výše v pasáži "Modulace protonového
svazku") a vstupuje do
ozařované tkáně. Protonový svazek může být silným
magnetickým polem fokusován do úzkého "tužkového"
paprsku (pencil beam).
*) Ozařovací hlavice bývá často
upevněna na speciálním stojanu, tzv. gantry,
umožňujícím řízenou rotaci kolem těla
pacienta pro izocentrickou radioterapii (srov.
výše obr.3.6.1). Rotace protonového ozařovacího svazku se
dá provádět pomocí kombinace mechanického pohybu gantry a
řízených magnetických polí elektromagnetů - jedná se o
velmi robustní a složité zařízení (jehož
pořizovací cena se blíží ceně primárního cyklotronu!).
Podobně jako v konvenční fotonové radioterapii
se i zde často používá frakcionované ozařování z
více směrů s modulovanou intenzitou svazku (IMPT
- Intensity Modulated Proton Therapy), analogicky jako je výše
uvedená modulace IMRT u svazků fotonových ("Radioterapie
s modulovanou intensitou").
Přídavnou výhodou hadronové radioterapie je možnost pro
každý svazek hloubkově nastavit oblast
maximální předávané energie do nádorového ložiska. Při
dané energii doletí všechny těžké nabité částice (platí pro protony i těžší urychlená jádra) zhruba do stejného místa (hloubky) v tkáni, kde se
zastaví a předají maximum své energie. Díky této zvýšené
selektivitě lze zvýšit ložiskovou dávku
(a tím zvýšit pravděpodobnost účinné
likvidace nádorových buněk), aniž by
došlo k vážnějšímu poškození okolních tkání.
Ve speciálních případech
se provádí i stereotaktická jednorázová terapie
u nezhoubných malformací, nebo terapie očních nádorů.
Jednou z dalších příznivých fyzikálních
vlastností svazků těžkých částic je jejich minimální
bočný rozptyl. Proton, jehož hmotnost je 1836-krát
větší než elektronu, je při interakcích s elektronovými
obaly atomů jen minimálně odchylován, letí v jednom směru
"vpřed" *). I tato vlastnost přispívá k lepšímu
zacílení radiační dávky do požadovaného místa.
*) V tomto směru primárního svazku je
nasměrována i větší část sekundárních elektronů
uvolněná při interakci těžkých rychlých částic s
látkou.
Přednosti protonové
a iontové radioterapie
Když to shrneme, protonová radioterapie má tři základní
přednosti :
× Dobře
definovaná dráha a radiační dávka při pohybu
protonů v tkáni, kterou lze regulovat energií protonů.
× Oblast
maximální distribuce dávky je úzce lokalizovaná a
lze ji přesně nastavovat energií částic. V dráze před
Braggovým maximem (v menší hloubce) je radiační dávka a
hustota ionizace poměrně nízká Ţ
relativně malý radiobiologický účinek. V oblasti Braggova
maxima (lokalizovaného dovnitř nádoru) je dávka vysoká,
záření hustě ionizuje a má vysoký radiobiologický
účinek.
× Ve
větších hloubkách než je dolet protonů, za
Braggovým maximem (za nádorem), je radiační dávka
prakticky nulová - zdravé tkáně za nádorem nejsou
protony zasaženy.
Vede to k lepší možnosti přesně
zacílit vysokou radiační dávku do nádorového
ohniska, při maximálním šetření okolních zdravých
tkání. Lze tím dosáhnout vysokou lokální kontrolu - účinnou
likvidaci nádorového ložiska - zejména u hlouběji
uložených nádorů v blízkosti důležitých rizikových -
kritických orgánů a složitých anatomických struktur, s
nižším rizikem vedlejších účinků a komplikací (nižší radiotoxicity), při
nižším rozptýleném záření, nižším riziku
sekundárních radiačně indukovaných malignit.
Souhrnně řečeno:
Radioterapie
těžkými nabitými částicemi umožňuje maximalizaci
radiační dávky v cílovém nádorovém objemu a minimalizaci
radiotoxicity v okolních zdravých tkáních.
Tyto přednosti má i radioterapie těžšími
jádry (ionty) a teoreticky i piony. V některých případech k
tomu přistupuje možnost monitorování radiační dávky podél
svazku, např. PET-zobrazením sekundárních radioaktivních
jader, vznikajících podél svazku vysokoenergetických
uhlíkových jader (viz níže pasáž
"Jaderné reakce při hadronové terapii a
možnosti gamagrafického monitorování"). Další fyzikálně
zajímavé aspekty hadronové radioterapie jsou diskutovány
níže.
Pozn.: Podobných
cílů poněkud jinými prostředky - gama nožem
- dosahuje výše uvedená stereotaktická
radioterapie SBRT.
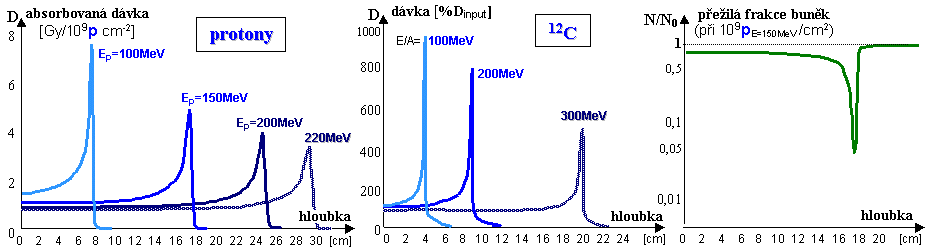
Braggovy křivky závislosi hloubkové
distribuce dávky v tkáni (vodním fantomu) pro různé
kinetické energie protonů (vlevo) a jader 12C (uprostřed).
Vpravo: Příklad hloubkové závislosti
radiobiologického účinku (přežilé frakce buněk) při
ozáření tkáně (s radiosenzitivitou a~0,35) protonovým svazkem
150MeV.
Radioterapie
těžšími jádry (ionty)
Pro hadronovou terapii se v současné době daleko nejčastěji
používají urychlené protony (energie do
250MeV). Podobný a ještě poněkud větší účinek však
mají i těžší urychlené částice *) -
částice alfa či jádra lithia, berylia, bóru, uhlíku a pod.,
jejichž širší využití lze v budoucnu možná očekávat;
označuje se jako hadronová radioterapie těžkými
ionty (za "těžké ionty"
se považují atomy těžší než vodík, zbavené všech nebo
části svých elektronů). Uspořádání
je v zásadě podobné jako na obr.3.6.5c, technologie je ještě
náročnější než u protonové radioterapie (synchrotron pro 12C má průměr 20-25metrů!).
*) Braggova křivka hloubkové distribuce
radiační dávky má pro těžší ionty zlehka odlišný tvar
než u protonů. Braggův pík má před maximem poněkud
ostřejší nárůst (nižší ozáření tkáně před
nádorem). Avšak za Braggovým maximem dávka neklesá tak
prudce k nule jako u protonů: křivka zde má jakýsi
"ocásek" (představující cca 10% dávky ve vstupní
plato-části), táhnoucí se cca 2cm do větší hloubky -
interakcí těžkých iontů s atomy tkáně dochází k
fragmentacím a vznikají prudce odražené lehčí ionty
(většinou protony), které při vysoké energii mají delší
dolet než primární těžší ionty.
Z těžších jader jsou pro radioterapii
zvláště vhodná urychlená jádra uhlíku 12C (uhlíkové ionty). Poměrně
snadno se získávají (ionizací plynného
oxidu uhličitého pomocí elektronů) v
iontovém zdroji k urychlení a vykazují vysoký radiační
kontrast v oblasti Braggova maxima. Kromě toho při jaderných
reakcích jader 12C v tkáni vznikají jádra 11C, která vykazují b+-radioaktivitu,
umožňující scintigrafické monitorování dávkové
distribuce v ozařované tkáni pomocí PET (viz níže pasáž "Jaderné
reakce při hadronové terapii a možnosti gamagrafického
monitorování"). Podobné vlastnosti mají i urychlená jádra
kyslíku 16O, včetně vzniku b+-radioaktivních jader
15O,
rovněž vhodných pro PET monitorování dávkové distribuce.
Radioterapie
mezony p-
Zvláště výrazné radiační maximum ke konci
svého doběhu v látce mají mezony p-
- záporné piony (o
jejich vzniku a vlastnostech viz kap.1.5, část "Vlastnosti a interakce elementárních
částic", pasáž "Mezony
p a K"). Kromě
obvyklého mechanismu Braggova píku (delší efektivní doba interakce pomalejší nabité
částice s atomovým obalem látky) k
tomuto účinku přispívá to, že na konci své dráhy jsou p--mezony zachyceny v jádrech atomů (v
tkáni např. v jádrech uhlíku 12C, kyslíku 16O, dusíku 14N). Při tomto záchytu p--mezonu jádrem se jeho reakcí s protonem (p- + p+ ® no + 140MeV) uvolní energie cca 140MeV, která je
vyšší než vazbová energie, takže excitované jádro se rozštěpí
zpravidla na a-částice, deuterony, neutrony a protony (u těžších
jader se mezi fragmenty vyskytují i 6Li nebo 12C). Např. u uhlíku dochází k reakci p- + 12C ® 2a + 3n + p, přičemž částice a odnášejí kinetickou
energii cca 30MeV a neutrony cca 70MeV (zbylých 40MeV se
spotřebuje na překonání vazbové energie jádra).
Zabrzděním těchto fragmentů se v daném místě předá
značná ionizační energie, tj. dávka záření, účinně
likvidující nádorové buňky.
Mezony p- se
získávají při ostřelování jader terčíku (např. uhlíku
nebo berylia) protony urychlenými na vysoké energie, větší
než cca 500MeV, ve velkém urychlovači (např.
synchrocyklotronu). Určitým problémem je velmi
krátká doba života těchto částic cca 10-8 sekundy, takže je
nelze rozvádět do vzdálenějších ozařoven. Dosah pionů o
energiích 50-100MeV v tkáni činí cca 10-25cm. Rozpad pionů
na konci jejich dráhy způsobuje určitý nežádoucí rozptyl
radiační dávky; rovněž rychlé neutrony, rozlétající se
od místa interakce pionů, způsobují určitou radiační
dávku mimo cílový objem. Pro vysokou technickou
náročnost a nákladnost je tato metoda dosud jen ve
stádiu experimentálního zkoušení v několika málo
největších urychlovačových centrech.
Antiprotonová
radioterapie
Dalšími neobvyklýmu částicemi, které by potenciálně mohly
být výhodné pro cílenou radioterapii, jsou antiprotony
p' neboli záporné protony p- (jejich vlastnosti byly popsány
v §1.5, část "Vlastnosti a
interakce elementárních částic"). Urychlené antiprotony po
vstupu do tkáně ionizují podobným způsobem jako normální
protony - zpočátku nízká hustota ionizace pomalu roste a
těsně před zabrzděním je výrazný nárůst ionizace v Braggově
píku. Po zabrzdění však navíc dochází k anihilaci
antiprotonu s protonem nebo neutronem v atomovém jádře
ozařované látky (tkáně) za vzniku p-mezonů, typicky: p'+p®2p++2p-+po. Sekundární mezony p- se mohou chovat způsobem popsaným výše v
předchozím odstavci; obecně se kladné a záporné piony
rychle rozpadají na miony a neutrina, neutrální pion na dvě
kvanta gama (tyto částice většinou uniknou z místa
interakce). Další kvanta mohou být emitována z
"postižených" jader (pokud to
nejsou jádra vodíku) mechanismem
jaderných reakcí. Antiprotonovou anihilací se tak v místě
Braggova píku uvolní další energie až
několik stovek MeV, která výrazně zvyšuje radiační
účinek v místě Braggova maxima - asi 3-krát ve
srovnání s protony. Doprovodným jevem při interakcích jsou i
pozitrony, jejichž anihilační gama-fotony energie 511keV lze
detekovat pomocí PET kamery a monitorovat tak
skutečné rozložení radiační dávky v tkáni (podobně jak je níže zmíněno u radioterapie jádry
uhlíku 12C) - obr.3.6.6. Určitou nevýhodou
antiprotonové terapie je poněkud vyšší radiační dávka
mimo cílový objem (včetně dávky
celotělové), způsobená pronikavými
piony, neutrony a g, rozlétajícími se ve všech směrech od místa
interakce antiprotonů.
Antiprotony p- je možno připravit
ostřelováním jader terčíku urychlenými protony při
reakcích p+p®2p+p+p' a p+n®2p+n+p'. Kinetická energie protonů musí být
nejméně 5,6GeV, ale pro dosažení většího výtěžku přes
20GeV, čehož lze dosáhnout jen na velkých urychlovačích.
Vzniklé antiprotony vylétají se značně vysokými
kinetickými energiemi několika GeV, takže pro
radioterapeutické účely je nutno je zpomalit
na energie cca 100-200MeV v decelerátorech. Tato
výsledná energie určuje dolet antiprotonů v
tkáni a tím hloubku Braggova maxima radiační
dávky. Metoda je ve stádiu laboratorního zkoušení v
největších nukleárních laboratořích (CERN, FERMILAB);
vzhledem k neobyčejné náročnosti a nákladnosti
nelze očekávat zavedení této zajímavé metody do klinické
praxe v dohledné době...
Neutronová terapie
Pro radioterapii lze v zásadě použít i svazky neutronového
záření. Buď jsou to rychlé neutrony, které
srážkami s jádry v tkáni, především s jádry vodíku,
vytvářejí urychlené protony, které mají silně ionizační
účinky. Rychlé neutrony mají vysoký LET a radiobiologickou
účinnost, avšak hloubkové rozložení dávky v tkáni není
výhodnější než u záření gama. Navíc se svazek
neutronového záření obtížně kolimuje a moduluje, dále
vykazuje v tkáni značný rozptyl "do stran" od
původního směru.
Zajímavým nekonvenčním postupem pro zvýšení
selektivity neutronového ozáření nádorového ložiska je
tzv. neutronová záchytová terapie (NCT - Neutron
Capture Therapy) pomocí pomalých neutronů.
Při tomto terapeutickém postupu se do nádorového ložiska
pomocí vhodné sloučeniny, která se přednostně vychytává a
akumuluje v nádorové tkáni, navážou vhodné atomy, jejichž
jádra mají vysoký účinný průřez pro záchyt neutronů
(viz §1.3., 1.6) - používá se bór
obohacený isotopem 10B. Pro mozkové nádory se vyvinuly speciální
sloučeniny bóru (BSH
-merkaptododekarborát, či BPA- dihydroxyboralfenylalanin), které se do zdravé mozkové tkáně dostávají jen
v nepatrné míře, avšak v buňkách nádorové tkáně, která
má porušenou hemato-encefalickou bariéru, se selektivně
vychytávají. Pro metabolicky aktivní nádory jinde v
těle lze použít Bor-Deoxy-Glukózu.
Takto připravené nádorové ložisko se pak ozáří
svazkem nízkoenergetických neutronů (s
energiemi cca 1eV-10keV), které se při průchodu tkání dále
zpomalují (moderují) na tepelnou energii a jsou pak zachycovány
v jádrech bóru, přičemž dochází reakcemi (n, a): 1n + 10B ® 11B* ® 7Li
+ 4He k
rozpadu jádra bóru a emisi jader hélia (tj. alfa částic) a
lithia. Vzniklé alfa částice a lithiová jádra,
odnášející značnou energii uvolněnou v
reakci, mají v tkáni velmi malý dolet,
zastaví se cca 10 µm od místa reakce, takže ionizační
energie je předávána prakticky přímo uvnitř příslušných
nádorových buňek, které mohou být efektivně
likvidovány, bez radiačního poškození okolních
tkání. Popsaná metoda je zatím experimentálně zkoušena u
mozkových nádorů glioblastomů (a též mozkových metastáz
kožního melanoblastomu).
Zdrojem neutronů pro radioterapii může být buď jaderný
reaktor (§1.3, část "Jaderné reaktory"), v laboratorních
podmínkách jsou však výhodnější neutronové
generátory, speciální malé urychlovače nabitých
částic, většinou deuteronů, s tritiovým terčíkem, (§1.5, část "Urychlovače
nabitých částic ", pasáž "Neutronové generátory"), nebo radioisotopové zdroje tvořené směsí
a-zářiče
s lehkým prvkem (jako je směs americia s beryliem, dochází k
reakci a,n),
či těžkým transuranovým radionuklidem (nejčastěji
kalifornium 252), při jehož spontánním štěpení se
uvolňují neutrony (§1.3, "Transurany"). Pro záchytovou terapii
se neutrony nejprve zpomalují v moderátoru.
Neutronová terapie nepřekročila rámec
pokusných studií (v praxi se příliš
neosvědčila) a nyní se používá jen
zcela ojediněle... Co se týče použití bóru,
je naopak perspektivnější níže uvedená "Proton-bórová terapie".
Jaderné reakce při hadronové
radioterapii a možnosti "in-beam" gamagrafického
monitorování
Při ozařování vysokoenergetickými hadrony (protony, piony,
rychlými neutrony, antiprotony) většina těchto částic
interaguje s atomovými obaly ozařované látky (tkáně); tím
je dán jejich ionizační a radiobiologický účinek. U malé
části těchto částic však dochází i k řadě jaderných
reakcí s jádry atomů v tkáni, při nichž vznikají
různé sekundární částice a fragmenty jader. Při těchto
jaderných reakcích je emitováno sekundární (či terciální)
záření, které může být v zásadě detekováno a použito k
monitorování dávkové distribuce v tkáni.
Jedná se o hadronovou aktivační analýzu s
použitím vznikajícího záření gama (jedině toto vysokoenergetické fotonové záření je pronikavé,
může vyletět z ozařované tkáně ven a být detekováno). Princip aktivační analýzy byl podán v §3.4,
část "Neutronová aktivační
analýza " (kde se jednalo
především o neutronovou aktivaci, avšak podobné principy se
uplatňují i při ozařování protony a těžšími ionty). Gama záření při jaderných reakcích vzniká v
zásadě dvěma mechanismy:
× Deexcitací vzbuzených
hladin terčových jader vznikajících po reakci. Toto záření
má čárové spektrum o řadě energií (v
širokém rozmezí cca 100keV-10MeV) a
může být analyzováno pomocí gama-spektrometrů se
scintilačními nebo polovodičovými detektory (HPGe) - viz
níže pasáž "". Gamagrafické zobrazení pro tak
vysoké energie je obtížné se standardními scintigrafickými
kolimátory, zkouší se speciální štěrbinové kolimátory,
experimentálně i kamery pro vysoké energie s elektronickou
kolimací, využívající kinematiky Comptonova rozptylu (§4.2, část "Alternativní fyzikální principy
scintilačních kamer",
pasáž "Comptonovy kamery").
× Emisí pozitronů z
pozitronových radionuklidů vytvářených při jaderných
reakcích. Tyto pozitrony v tkáni anihilují s elektrony za
vzniku dvojic kvant anihilačního záření
gama o energii 511keV. Distribuci pozitronových radionuklidů
lze zobrazit pomocí gamakamery PET.
Z časového hlediska se jedná o sekundární
záření dvojího druhu :
¨ Promptní
záření gama, emitované okamžitě při reakci nebo
bezprostředně po reakci v důsledku deexcitace vzbuzených
jaderných hladin v ozařované látce. Toto záření je nutno
měřit "on-line" přímo při ozařování.
¨ Následné
- zpožděné - gama záření, vyzařované
radionuklidy generovanými po reakci, které mají určitý
kratší či delší poločas rozpadu. Zde můžeme měřit a
zobrazovat i "off-line" s určitým časovým odstupem,
s ohledem na poločas rozpadu analyzovaného radionuklidu.
In-beam
PET monitoring
Z hlediska gamagrafického monitorování průchodu svazku
záření látkou (tkání) jsou zajímavé zvláště takové
reakce, které vedou ke vzniku pozitronů: buď
jsou e+
emitovány přímo, nebo vznikají jádra vykazující
pozitronovou b+-radioaktivitu.
Anihilace pozitronů s elektrony je doprovázena emisí dvojic
protilehlých kvant anihilačního záření g o
energii 511keV. Tyto fotony pak mohou být detekovány metodou pozitronové
emisní tomografie PET (viz "Kamery PET" v kap.4 "Radionuklidová scintigrafie") - obr.3.6.6a. Nejčastějšími pozitronovými
radionuklidy, vznikajícími při vysokoenergetickém
ozařování tkáně, jsou: 11C (T1/2=20,3min.), 15O (T1/2=122s.) a v menší míře 10C (T1/2=19,3s.). Jelikož existuje určitá korelace
*) mezi radiační dávkou a indukovanou pozitronovou
radioaktivitou (či přímou emisí pozitronů a anihilačního
záření), umožňuje to scintigrafické monitorování
dávkové distribuce v ozařované tkáni pomocí PET -
"zviditelnit neviditelné", a to on-line, in
situ, nebo off-line s využitím vznikajících
pozitronových radionuklidů s ne příliš krátkým poločasem
(dolní části obr.3.6.6b,c).
*) Tato korelace může být negativní
i pozitivní, jak je znázorněno křivkami na
obr.3.6.6b,c. Závisí to na mechanismu reakcí a kinetické
bilanci ozařovacích částic a indukovaných
radioaktivních jader. U protonové terapie
vznikají zmíněné tři radionuklidy vyrážením neutronů z
jader uhlíku a kyslíku v oblasti s vysokou energií protonů,
před Braggovým maximem; korelace je negativní - největší
aktivita je indukována v oblasti nízkého LET, v oblasti
Braggova maxima není žádná (obr.3.6.6b). Při ozařování jádry
12C dochází ke strip-reakcím dvojího
druhu: 1. Z prolétajícího jádra 12C je stržen neutron,
čímž vzniká b+-radioaktivní 11C, které pokračuje
v letu a zastaví se v místě Braggova maxima - pozitivní
korelace mezi dávkou z 12C a indukovanou b+-radioaktivitou
(obr.3.6.6c). 2. Rychle letící jádro 12C vyrazí neutron z
uhlíkového či kyslíkového jádra v tkáni, čímž vzniká 11C, 15O nebo 10C, které zůstává
v místě svého vzniku (tedy mimo Braggovo maximum) - opět
negativní korelace. Pozitivní korelace mezi distribucí dávky
a intenzitou anihilačního g-záření je i v případě jaderné reakce antiprotonů
či pionů p- v
místě jejich zastavení (Braggově maximu).
Pro PET monitorování dávkové distribuce je vhodnější
případ pozitivní korelace, a to ještě za podmínky
dostatečně vysoké indukované b+-aktivity. U negativní dávkově-aktivitní korelace
jsou PET obrazy málo kvalitní, lze monitorovat jen průchod
svazku tkání mimo cílový objem (obr.3.6.6b dole); je
stručně diskutováno níže.
Pozn.:
b+-radioaktivní isotopy
jsou indukovány i při klasickém ozařování svazky g s energií
vyšší než cca 10MeV, avšak aktivity jsou velmi malé,
nedostačující ke gamagrafickému zobrazení.
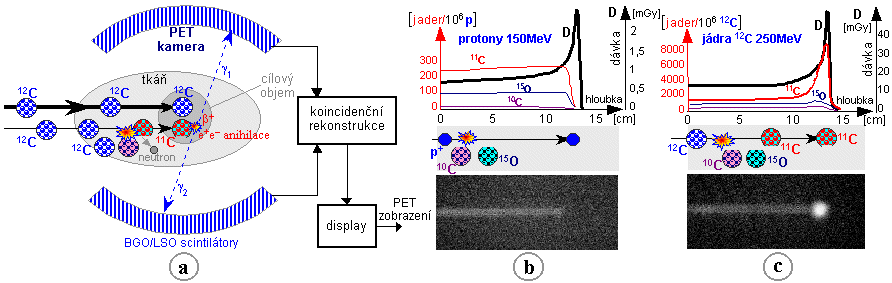
Obr.3.6.6. a) Možnost gamagrafického
"in-beam" monitorování hadronové radioterapie
pomocí pozitronové emisní tomografie. b)
Negativní korelace mezi distribucí dávky D a indukovanou b+-radioaktivitou u protonového svazku. c)
Pozitivní korelace mezi distribucí dávky D a indukovanou b+-radioaktivitou u ozařování urychlenými jádry
uhlíku.
Typickým příkladem
jaderných reakcí, umožňujících PET-monitorování s pozitivní
dávkovou korelací, je radioterapie urychlenými jádry
(ionty) uhlíku, kdy při jaderných reakcích
*) v tkáni z části jader 12C vznikají b+-radioaktivní jádra 11C, která pokračují
v letu a zastaví se, stejně jako základní jádra 12C, v místě Braggova
maxima (obr.3.6.6a,c). Gamagrafickým PET-zobrazením takto
indukované pozitronové radioaktivity získáme obraz
rozložení míst, v nichž se jádra 12C+11C zastavila a odevzdala maximum radiační dávky. PET
kamerou instalovanou na ozařovači tak můžeme monitorovat
rozložení dávky v cílové tkáni a v okolí - tím
kontrolovat průběh radioterapie podobně jako u metody IGRT (zmíněné výše). Tato metoda
se nazývá in-beam PET monitoring -
monitorování přímo v ozařovacím svazku
pomocí PET - obr.3.6.6a.
*) Uplatňují se zde především
"periferní" jaderné reakce, tzv. strip-reakce
(viz část "Mechanismy jaderných reakcí"
v §1.3 "Jaderné reakce"), při nichž je z letícího jádra 12C při interakci s
jádrem v tkáni odtržen neutron 12C ® 11C + n. Vzniká tím neutron-deficitní uhlíkové jádro
11C
(pokračující v pohybu), které je b+-radioaktivní: 11C ® 11B + e+ + n s poločasem T1/2=20,3min.; rozpadá se až po zastavení v místě
Braggova maxima. Následně dochází k anihilaci
pozitronu e+ s elektronem: e++e- ® 2g, přičemž tato dvě protisměrně se rozlétající
kvanta g
o energiích 511keV mohou být použita k PET
scintigrafii. Zobrazí se tím distribuce míst
zastavení jader 12C+11C, což jsou zároveň místa největší
radiační dávky v Braggově maximu. Vzhledem ke
krátkému poločasu rozpadu 11C musí být PET zobrazení provedeno bezprostředně po
hadronovém ozáření - buď přímo PET kamerou instalovanou v
ozařovně, nebo do několika minut na kameře v jiné místnosti
pracoviště.
U protonové
radioterapie vznikají radionuklidy 11C a 15O vyrážením
neutronů z jader uhlíku a kyslíku v oblastech, kde mají
protony vysokou energii, tj. ve vstupním svazku do vzdálenosti
cca 1-2cm před Braggovým maximem. Aktivovaná jádra
zůstávají "stát" na svých původních místech v
tkáni (nebo jsou odrážena jen do malých
vzdáleností). V oblasti nejvyšší
dávky je aktivace nulová (energie zpomalených protonů je
podprahová, nestačí k reakci). I zde mohou PET obrazy
poskytovat určitou informaci o dávkové distribuci, avšak mezi
absorbovanou dávkou a indukovanou aktivitou na PET obraze je negativní
korelace.
Scintigrafické zobrazení
PET je ostatně velmi vhodné i pro monitorování
biologické odezvy nádorové tkáně na radioterapii
obecně (jak na hadronovou, tak na konvenční se zářením g), neboť je
schopné monitorovat buněčnou aktivitu tkáně - rozlišit
zbylé (či recidivující) viabilní nádorové
buňky.
Pozitronové radionuklidy (11C, 15O, 13N, ...), produkované po dráze hadronového paprsku, tedy
mohou být měřeny pomocí PET kamery. I když tato technika je
vhodná pro dodatečnou úpravu a korekci ozařovacího svazku,
neumožňuje on-line monitorování v reálném čase. Může
být efektivní pro méně perfundované struktury (jako je
skelet), avšak u dobře perfundovaných tkání dochází k
rychlému biologickému vymývání a pohybu indukované
radioaktivity. Vzhledem k obecně nízké indukované aktivitě
je potřeba delší doby PET akvizice.
Hadron-gama-aktivační
analýza - promptní gama monitorování ozařovacího svazku
Při průchodu hadronového svazku ozařovanou tkání dochází
v určitém malém procentu i k interakcím s jádry ozařované
látky za vzniku excitovaných jader, které
vzápětí deexcitují emisí promptního gama-záření.
Další možností in-beam monitorování tedy je analýza tohoto
deexcitačního g-záření vznikajícího podél hadronového svazku.
Zkoušejí se scintilační gama-kamery se štěrbinovými
kolimátory, které poskytují 1-D projekci promptního
gama-záření podél dráhy protonových paprsků. Tato metoda
je vhodná pro monitorování v režimu tužkového svazku (pencil
beam), avšak není použitelná pro nepravidelně
tvarovaná pole v režimu rozptylovém, kde různé části pole
dosahují různé hloubky penetrace. .... ..........
Proton-bórová záchytová terapie
V poslední době se zkoumají možnosti dalšího zvýšení
efektivity protonové terapie k selektivní likvidaci
nádorových buněk s využitím jaderných reakcí
protonů s vhodnými látkami, inkorporovanými do nádorové
tkáně. Nejperspektivnější se jeví proton-bórová
záchytová terapie PBCT (Proton-Boron
Capture Therapy). Terapie tohoto druhu se
provádí ve dvou krocích :
1. V nádorovém ložisku se nejprve nechá vychytat
vhodná sloučenina obsahující atomy bóru,
isotopu 11B.
Lze k tomu využít zvýšený metabolismus nádorových buněk
oproti normálním buňkám. Aplikujeme-li i.v. např. glukózu s
chemicky navázanými atomy bóru - Bor-Deoxy-Glukózu
(je analogická známé Fluordeoxyglukóze 18FDG, používané v
PET scintigrafii), bude se zvýšeně
akumulovat v nádorových buňkách. Dalšími takovými
sloučeninami jsou merkaptododekarborát (BSH), či dihydroxyboralfenylalanin
(BPA). K chemickému navázání stačí používat přírodní
bór, který obsahuje 80% isotopu 11B a 20% isotopu 10B.
2. Takto předpřipravené nádorové ložisko, v jehož
buňkách je obsažen bór, se pak ozáří protonovým svazkem.
Při interakci protonů s jádry bóru dochází k jaderným
reakcím p + 11B
® 3a *), při nichž jsou emitovány tři alfa-částice
s průměrnou energií kolem 3MeV, celková uvolněná energie
má hodnotu Q=8,7MeV. Tyto alfa částice se okamžitě zabrzdí
cca 10 µm od místa reakce, takže vysoká ionizační energie
je předávána prakticky přímo uvnitř
příslušných nádorových buňek, které mohou být dvojzlomy
DNA efektivně likvidovány, bez radiačního
poškození okolních tkání.
*) Tato reakce probíhá 3-stupňově:
nejprve nastane záchyt - fúze protonu s jádrem bóru 11B za vzniku
excitovaného jádra uhlíku 12C*, které se okamžitě rozpadne na beryliun 8Be a alfa částici 4He, načež 8Be se promptně
rozštěpí na 2 alfa částice: p + 11B ® 12C* ® 8Be + 4He(3,8MeV) ; 8Be®4He+4He (2,4+2,4MeV). Sumárním výsledkem je emise tří
alfa částic: p + 11B ® 3a. Reakce má zvýšený účinný průžez 1,2 barn pro
energie protonů kolem 700keV, což dobře odpovídá zpomaleným
protonům v oblasti Braggova maxima. Při proton-bórové reakci
jsou též emitovány fotony gama s hlavním píkem 718keV,
které by v principu mohly být využity pro "in beam"
gamagrafické monitorování rozložení dávky z alfa-částic
podél protonového svazku v cílové tkáni a okolí; vzhledem k
nízké koncentraci bóru však toto slabé záření bude
obtížné detekovat na daleko silnějším pozadí
sekundárního záření vznikajícího při jaderných reakcích
protonů s jádry uhlíku a kyslíku v tkáni, především
anihilačního gama 511keV (obr.3.6.6).
Výsledkem takto
kombinované protonové terapie, "posílené"
sekundárními alfa-částicemi z jaderných reakcí, je
selektivně vyšší radiobiologická účinnost
oproti samotnému protovému svazku. Jedná se o molekulárně-biologicky
cílenou protonovou terapii. Signifikantní
zlepšení terapeutického efektu lze, díky hustě ionizujícím
alfa-částicím, očekávat zvláště u hypoxických a
radiorezistentních nádorů. Základní podmínkou úspěšnosti
této metody ovšem je dostatečně účinné a selektivní
vychytání bórové látky v cílové nádorové
tkáni.
Společné
aspekty hadronové radioterapie
Poněkud nezvykle znějící název "hadronová
terapie" vznikl proto, že se zde využívá
částic, které interagují silnou interakcí - tzv. hadronů
(viz §1.5, pasáž "Systematika elementárních částic", "Elementární
částice a jejich vlastnosti"
a 1.6). Při vlastním terapeutickém
účinku se zde však uplatňuje především elektromagnetická
interakce vedoucí k ionizaci látky; silná interakce se
projevuje u p, antiprotonové a neutronové či protonové
záchytové terapie. Pro dané použití je důležité to, že v
konečném důsledku se jedná o částice těžké
a elektricky nabité, s vysokými
radiobiologickými účinky a specifickou hloubkovou distribucí
radiační dávky. U terapie částicemi p-, neutrony či antiprotony lze s trochou nadsázky
říci, že na konci dráhy částice, uvnitř cílové
nádorové tkáně, dochází k jakési miniaturní "jaderné
explozi", jejíž energie účinně likviduje
nádorové buňky, s minimalizovaným radiačním poškozením
okolních tkání. I u protonové či iontové terapie lze
říci, že radiační dávka v určitém smyslu
"exploduje" v místě Braggova vrcholu, který by měl
být umístěn dovnitř nádoru.
Vztah dávky a
biologického účinku je i zde v zásadě dán standardním lineárně-kvadratickým
(LQ) modelem zmíněným výše (podrobně je analyzován v
§5.2, část "LQ model"),
od něhož se však vyskytují určité odchylky. Vedle druhé
mocniny je třeba zahrnout menší opravy obsahující i vyšší
mocniny dávky, mající svůj původ ve vícečetných
interakcích hustě ionizujícího záření se strukturou DNA.
Všechny shora
nastíněné "hadronové" metody - protonová
terapie (+ iontová, mionová či antiprotonová) a neutronová
záchytová terapie, zde uvádíme především proto,
že jsou velmi zajímavé z hlediska jaderné a
radiační fyziky. Do širší terapeutické praxe se
zatím propracovala jen protonová terapie, ostatní jsou zatím
ve stadiu laboratorního zkoušení.
Brachyradioterapie
Pro ozařování menších objemů cílové tkáně lze někdy s
výhodou použít tzv. brachyterapii *) - metodu
lokální radioterapie, při níž zdroj
záření má těsný kontakt s nádorovým
ložiskem. Podmínkou použitelnosti brachyterapie je mechanická
dostupnost léze. Do orgánů postižených
nádorovým onemocněním se radionuklidový zdroj záření zavádí
(punkcí či implantací) buď přímo do nádorového ložiska (intersticiálně),
nebo se intrakavitárně zavádí do tělesných dutin
(např. do dělohy), či intraluminárně do trubic,
příp. se přikládá na povrch nádoru (tzv. muláž).
*) Řecky brachys
= krátký - jedná se o ozařovaní z krátké
vzdálenosti, "na blízko", na rozdíl od teleterapie
jakožto ozařování "na dálku". Z tohoto hlediska
můžeme srovnat s terapií otevřenými radionuklidy,
která je "úplně na blízko" - na buněčné úrovni;
viz pojednání níže "Radioisotopová
terapie otevřenými zářiči - nejtěsnější
možná "brachyterapie".
Selektivní ozáření
nádorového ložiska je zde dosaženo tím, že intenzita
záření je nejvyšší v bezprostřední blízkosti
zářiče, zatímco ve větších vzdálenostech prudce
klesá - ve vakuu by to bylo přibližně s druhou
mocninou vzdálenosti, v tkáni je to ještě
rychlejší vzhledem k exponenciální absorbci
záření. Na nádorové ložisko je proto možné koncentrovat
značně vysokou dávku záření, většinou
bez nebezpečí závažnějšího poškození okolních zdravých
tkání.
Máme-li radionuklidový gama-zářič - radiofor
- poloměru r0 o aktivitě A [GBq], umístěný v tkáni s
absorpčním koeficientem m pro emitovanou energii gama-záření, pak výsledná intenzita
I gama-záření (a tím i dávkový
příkon D') v okolní tkáni ve
vzdálenosti r (> r0) bude dána součinem geometrické inverzní
kvadratické závislosti r -2 a absorpční exponenciální
závislosti :
D'(r) ~ I(r) = G . A/r2 . e-m.r , r > r0 .

Vlevo: Závislost intenzity gama
záření na vzdálenosti od bodového nebo sférického
radionuklidového zdroje aktivity A v látkovém
prostředí.
Vpravo: Scintilační záření
brachyterapeutického radioforu 192Ir (aktivity 400 GBq) ponořeného do baňky s kapalným scintilátorem.
Pro r < r0 - uvnitř zdroje - je průběh radiační
intenzity odlišný, závislý na konstrukci, materiálu a
distribuci radioaktivity uvnitř radioforu (toto
se však v brachyterapii neuplatňuje).
Zpočátku, pro blízké vzdálenosti vně zdroje, převládá
kvadratický pokles, ve větších vzdálenostech je
výraznější pokles exponenciální (zeslabení
záření v tkáni).
Z časového hlediska se brachyterapie dělí na dočasnou
a trvalou (permanentní) brachyterapii :
Dočasná
brachyterapie
Uzavřené radionuklidové zářiče delšího poločasu - radiofory
- jsou do cílové tkáně zavedeny na určitou stanovenou
dobu T. Této době aplikace je pak úměrná radiační
dávka D - zjednodušeně vyjádřeno: D ~ G.A.T, kde G je radiační
dávková konstanta pro daný druh záření resp. radionuklidu, A
je aktivita radioforu (kterou vzhledem k
dlouhému poločasu rozpadu radionuklidu můžeme po dobu
poměrně krátké expozice považovat za konstantní).
Jako zdroj záření pro brachyradioterapii se dlouhou dobu
používalo rádium 226Ra (a-rozpad, T1/2 1602let), jehož
rozpadové produkty (jako je 214Pb, 214Bi, 214Po, ...) jsou gama-zářiči. Rádium mělo některé
nevýhody, např. při jeho rozpadu vzniká radon, dále nízká
intenzita g-záření vedoucí k dlouhým expozičním dobám (cca
2 dny) - jednalo se o LDR brachyterapii (Low
Dose Rate - nízký dávkový příkon, <2Gy/hod.). Proto
se rádium postupně nahradilo některými jinými umělými
radioisotopy: kobalt 60Co, cesium 137Cs a především iridium 192Ir. Při
dostatečně vysokých aktivitách radiforů (cca 400GBq,
většinou 192Ir) se expoziční doba zkracuje i na desítky minut - HDR
brachyterapie (High Dose Rate - vysoký dávkový příkon,
>10Gy/hod.). Ojediněle se používá
tzv. pulzní brachyterapie PDR (Pulsed
Dose Rate), při níž je radiační dávka dodávána frakcionovaně
během jedné brachyterapeutické aplikace: radiofor se pohybuje
v sekvenci opakujících se kroků - v "pulsech".
Experimentálně se používají i neutronové radiofory
(především s kaliforniem 252Cf), kde neutronové záření má vysoké LET -
vyšší hustota ionizace a silnější radiobilogický účinek
(i na hypoxické tumory).
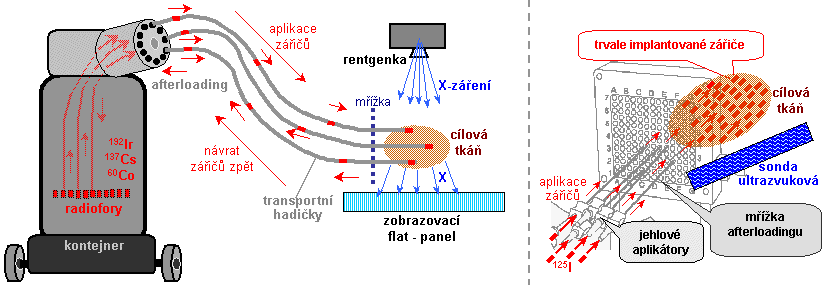
Obr.3.6.7. Dvě základní techniky brachyradioterapie.
Vlevo: Při dočasné brachyterapii jsou z
otvorů hlavice stíněného boxu afterloadingu zářiče vedeny
hadičkami do cílové oblasti a po expozici zase vraceny zpět
do kontejneru. Vpravo: Při permanentní
intersticiální brachyterapii jsou drobné radiofory pomocí
aplikátorů trvale implantovány do cílové tkáně.
Zářiče, neboli radiofory,
pro brachyterapii jsou uzavřené zapouzdřené
radioisotopy, jejichž obaly mají tvar jehel, tub, drátů či
válečků. Významné zdokonalení techniky brachyterapie
představuje tzv. afterloading (angl. afterloading = dodatečné zatížení,
zavedení): do cílové oblasti či
tělesné dutiny se nejprve zavede neaktivní
trubička či hadička - aplikátor, která se
přesně nastaví (za pomoci značky či
"makety" radioforu, zavedené na konec aplikační
hadičky). Pro přesné nastavení, jakož
i pro plánování dávkové distribuce, se provádí navigace
rtg zobrazením (nejčastěji C-rameno, min. 2 kolmé projekce
pro získání prostorově-volumového obrazu), popř. CT,
ultrasonografie či NMRI. Do této trubičky se pak na stanovenou
dobu zavádí vlastní zářič - radiofor -
tvaru malého válečku (upevněný na vodící drátek), který
se po skončení expozice vrací zpět do stíněného boxu.
Dřívější manuální afterloading byl nyní nahrazem
automatickým afterloadingem, při němž jsou zářiče
zaváděny a vraceny zpět pomocí elektronicky řízených
motorků. Stíněný kontejner může obsahovat
větší počet radioforů *), které lze zavádět buď
postupně nebo současně do různých transportních cest -
obr.3.6.7 vlevo.
*) Na ideovém schématu v levé části
obr.3.6.7 jsou pro obecnost znázorněny všechny možnosti.
Současné přístroje HDR afterloadingu však obsahují
zpravidla jen jeden silnější zdroj 192Ir. Je to z
ekonomických a technických důvodů: zářiče jsou drahé a
rozpadají se (je třeba je obměňovat); mechanismus pro
současné zavádění více zářičů je technicky
komplikovaný. Tento intenzívní radiofor se v případě
potřeby postupně zavádí do různých
transportních cest k dosažení požadované dávkové
distribuce v cílovém objemu, do něhož jsou jednotlivé
aplikátory zavedeny; toto zavádění je dostatečně rychlé.
Pro přesné rovnoměrné zavedení aplikátorů v požadované
geometrii podle ozařovacího plánu se někdy používá
speciální mřížková šablona (template),
podobná jako je schématicky znázorněná v pravé části
obr.3.6.7.
Ve srovnání s manuální aplikací radioforů má automatický
afterloading dvě zásadní přednosti :
- Výrazně snižuje (či dokonce zcela eliminuje)
radiační zátěž pracovníků při provádění
brachyradioterapie.
- Pohybem zdrojů v aplikátoru řídíme čas,
po který se zdroj nachází v určitých pozicích,
čímž dosahujeme požadované distribuce radiační
dávky v cílovém objemu. Touto řízenou modulací
dávkové distribuce automatický afterloading podstatně
zpřesňuje terapeutický efekt.
Perspektivními zářiči
pro brachyterapii by mohly být miniaturní elektronické
rentgenové zdroje (pracuje se na vývoji laserových
mikro-rentgenek) s nastavitelným dávkovým příkonem a
volitelnou efektivní energií X-záření. Měly by též
výhodu v lepší radiační bezpečnosti a nepřítomnosti
radioaktivního odpadu.
Radiobiologický
účinek brachyterapie lze popsat obecným lineárně-kvadratickým
(LQ) modelem (uvedeným výše v pasáži "Závislost
radiačně biologického účinku na dávce a jejím časovém
rozvržení"), ovšem při zahrnutí specifických
faktorů prostorové a časové distribuce dávky u různých
druhů brachyterapie :
l HDR brachyterapie, při níž
jednotlivé aplikace trvají několik minut (až desítky minut),
se z hlediska časové distribuce dávky podobá frakcionované
zevní radioterapii EBRT. Reparace během frakce se
neuplatňuje, faktor dávkového příkonu je zanedbatelný.
Může se však projevit buněčná repopulace
nádorových buněk mezi jednotlivými frakcemi, celková doba
léčby je poměrně dlouhá. Pro HDR terapii nádorové tkáně
s koeficienty a,b a zdvojovacím poločasem repopulace T2r, s celkovou dávkou D
rozdělenou na frakce d během celkové doby léčby T,
vychází pro biologickou efektivní dávku BED z LQ
modelu (bez reparace, ale s repopulací) vztah: BED = D.[1+D/(a/b)] - T.ln2/(a.T2r).
l U LDR
brachyterapie, při níž probíhá kontinuální
expozice nízkým dávkovým příkonem s poměrně krátkou
celkovou dobou léčby, je výrazně omezená repopulace
nádorových buněk (probíhá konstantní dávkový příkon do
cílového objemu). Pro LDR expozici nádorové tkáně s
koeficienty a,b a rychlostní konstantou reparace l, s dávkovým příkonem R
a časem T, vychází pro biologickou efektivní
dávku BED z LQ modelu (s reparací, ale bez repopulace)
zjednodušený vztah: BED = R.T.[1+2R/(l.(a/b)].(1-1/l.T). Případ permanentní LDR brachyterapie je
rozebrán níže :
Permanentní brachyterapie
U této metody jsou zářiče o kratším poločasu (dny až
desítky dnů) zavedeny do cílové tkáně trvale
a působí dlouhodobě až do svého rozpadu a vyzáření.
Dávkový příkon R klesá exponenciálně s poločasem
rozpadu T1/2 použitého radionuklidu: R(t) ~ G.A(t) = G.Ao.e-(ln2/T1/2).t,
celková radiační dávka je dána časovým integrálem D ~ G.0ňĄA(t)dt = G.0ňĄAo.e-(ln2/T1/2).tdt ~ G.Ao.T1/2. Celková
radiační dávka je tedy dána počáteční aplikovanou aktivitou
Ao
implantovaných zářičů.
Radiobiologický účinek je obecně
vyjádřen rovnicí LQ modelu (uvedenou výše v pasáži "Závislost radiačně biologického
účinku na dávce a jejím časovém rozvržení") obsahující časové faktory buněčné
reparace a repopulace. V počátečních stádiích permanentní
brachyterapie prakticky nedochází k buněčné repopulaci v
důsledku neustále dodávaného dostatečně vysokého
dávkového příkonu. Z takto redukované rovnice LQ modelu (s
reparací, ale bez repopulace) pak plyne pro biologickou
efektivní dávku BED při permanentní brachyterapii
nádorové tkáně s koeficienty a,b a rychlostní konstantou
reparace l, pomocí radioforu o poločasu rozpadu T1/2 a počátečním
dávkovém příkonu Ro, zjednodušený vztah: BED = Ro.(T1/2/ln2).{1+Ro/[(l+ln2/T1/2).(a/b)]}. Počáteční dávkový příkon je zde úměrný
počáteční aplikované aktivitě: Ro ~ G.Ao.
Díky exponenciálnímu poklesu dávkového příkonu s
časem je radiační účinek nejvyšší v počáteční fázi.
Po uplynutí cca 3-4 poločasů poklesne dávkový příkon
natolik, že reparační mechanismy buněk stačí příslušné
změny eliminovat - deterministické radiační účinky vymizí,
pokračující (a stále slábnoucí) radiační dávka je již
terapeuticky neúčinná *) a "zbytečná" ("wasted dose" - "odpadní" či
"jalová" dávka) - srov. s diskusí efektu dávkového příkonu
v §5.2., část "LQ
model".
*) Podíl neúčinné (zbytečné) dávky
může být poněkud nižší (a terapeutický efekt tím
přiměřeně vyšší), než by vyplývalo z LQ modelu, v
důsledku dvou okolností:
1. Pokud během iradiace dochází k regresi
tumoru, může se nádorová tkáň "scvrkávat" a
zbylé nádorové buňky se dostanou do větší blízkosti
radioforů, čímž se na ně zvýší dávkový příkon.
2. Pokud existuje hypersenzitivita k
nízkým dávkám (viz §5.2, část"LQ
model", pasáž "Odchylky od
LQ modelu", obr.5.2.4c), mohou deterministické radiační
účinky skrytě pokračovat i při nízkých dávkách.
Permanentní
intersticiální brachyterapie spočívá v implantaci
většího počtu (několik desítek) drobných radioforů
pomocí vhodných jehlových aplikátorů
manuálního afterloadingu (pod rtg nebo ultrazvukovou
kontrolou), příp. s použitím šablony tvaru
pravidelné mřížky (template),
přímo do cílové tkáně - obr.3.6.7 vpravo. Používají se
např. zrna *) obsahující radiojód 125I (g 35keV, X 27keV),
každé o aktivitě cca 10-20MBq, nebo 103Pd (X 21keV), příp. 131Cs (X 33keV). Zlato 198Au má sice krátký
poločas 2,7dne, ale příliš vysokou energii g 412keV, proto se
již nepoužívá. Ozařování je
poměrně dlouhodobé (poločas rozpadu 125I je 60dní, 103Pd má T1/2=17dní, u 131Cs je T1/2 9,7dne), z hlediska
dávkového příkonu se jedná o LDR (či dokonce VLDR
- Very Low Dose Rate) brachyterapii, přičemž vzhledem k
nízké energii fotonového záření je radiační zátěž
okolí minimální, prakticky veškeré záření se absorbuje v
tkáni. Metoda je vhodná pro pomalu rostoucí nádory,
používá se především u karcinomu prostaty. Pro
ozařování malých ložisek ve složitějších strukturách,
např. v oftalmologii, se vedle 125I používají i beta-zářiče jako je 106Ru(®106Rh, poločas 174dní, max. energie 3,5MeV).
*) Několik zrn radioforu může být
spojeno dohromady pomocí speciálního vlákna (tzv. strand).
Při postupném vysunování z jehlového aplikátoru se zrna
uspořádají lineárně ve stejné vzdálenosti, což
zajišťuje homogennější prozáření cílové oblasti a též
zabraňuje individuálním posunům (migraci) jednotlivých zrn v
cílové tkáni, nebo dokonce jejich úniku mimo cílovou tkáň.
I pro
brachyterapii jsou v současné době používány počítačové
plánovací systémy (i když ne tak komplikované jako
u IGRT), které na základě snímků polohy zdroje
(simulovaného značkami v aplikátoru afterloadingu) stanoví
dávkovou distribuci v cílové tkáni a řídícímu systému
afterloadingu určí časy a pohyby zdroje (popř. aktivity a
polohy trvale aplikovaných radioforů) takové, aby v
ozařovaném cílovém objemu byla dosažena požadovaná dávková
distribuce. K účinnějšímu
prozáření nádorové tkáně by částečně mohl přispívat
i tzv. bystander efekt (viz §5.2 "Biologické účinky ionizujícího
záření", pasáž "Bystander-Abscopal efekt"), který by snad mohl poněkud korigovat vliv
mírných nehomogenit v prozáření nádorové tkáně -
zvyšovat účinek v podexponovaných částech cílové tkáně.
| Nádorová terapie: ionizující
záření - nebo chemie ? |
V
současné době je zde terapeutické využití
ionizujícího záření velmi důležité a přínosné.
Tato metoda však zasahuje až následky,
ale neřeší příčiny onemocnění.
Záření se v organismu též často chová
jak "slon v porcelánu"
!
Lze doufat, že budoucnost léčby
nádorových onemocnění bude spočívat spíše v
pokročilých chemických, biochemických a
imunologických metodách - na buněčné a
molekulární úrovni. |
Radioisotopová
terapie otevřenými zářiči - nejtěsnější
možná "brachyterapie"
Aplikujeme-li do organismu radioaktivní látku,
vstoupí do metabolického procesu způsobem,
který je dán chemickou formou látky - její biodistribucí,
farmakokinetikou. Podaří-li se nám označit vhodným
radionuklidem látku, která se selektivně vychytává
a akumuluje v nádorové tkáni, můžeme dostat
velmi efektivní způsob radiační likvidace tumoru:
radionuklidem emitované ionizující záření napadá buňky
"zevnitř". Pro radioisotopovou
terapii jsou vhodné radionuklidy emitující záření beta
nebo alfa s krátkým dosahem v tkáni (max.
milimetry), které má lokálně silné radiobiologické účinky
a přitom nedosahuje do okolních zdravých tkání. Těmito
radionuklidy se značí (konjugují) terapeutická
radiofarmaka. Radionuklid beta či alfa dodává
biologicky účinnou dávku záření selektivně do
akumulujících nádorových buněk a okolního mikroprostředí.
Z hlediska výše uvedeného členění metod radioterapie (podle způsobu "zacílení" radiační dávky
do postižené tkáně) je radioterapie
pomocí otevřených radionuklidů možno
označit za nejtěsnější možnou brachyterapii
(permanentní) -
přímo na buněčné úrovni.
Vzhledem ke svým fyzikálním, chemickým a
biologickým specifikům však tato cílená terapie otevřenými
radionuklidovými zářiči tvoří samostatnou
radioterapeutickou kategorii a provádí se většinou na
pracovištích nukleární medicíny. Nazývá se biologicky
cílená radionuklidová terapie BTRT (biologically
targeted radionuclide therapy) nebo molekulární
radioterapie, někdy též endoradioterapie.
Pro většinu nádorových procesů bohužel zatím takovou vhodnou
látku nemáme; níže bude ukázáno, kdy takovou
radioaktivní látku aspoň částečně "máme"
a jak ji lze použít pro účinnou radionuklidovou terapii.
Aplikace otevřených radionuklidů se používá i pro nenádorovou
terapii u hypertyreózy a v radionuklidové synovektomii
(viz níže "Thyroid terapie" a "Radionuklidová synovektomie").
Metodický přístup je zde zcela odlišný od
zevní terapie i brachyterapie. Při klasické radioterapii
externími svazky záření potřebujeme přesně znát lokalizaci
a rozsah nádorového ložiska, které pak ozáříme přesně
směrovanými svazky záření, nebo umístíme do blízkosti
léze brachyterapeutický radiofor (obr.3.6.8
vlevo). Při radioisotopové terapii
potřebujeme znát biologické (biochemické,
farmakokinetické) vlastnosti nádorové
tkáně, podle nichž aplikujeme do metabolického prostředí
organismu vhodné radiofarmakum (obr.3.6.8 vlevo), které se
dostane dovnitř nádorového ložiska (vychytá
se tam biologicky mechanismem ligand -> receptor,
nebo na základě specifické metabolické aktivity buněk) a svou radiací likviduje nádorové buňky "zevnitř"
(obr.3.6.8 vpravo). Potřebné
selektivní nahromadění radiofarmaka v cílové tkáni se
dosahuje dvěma hlavními způsoby :
--> Navázáním značených ligandů
na receptory na povrchu buněk. Pro terapii
lymfomů se používají monoklonální protilátky jako
je ibritumomab tiuxetan (anti-CD20,
značený 90Y - Zevalin), tositumomab
(anti-CD20, značený 131I - Bexxar), tetraxetan-tetulomab
(anti-CD37, značený 177Lu - Lilotomab) - níže "Radioimunoterapie
lymfomů". U
neuroendokrinních nádorů se používají peptidové somatostatinové
ligandy (značené 90Y, nověji 177Lu.) - níže "Neuroendokrinní
nádory".
Jako nejdůležitější se jeví ligandy PSMA (značené 177Lu nebo 225Ac) u metastatického ca prostaty (níže "Karcinom prostaty"). Značená látka se selektivně váže v místech s
vysokou hustotou příslušných receptorů a po navázání na
receptor internalizuje.
--> Začlenění radiofarmaka do buňek na
základě jejich specifické metabolické aktivity.
Tak je tomu u vychytávání radiojódu 131I buňkami štítné
žlázy, včetně metastáz diferencovaného thyroid. karcinomu.
Tyto mechanismy selektivního začlenění do
buněk vedou k akumulaci radionuklidu v tumoru a emisi biologicky
účinného ionizujícího záření.
-->
Okrajově se používají
jednoduché metody přímé lokální aplikace
radiofarmaka, především do kloubních dutin ("Radionuklidová synovektomie"), které však nemají charakter biologicky cílené
terapie.
Lokalizaci nádorového
ložiska v podstatě znát nemusíme, radiofarmakum se může
vychytat i v ložiscích o nichž zatím nevíme (např. mikrometastázy) - "najde
si je samo"! Tato cílená terapie tedy používá k
likvidaci nádorových buněk radionuklidy, které jsou
navázány na vhodný "transportér",
jehož úkolem je selektivně dopravit do
cílové tkáně dostatečné množství radionuklidu, aby dávka
emitovaného záření zahubila nádorové buňky, přičemž
ostatní zdravé tkáně a orgány by byly poškozeny co
nejméně - aby nebyla nevratně ohrožena jejich funkčnost (v souladu s výše deklarovaným obecným
"strategickým cílem" radioterapie "Strategický cíl a metody
radioterapie").
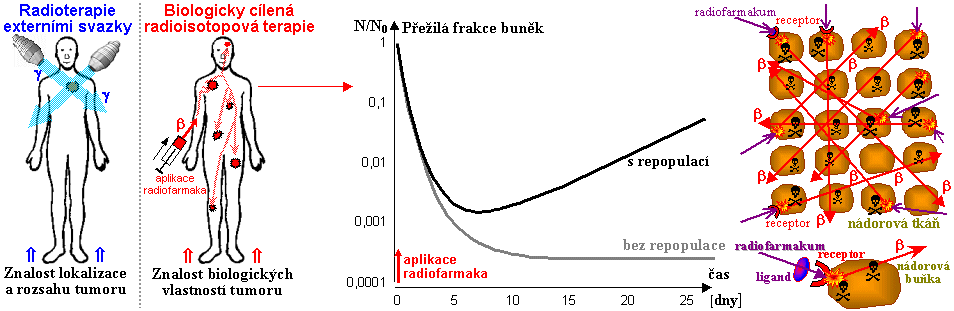
Obr.3.6.8. Biologicky cílená radionuklidová
terapie ("molekulární radioterapie").
Vlevo: Srovnání
metodického přístupu externí radioterapie a radioisotopové
terapie. Uprostřed: Časová
závislost přežilé frakce buněk v tumoru při radioisotopové
terapii. Vpravo: Efekt
"křížové palby" tvrdého záření b na nádorové
buňky.
Biologicky cílená
radionuklidová - radiofarmaceutická - terapie
poskytuje několik výhod oproti jiným
léčebným přístupům v onkologii. Na rozdíl od klasické
radioterapie ("Radioterapie") se záření do těla
neaplikuje z vnějku (problém
přesně se "trefit" do známých lézí a nemožnost
terapie skrytých lézí, radiační zasahování zdravých
tkání), ale dodává se systémově
biochemickou cestou, podobně jako u chemoterapie nebo
biologické léčby ("Chemoterapie", "Biolog Terapie"). Mohou se specificky vychytávat i v neznámých
mikrometastázách či dokonce v jednotlivých izolovaných
buňkách (třebas v krevním oběhu). Na rozdíl od chemické a biologické terapie
nosičové biochemické molekuly nepůsobí přímo, ale jen
dopravují atomy radionuklidu, jehož vysoké cytotoxické
účinky po vychytání již nejsou závislé na variabilitě
signálních drah (s příp. mutacemi).
Podstatnou výhodou je možnost vizualizovat
biodistribuci radionuklidů - pomocí gamagrafických
metod zobrazit žádoucí akumulaci radiofarmaka v cílových
tkáních i nežádoucí vychytání ve zdravých tkáních a
orgánech. Tato možnost je dokonale využita v koncepci teranostiky
(podrobněji popsané v §4.9, pasáž
"Kombinace diagnostiky a terapie -
teranostika"), kombinující diagnostické zobrazování s biologicky
cílenou terapií. Tato analýza diagnostiky a terapie u
individuálního pacienta umožňuje určit, zda příslušná
terapie bude účinná, a to ještě před jejím zahájením. A
na základě dozimetrické analýzy distribuce radiofarmaka v
cílových tkáních a zdravých kritických tkáních určit
optimální dávku - aktivitu. Je tím dosaženo precizního
induvidualizovaného přístupu k radionuklidové terapii.
Ve srovnání s ostatními metodami systémové
terapie, biologicky cílená radionuklidová terapie v
indikovaných případech vykazuje dobrou účinnost s
minimální toxicitou. Bohužel je zatím málo známá v
širší onkologické komunitě, takže není nasazována buď
vůbec, nebo až jako modalita poslední volby, když
již všechny jiné metody selhaly. A to již může být trochu
pozdě, u pacientů "zdecimovaných" předchozí
neúpěšnou léčbou (i když i zde se
vyskytují případy dosažení téměř úplné remise u
infaustních pacientů v terminálním stádiu...).
Fyzikální a biologické
faktory
Podobně jako u externí radioterapie, i u radionuklidové
terapie se patřičného účinku dosahuje koprodukcí dvou
základních faktorů :
--> Fyzikální faktory
- druh radionuklidu, druh emitovaného záření (a,b,g) a jeho
energie, poločas rozpadu.
Pro terapii otevřenými radionuklidy je vhodné
pouze záření s malou pronikavostí (krátkým
doletem), především záření beta (jehož dosah v tkáni je zpravidla menší než 5mm), popř. Augerovy elektrony (s velmi krátkým doletem řádu nanometrů), nebo záření alfa (rovněž krátký dolet desítek mikrometrů). Krátký dolet emitovaného záření
v tkáni zajišťuje, že prakticky veškerá energie se deponuje
v cílovém objemu a účinek záření je tak lokalizován
na orgán či oblast tkáně, v níž se radioaktivní látka
vychytala *), s minimálním poškozením okolních zdravých
tkání.
*) K radiační zátěži dalších tkání
a orgánů však může docházet vlivem částečného nežádoucího
vychytávání použitého radiofarmaka v těchto
tkáních a při metabolickém zpracování a clearanci
radiofarmaka (krevní cestou, močovými cestami či GIT).

Tab.3.6.1. Některé radionuklidy, vhodné pro biologicky
cílenou terapii (jejich vlastnosti a použití budou popsány
níže).
Dosah (dolet) záření v tkáni závisí na druhu a energii
příslušných kvant. U záření b
je maximální dosah dán maximální energií
ve spojitém spektru; tuto energii má však jen malé procento
elektronů b. Důležitější je zde střední dosah,
který představuje asi 1/3 max. doletu - je dán střední
energií ve spektru b (§1.2, část "Radioaktivita beta"). U záření a,
pokud je "monochromatické", není prakticky rozdíl
mezi maximálním a středním doletem (rozdíl je jen tehdy,
když jsou emitovány dvě či více linií alfa s výrazně
různými energiemi).
Radionuklidy jsou v tabulce seřazeny podle
dosahu, který mají v tkáni příslušná radiobiologicky
nejúčinnější kvanta, alfa či beta.
Terapeutické beta či alfa radionuklidy by
měly splňovat několik kritérií :
l
Nuklid by měl mít vysoký poměr korpuskulární emise
beta či alfa a nízkou složku gama.
l
Poločas rozpadu by měl odpovídat biologické kinetice
cílového ligandu. Efektivní poločas radiofarmaka, který je
výsledkem fyzikálního poločasu nuklidu a poločasu
biologické eliminace ligandu, pak určuje dobu terapie (či její frakce).
l
Pokud je dceřinný nuklid též radioaktivní -
radionuklid se rozpadá přeměnovou řadou ("In vivo
generátory" v nukleární medicíně), rozpadový řetězec by neměl
obsahovat meziprodukty s dlouhým poločasem (které by se mohly uvolňovat z cílové léze a
způsobovat radiační zátěž zdravých tkání - podrobněji
je diskutováno níže v pasáži "Alfa a beta radionuklidy pro terapii").
l
Atomy radionuklidu by měly být schopné tvořit stabilní
sloučeniny či konjugáty s potřebnými
biomolekulami - radioligandy (obr.3.6.10 a).
Cílem radionuklidové terapie je inaktivace a likvidace
nádorových buněk apoptózou vyvolanou ionizačními
dvojvláknovými zlomy DNA. Pro dvouvláknový zlom způsobený
jednou částicí je zapotřebí LET přibližně 100-200
keV/mikrometr, což umožňují alfa částice schopné
vytvářet husté ionizační stopy. Pro
řidčeji ionizující záření beta pak dostatečně vysoká
intenzita (fluence) kvant, způsobující rychlé zlomy
vláken na různých místech DNA (rychlejší,
než aby je buněčné reparační mechanismy stačily opravit).
--> Biologické a
radiobiologické faktory
- radiosenzitivita patologických buněk ve srovnání s buňkami
zdravých tkání a orgánů, farmakokinetika terapeutických
radiofarmak (jejich vychytávání v cílových tkáních a v
ostatních tkáních). Základním požadavkem je vysoká
akumulace v cílových tkáních a nízká
akumulace ve zdravých tkáních.
Biokinetiku terapeutických radiofarmak lze do
určité míry ovlivnit farmakologicky (např.
vysazením TSH či aplikací thyrogenu u štítné žlázy, nebo
aplikací rituximabu u lymfomů).
Internalizace a externalizace radiofarmaka v
buňkách
Míra akumulace radiofarmaka v cílové tkáni je jistě tím
základním parametrem rozhodujícím o úspěšnosti terapie.
Účinnost terapie však závisí i na mechanismech transportu
radiofarmak do nádorových buněk - jejich internalizaci
uvnitř - a průniku ven z těchto buněk - externalizaci.
Internalizace makromolekul je zprostředkována buněčnými
receptory nebo endocytózou buněčné membrány. Když ligand
aktivuje receptor na buněčné membráně, který je asociován
s G-proteinem na vnitřní straně membrány, jsou receptory
spolu s ligandy fosforylovány a internalizovány dovnitř
buňky. Nejprve vytvoří tzv. endozom, který potom
zfúzuje s lysozomem a dojde k rozkladu ligandu.
Degradační protukty, včetně radioaktivního atomu, pak po
určitou dobu zůstávají v lysozomech a mohou působit
ionizujícím zářením. U metabolické akumulace (jako je radiojód v buňkách štítné žlázy) je doba internalizace dána rychlostí tvorby
výsledných metabolitů a jejich exkrece z buněk do krevního
oběhu.
Po určité době se atomy terapeutického
radionuklidu, či jeho dceřinného isotopu, vylučují z buněk
- externalizace a vstupují do krevního oběhu. Další
osud externalizovaného radiofarmaka pak závisí na jeho
(bio)chemickém složení. Obecně se vylučuje především
ledvinami, v menší míře GIT.
Pro účinnou radionuklidovou terapiii je
žádoucí rychlá internalizace a opožděná
externalizace.
Internalizace a externalizace má specifický
význam u radiofarmak značených alfa-radionuklidy s řetězovou
rozpadovou řadou - je diskutováno
níže v pasáži "In vivo radionuklidové
generátory".
Fyzikálně-radiobiologické efekty
Při biologicky cílené radionuklidové terapii je tedy
základním požadavkem vytvoření takové radionuklidově
značené látky, která by se pokud možno selektivně
vychytávala v daných nádorových lézích, avšak co
nejméně by pronikala do zdravých buněk, tkání, rizikových
- kritických orgánů. Avšak i tehdy, když se
radioterapeutický preparát úspěšně vychytá v nádorových
buňkách, mohou vzniknout další dva problémy související s
velikostí cílových lézí :
-->
Heterogenita velkých nádorových
ložisek, jejichž buňky vychytávají radiofarmakum v různých
místech s rozdílnou účinností, někdy vůbec. Pro tyto
objemné a heterogenní nádorové léze je vhodné použít
radionuklid s vysokou energií záření b (jako je 90Y s max. energií
2,3MeV a dosahem v tkáni cca 5mm, což představuje zhruba
100-200 buněčných průměrů) pro tzv. efekt
"křížové palby" (cross-fire effect):
toto záření dokáže zničit i ty nádorové buňky, které
nejsou v přímém kontaktu s navázaným radiofarmakem (buňky jež nemají příslušné receptory, nebo k nim
radiofarmakum uvnitř nádoru nepronikne).
Tyto buňky se dostanou do "křížové palby" tvrdého
záření z radionuklidu, navázaného na okolní buňky (je znázorněno na obr.3.6.8 vpravo). Částice beta- emitované např. 90Y (průměrná energie 933keV) jsou účinnější proti
velkým nádorům cca 3-5 cm.
Pro eradikaci nádorových ložisek menších
rozměrů cca 1-3 mm, nebo nádory infiltrující do normálních
tkání v difuzní (rozptýlené) formě, by však tento efekt
mohl způsobovat únik energie z nádorové léze a zvýšenou
radiační zátěž okolních zdravých buněk. Zde jsou naopak
vhodné radionuklidy s nižší energií
záření b, jako je 177Lu s max. dosahem v tkáni cca 2mm, nebo
alfa-radionuklidy. Kratší pronikání záření 177Lu, vychytaného v
nádorových buňkách, do okolních tkání může vést k
příznivějšímu poměru účinku tumor/zdravá tkáň.
-->
Únik částic-energie z malých nádorů,
mikrometastáz nebo jednotlivých izolovaných nádorových
buněk. U mikro-lézí či osamocených buněk je účinnost
emitovaného beta-záření středních energií malá, většina
částic beta nestačí interagovat a odlétá pryč
mimo lézi, bez účinku. Tato mikro-ložiska
pak mohou být nedostatečně eradikována a mohou být později
zdrojem recidivy. Zde mohou být účinným terapeutickým
prostředkem alfa-částice (s energií ~4-9MeV
a vysokým LET ~100-300 keV/mikrometr). Vzhledem k jejich krátké
délce dráhy v tkáni cca 40-100 mikrometrů, činící
jen ~1-3 průměrů buněk, mohou být účinné i u malých
lézí a mikrometastáz submilimetrových velikostí,
nebo dokonce u izolovaných osamocených nádorových
buněk. Pokud se do nich alfa částice dostanou, mohou
vysokou hustotou ionizace způsobit neopravitelné zlomy DNA.
Podobný účinek mohou mít i nízkoenergetické konverzní a
Augerovy elektrony.
Pro nádorová onemocnění zahrnující větší
i menší tumory se zkouší tzv. tandemová terapie
90Y - 177Lu, nebo 177Lu - 225Ac, popř. "koktejl"
současně podaných radiofarmak značených vysoko- a
nízkoenergetickým beta radionuklidem, či alfa-radionuklidem (srov. níže "Alfa a beta radionuklidy
pro terapii").
K účinku radioisotopové terapie může dále
přispět radiačně indukovaný biologický bystander
efekt (popsaný v §5.2, část
"Účinek záření na buňky", pasáž "Bystander-Abscopal efekt"), díky němuž dochází k
poškození nejen buněk přímo zářením zasažených, ale i
některých okolních buněk, které nebyly přímo ozářeny.
Mohou tak být eliminovány i některé buňky, které
radiofakmakum nevychytaly. V pozdních stádiích radionuklidové
terapie, kdy jsou radiační dávky již nízké, může
biologickou účinnost zvýšit efekt hyper-radiosenzitivity
k nízkým dávkám záření (§5.2,
část"LQ model",
pasáž "Odchylky od LQ modelu", obr.5.2.4c). Snižuje se tak podíl "zbytečné odpadní
dávky" (wasted dose) v pozdních stádiích terapie.
 |
Obr.3.6.9 Schématické porovnání
účinků beta a alfa záření na DNA.
Nahoře:
Elektrony beta s nízkou hustotou ionizace způsobují v
DNA převážně jednoduché zlomy, které si buňka
dokáže opravit. Pro vyvolání apoptózy je potřeba
větší počet jednoduchých zlomů.
Dole:
Částice alfa s vysokou hustotou ionizace vyvolávají v
DNA dvojité zlomy, které zpravidla vyústí ve smrt
buňky apoptózou. |
Alfa a beta radionuklidy
pro terapii
Pro radioisotopovou terapii se zatím používají převážně beta-radionuklidy
(střední a dolní část Tab.3.6.1) - bylo diskutováno výše. V poslední době se zde
však stále více uplatňují i radionuklidy alfa
(horní část Tabulky 3.6.1), jejichž radiace má vysoký LET - vysokou
hustotu ionizace - pro vytváření dvojných
zlomů DNA, což vede k vysoké radiobiologické
účinnosti zabíjení buněk. U alfa radiofarmak přitom
dochází k uvolnění vysoké radiační energie ve velmi malém
objemu, což vede k nižší radiační zátěži okolních
tkání. Srovnáme-li a- a b- emitující radionuklidy z hlediska použití pro
biologicky cílenou terapii, můžeme zdůraznit následující
rozdíly :
¨ Hmotnost
a-částic
je cca 7000-krát větší než b-částic.
¨ Energie
a-částic
je »
10-30-krát větší než b-částic: alfa typicky 4-8MeV, beta cca 0,2-2,25MeV.
¨ Elektrický
náboj a-částic je 2-krát větší než b-částic (alfa: +2 , beta: -1 elementárního náboje |e|).
¨ Hustota
ionizace (lineární přenos energie LET) a-částic je cca
100-krát větší než b-částic. U alfa částic o energiích 4-8MeV činí
LET v tkáni cca 100keV/mikrometr, ke konci dráhy v Braggově
maximu se může lokálně zvyšovat až na 300keV/mikrometr. U
beta-částic typických energií stovky keV je LET jen cca 0,2
keV/mikrometr.
¨ Efektivní
dosah a-částic v tkáni je podstatně kratší než b-částic. U alfa
dolet činí cca 2-5 buněčných průměrů, u beta stovky
buněčných průměrů.
Z tohoto srovnání plyne, že alfa
radionuklidy mají lokálně vyšší radiobiologickou účinnost
než beta, avšak vzhledem ke krátkému doletu se u a-záření téměř
neuplatňuje „efekt křížové palby“. Nízká penetrace
(malý dolet v tkáni, cca 50-90 mm) a vysoká hustota
ionizace (LET desítky až stovky keV/mikrometr) však
umožňují účinnou destrukci nádorových buněk s minimálním
kolaterálním poškozením okolní zdravé tkáně.
Z hlediska radionuklidové terapie jsou tedy
alfa a beta radionuklidy do značné míry vzájemně komplementární
:
-->
Beta částice
s obvyklou energií cca 0,5-2,3 MeV a nízkým LET
~0,2keV/mikrometr mají delší dráhu,
mikrometry až centimetry, představující cca 5-150 průměrů
buněk - jsou vhodnější po větší tumory,
difuzní nebo reziduální onemocnění. Každý elektron beta je
schopen prolétat a zasahovat mnoho buněk, v nichž způsobuje
ionizační poškození (srov. efekt
"křížové palby"). U
mikro-lézí či osamocených buněk je účinnost malá,
většina částic beta odlétá pryč mimo lézi, bez účinku.
-->
Zatímco alfa
částice (s energií ~4-9MeV a vysokým LET ~100-300
keV/mikrometr), vzhledem k jejich krátké délce dráhy
v tkáni cca 40-100 mikrometrů, činící jen ~1-3 průměrů
buněk, mohou být účinné i u malých lézí a
mikrometastáz velikosti milimetrů, nebo dokonce u
izolovaných osamocených nádorových buněk.
Pokud se do nich alfa částice dostanou, nebo nejlépe když je
alfa-emitující radionuklid internalizován uvnitř
buňky, mohou vysokou hustotou ionizace způsobit neopravitelné
zlomy DNA.
Radiobiologický účinek
odražených jader
Při emisi alfa-částic - těžkých
héliových jader s vysokou kinetickou energií - dochází
vlivem akce a reakce ke zpětnému odrazu
dceřinných jader s kinetickou energií cca 100keV (§1.2, pasáž "Zpětný odraz jader"). Takto odražená jádra
se v tkáni velmi rychle zabrzdí na dráze cca 500nm, podél
níž způsobují hustou ionizaci látky s
vysokým LET (řádu stovek keV/mm). Pokud k tomu dojde
uvniř buňky, může to způsobit dvojitý zlom DNA nebo
poškození mitochondrií, což může vyústit v apoptózu.
Odražená jádra tak poněkud přispívají k
radiobiologickému účinku, který je zde však
lokalizován na velmi blízké okolí místa
alfa-rozpadu, pouhých 0,5 mikrometru.
In vivo radionuklidové generátory
Většina v nukleární medicíně
používaných alfa-radionuklidů se přeměňuje celou rozpadovou
řadou (§1.4, pasáž "Rozpadové
řady") a po jejich aplikaci do organismu se chovají jako "in
vivo radionuklidové generátory" (§1.4, pasáž "In vivo generátory"
v nukleární medicíně) -
(obr.3.6.10 b,c). Výhodou
je zde emise několika alfa-částic (typicky 4alfa/rozpad, viz např. 227Th - kde je 5alfa) o vysokých energiích cca 4-8
MeV, což vede k vysoké radiobiologické účinnosti.
Určitým
problémem u in vivo generátorů je redistribuce
dceřinných radionuklidů - uvolňování -
disociace - dceřinných atomů z chemické
vazby v molekulách radiofarmaka v důsledku zpětného
odrazu jádra při emisi alfa-částice (§1.2, pasáž "Zpětný odraz jader") a rozdílnosti chemických
vlastností dceřinného atomu (oxidačního čísla). Již při
první a-přeměně
je chelatace radionuklidu s ligandem narušena zpětným odrazem
jádra (a tím i dceřinného atomu) a chemickou transformací původního atomu.
Následující a-emitující dceřinné atomy jsou pak volné. Když k
tomu dojde na povrchu buňky, může lymfatický a krevní oběh
přenášet takto uvolněnou radioaktivitu do nenádorových
tkání (obr.3.6.10 b). Pokud dceřinný atom
během své přeměny uniká z cílové tkáně, účinnost
terapie se tím snižuje o několik
následujících energetických alfa-částic z rozpadové řady
. Tyto uvolněné radioaktivní atomy pak mohou migrovat a
vychytávat se v jiných tkáních (např.
v kostní dřeni) a způsobovat tam
nežádoucí radiační zátěž. Tento nežádoucí efekt
bude zmírněn, pokud radioaktivně značený ligand dostatečně
rychle proniká dovnitř buněk a je v nich internalizován
(obr.3.6.10 c);
potom nascentní nabité dceřinné atomy, které jsou
velmi reaktivní, mohou zůstávat navázané v cytoplasmě
uvnitř buňek dostatečně dlouho, aby se tam stačily
opakovaně rozpadnout a předat veškerou svou radiační
energii. Tato internalizace dceřinných radionuklidů
in vivo generátoru může zároveň omezit či zabránit
nežádoucí redistribuci radioaktivity mimo nádorovou tkáň.

Obr.3.6.10. Radioaktivně značené biomolekuly jakožto
radiofarmaka pro diagnostiku a terapii v nukleární medicíně.
a) Chemické navázání radionuklidu na
biomolekulu (např. monoklonální protilátku)
pomocí bifunkční chelatační molekuly (např. DOTA). b)
Uvolnění - disociace - dceřinného atomu z chelatační vazby
v důsleku zpětného odrazu jádra a transformace oxidačního
čísla dceřinného atomu při radiaktivní přeměně (např.
alfa). Pokud je radionuklid vázán na povrchu buňky, uvolněný
dceřinný radionuklid může metabolismem migrovat do zdravých
tkání (a způsobit tam nežádoucí radiační
zátěž). d) Zabránění tohoto úniku
internalizací radiofarmaka uvnitř buňky.
Z těchto důvodů je též vhodné, aby rozpadový řetězec
použitého radionuklidu neobsahoval dceřinné meziprodukty s
delším poločasem rozpadu, které by se mohly
uvolňovat z cílové léze a způsobovat radiační zátěž
zdravých tkání. Např. aktinium 225Ac (225Ac(10d.;
a) ® 221Fr(4,8m.;
a) ® 217At(32ms.;
a) ® 213Bi(46m.;
b-) ® 213Po(4ms.; a) ® 209Pb(3,3h.;
b-) ® 209Bi(stab.)) je z tohoto hlediska výhodnější než jinak též
slibné thorium 227Th (227Th(18,7d.; a) ® 223Ra(11,4d.;
a) ® 219Rn(4s.;
a) ® 215Po(1,8ms.;
a) ® 211Pb(36,1min.;
b-) ® 211Bi(2,2min.;
a) ® 207Tl(4,8min.;
b-) ® 207Pb(stab.)), kde je problematické 223Ra s poločasem jen o málo kratším než základní 227Th.
Obecně však všechna radiofarmaka, včetně
dceřinných radionuklidů u in vivo generátoru, se
vychytávají nejen v nádorových buňkách, ale více nebo
méně i v jiných tkáních, kde způsobují nežádoucí
radiační zátěž.
"Tandemová"
terapie alfa + beta radionuklidy
Radiace alfa a beta se při radionuklidové terapii svými
biologickými účinky mohou doplňovat -
pracovat "synergicky v tandemové kooperaci"
:
-> Hustě ionizující
záření alfa může být účinné i vůči mikrometastázám
či dokonce osamoceným nádorovým buňkám .
-> Záření
beta vzhledem k efektu „křížové
palby“ může zase účinněji působit u větších
a heterogenních nádorových lézí .
Zkouší se např. tandemová terapie s 225Ac-PSMA a s 177Lu-PSMA
u ca prostaty.
Radionuklidová
terapie: beta- ano,
beta+ ne !
Pozitrony b+ mají v
zásadě stejné radiobiologické účinky jako elektrony b- stejné energie. Avšak u pozitronů dochází po
zabrzdění v tkáni k anihilaci s elektrony, čímž je
generováno pronikavé anihilační g-záření o energii 511keV,
které silně radiačně zatěžuje okolní i vzdálenější
tkáně a orgány. Pozitronové b+ radionuklidy jsou proto pro terapii nevhodné a nepoužitelné!
Radionuklidová terapie Augerovými
elektrony
Kromě záření a,b,g emitují některé radionuklidy i konverzní
a Augerovy elektrony (+
Coster-Kronigovy elektrony). Vznikají vnitřní
konverzí (virtuálních) fotonů záření g a
charakteristického X-záření uvnitř atomového obalu (§1.2,
pasáž "Vnitřní konverze gama a X-záření"). Na rozdíl od spojitého spektra elektronů b-záření z jádra
mají konverzní a Augerovy elektrony diskrétní spektrum,
sestávající z několika monoenergetických linií. Augerovy
elektrony mají podstatně nižší energie než
b-záření,
zpravidla jednotky keV i méně. Radionuklidy emitující
Augerovy elektrony mají z hlediska biologicky cílené terapie
následující specifické vlastnosti :
× Je emitováno několik
(cca 5-20) elektronů na 1 rozpad.
× Velmi
krátký dosah Augerových
elektronů - ve vodě či tkáni je řádu nanometrů.
× Jejich LET je
lokálně »
>20-krát vyšší než u beta (energie »100keV).
× V bezprostředním okolí »5nm od
radionuklidu vzniká od Augerových elektronů lokálně vysoká
mikro-dávka (podle fiktivního teoret. přepočtu »104-107Gy).
Z těchto vlastností plyne lokálně vysoká
radiobiologická (cytotoxická) účinnost
zabíjení buněk v rozsahu několika nanometrů, která se však
může uplatnit jen tehdy, pokud se radionuklid emitující
Augerovy elektrony rozpadá přímo uvnitř molekuly DNA
dané buňky, zejména mezi vlákny DNA. Zatím se zkoušejí dva
způsoby jak in vivo navázat příslušný radionuklid
dovnitř molekul DNA: 1. Značení derivátů pyrimidinu,
které se in vivo začleňují do DNA. 2.
Označování DNA barviv, které se vážou na DNA přes
vodíkové můstky.
Intenzívními zdroji Augerových elektronů
jsou především radionuklidy rozpadající se elektronovým
záchytem, jako je 125I, 77Br, 123I, 124I, 111In, 67Ga, 201Tl, ...; jsou též emitovány některými
"čistými", metastabilními g-radionuklidy (včetně 99mTc). U některých
terapeutických beta- - radionuklidů vznikají vnitřní konverzí
doprovodného gama-záření. Jedním z takových radionuklidů s
vysokým zastoupením Augerových elektronů je terbium 161Tb.
Vliv záření gama
Záření gama u radionuklidové terapie
prakticky nemá terapeutický účinek a jeho
přítomnost může naopak způsobovat nežádoucí ozáření i
jiných orgánů a tkání než cílové léze. U smíšených
zářičů beta-gama však záření gama může být s výhodou
využito pro scintigrafické zobrazení biodistribuce
radiofarmaka v organismu (kap.4 "Radioisotopová
scintigrafie")
a dozimetrické monitorování průběhu terapie
(viz níže "Plánování,
monitorování a dozimetrie radionuklidové terapie"). Takovými smíšenými
terapeutickými radionuklidy s použitelnou složkou záření g jsou především 131I [g 364keV(81%)], dále 153Sm [g 70keV(5%) a 103 keV(28%)], 186Re [g 137keV(9%)], 177Lu [g 113keV(3%) a 208keV(6%)], 166Ho [g 48-58keV(9%) a 81keV(6%)], nebo 225Ac [linie g 100keV(1,6%), 218keV(5%) , 440keV(26%)] a několik dalších. Podrobná
gama-spektra těchto a dalších radionuklidů jsou v §1.4,
část "Nejdůležitější radionuklidy".
U čistých
radionuklidů b s vyšší energií, jako je např. 90Y, může být k
detekci (gamagrafii) použito brzdného záření,
avšak přesnost lokalizace a stanovení orgánové aktivity je
podstatně horší (u ytria-90 existuje
však možnost využít velmi slabého anihilačního záření
pro PET scintigrafii s lepším rozlišením než je u brzdného
záření - je analyzováno v §1.4, pasáž "Ytrium 90Y").
Pozn.: Stojí za povšimnutí, že základní požadavek "co
nejvíce beta, co nejméně gama" na radionuklidy
pro terapii je přesně opačný než na
radionuklidy pro diagnostiku (scintigrafii), kde hlavní složkou
musí být záření gama, zatímco záření beta, zvyšující
radiační zátěž, by mělo být zastoupeno co nejméně, nebo
vůbec (jak je tomu ideálně u 99mTc) - viz kap.4 "Radioisotopová scintigrafie".
Aplikace
terapeutického radiofarmaka
Vyšetření před
aplikací
Před vlastní aplikací je nutno se přesvědčit, zda buňky
nádoru, či jeho metastáz, budou akumulovat použité
radiofarmakum. Předběžné základní informace poskytují
klinické výsledky - o jaký typ tumoru se jedná (s histologickými údaji), jaké
receptory by nádorové buňky měly exprimovat. Skutečné
potvrzení akumulace radiofarmaka (či
exprese potřebných receptorů) nádorovými
buňkami se provádí pomocí scintigrafického
vyšetření při aplikaci diagnostické aktivity
příslušného radiofarmaka. Akumulace radiofarmaka v nádorové
tkáni musí být vyšší než akumulace v okolních zdravých
tkáních a dalších orgánech, většinou v játrech (pro posouzení selektivního vychytávání se
používá někdy tzv. Krenningovo skóre 1-4, pro úspěšnou
terapii by mělo být vyšší než 2).
Dále je potřeba zohlednit kontraindikace (jako
gravidita či laktace), rizikové okolnosti jako je porucha
činnosti ledvin (clearence kreatininu <40 ml./min.), jater,
krvetvorby.
Aplikace
Terapeutická radiofarmaka se aplikují většinou intravenózně,
někdy perorálně (u
terapie karcinomu štítné žlázy), dále
do dutin a do pouzder kloubů (zde se
neprovádí akumulační scintigrafie, neboť tyto mechanismy zde
nejsou přítomny). Nosiče
("transportéry") v radiofarmakách mají
širokou chemickou škálu - od jednoduchých anorganických
sloučenin (jako jsou chloridy či jodidy), přes složitější organické látky (.., peptidy,...), až po velmi
složité značené monoklonální protilátky. Intravenózní
aplikace terapeutických radiofarmak se provádí většinou
pomalou infuzí po dobu cca 10 - 30 minut.
Optimální dávkování aktivity
[MBq] terapeutického radionuklidu vychází z kompromisu mezi
maximálním požadovaným radiačním účinkem
v cílové tkáni a radiotoxicitou preparátu,
který se často nechtěně vychytává a radiačně zatěžuje i
jiné tkáně a orgány. Na základě důkladných laboratorních
a klinických zkoušek je pro každé terapeutické radiofarmakum
stanovena doporučená aplikovaná aktivita
[MBq], někdy přepočítaná na váhu pacienta (nebo na plochu povrchu těla - empirický vzorec z
výšky a váhy pacienta). Individuální
upřesnění může být provedeno na základě analýzy metodou MIRD
(Stanovení radiační dávky z
vnitřní kontaminace. Metoda MIRD.).
Uvedene si zde pro názornost znovu obr.5.5.1 z
§5.5 :
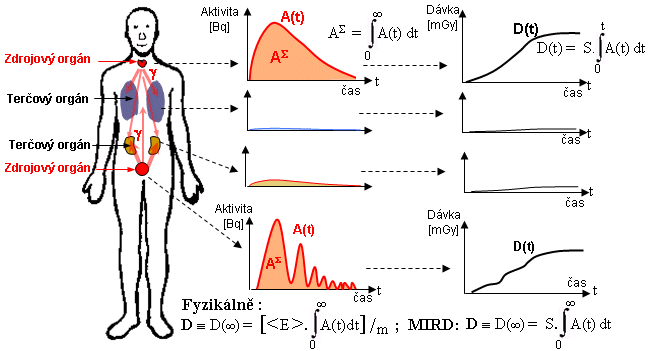
Obr.5.5.1. Radiační dávky z distribuce radioaktivity uvnitř
organismu. Vlevo: Zdrojové a terčové orgány
v organismu. Uprostřed: Časová závislost
aktivity ve zdrojových orgánech. Vpravo:
Časová závislost pro stanovení dávek D metodou MIRD.
<E> je
střední energie [J] deponovaná v tkáni hmotnosti m na
jeden rozpad použitého radionuklidu (uvažují
se elektrony beta nebo částice alfa).
Pokud se tato střední energie uvádí v jaderných jednotkách
[eV], figuruje zde ještě přepočítávací faktor 10-19.
Obrázek zhruba simuluje situaci po
vniknutí radiojódu 131I do organismu. Radiojód se rychle vychytá ve
štítné žláze, pak se metabolizuje a vylučuje ledvinami do
močového měchýře, odkud periodicky při močení odchází z
organismu.
Radionuklidová terapie se provádí buď
jednorázově, nebo v několika cyklech, většinou 4, s odstupem
4-8 týdnů. Kromě s vlastního radiofarmaka se často
podávají další pomocné látky jako jsou antihistaminika
proti alergiím a aminokyseliny k protekci renální toxicity.
U aplikace do kloubů (radionuklidová
synovektomie - viz níže) jsou hodnoty doporučené aplikované aktivity odvozeny
od velikostí kloubu.
Radiační dávka a její distribuce při
radionuklidové terapii
U radionuklidové terapie je distribuce dávky, jakož i její
časová proměnnost, v nádorové i zdravé tkáni podstatně
složitější než u zevní radioterapie. Je to dáno časově
proměnnými biologickými procesy vychytávání
(akumulace) a vyplavování (clearance-úbytku) radioaktivních
látek v různých druzích tkání; přistupuje k tomu i
fyzikální poločas rozpadu použitého radionuklidu.
Základní vztahy pro radiační dávku z homogenní distribuce
radioaktivity v látce byly odvozeny v §5.1, pasáž "Radiační dávka z radioaktivity"; zde si je vhodně zmodifikujeme.
Radiofarmakum
o aktivitě Ainj se po aplikaci většinou rychle (během několika
hodin) částečně vychytá v cílových
tkáních; zbytek odchází z organismu především močovými
cestami. V nejjednodušším případě se v cílovém ložisku
hmotnosti m rovnoměrně akumulovala aktivita Ao=a.Ainj, daná akumulační schopností a dané tkáně (akumulace se často vyjadřuje v %). Tato aktivita Ao způsobí svými emitovanými částicemi v daném
ložisku dávkový příkon Ro[Gy/s] = Ao.<E>.6.10-12/m, kde <E> [MeV] je střední energie částic
krátkého doletu (většinou beta, popř. alfa), která se
absorbuje ve vyšetřovaném ložisku (koeficient
6.10-9 je
energetický přepočítávací faktor mezi jednotkami MeV®Joule,
zahrnující též přepočet hmotnosti g®kg).
Pak
tato akumulovaná aktivita bude s časem t klesat
přibližně exponenciálně: A(t) = Ao.e-k.t s efektivní rychlostí k = ln2/(T1/2fyz +
ln2/T1/2biol), danou fyzikálním poločasem rozpadu T1/2fyz použitého
radionuklidu a biologickým poločasem clearance
radiofarmaka T1/2biol z tkáně. Se stejným tempem bude klesat dávkový
příkon v ložisku. Celková kumulativní dávka
D obdržená v cílové tkáni po uplynutí času T
pak je D(T) = 0ňTR(t)dt
= (Ro/k).[1- e-k.T].
Tuto radiační dávku, spolu s její časovou závislostí, lze
pak dosadit do lineárně-kvadratického modelu s
časovým faktorem reparace l a repopulace T2r , jak bylo odvozeno
výše ("LQ model") :
-ln(N/No) = a.D + {2.[(1-e-l.T).(1-1/l.T)]/l.T}.b.D2 -
ln2.T/T2r .
V obecném případě vzniká složitá rovnice pro
přežívající frakci buněk N/No, která se však za předpokladu ozařovacího času
dlouhého ve srovnání s efektivním poločasem poklesu
radioaktivity v cílovém objemu (a při zanedbání buněčné
proliferace) zjednoduší na: -ln(N/No) = a.D.{1 + Ro/[(l+k).a/b]}].
Ze srovnání s odpovídajícím vzorcem
pro externí frakcionovanou radioterapii je vidět, že poměr Ro/l zde má obdobnou úlohu
jako frakcionační dávka d.
Při radionuklidové terapii je důležitým
parametrem výsledná radiační dávka
- celotělová, terapeutická dávka v cílových lézích,
nežádoucí dávka ve zdravých (rizikových - kritických)
tkáních a orgánech. Pokud změříme časový průběh
aktivity A(t) v určité tkáni (orgánu, lézi) hmotnosti m,
můžeme celkovou kumulativní radiační dávku
stanovit pomocí vztahu
D = 0ňĄA(t)
dt . <E>. 6.10-19/m , neboli
D = AS . <E>
.6.10-19/m ,
kde AS je celková tzv. kumulovaná aktivita (zavedená v §5.5, "Vnitřní kontaminace") ve vyšetřovaném objemu v celém čase od aplikace
(t=0-Ą).
Tím se budeme zabývat níže v pasáži "Plánování,
monitorování a dozimetrie radionuklidové terapie", obr.3.6.11.
Během
expozice, která je kontinuální s klesajícím
dávkovým příkonem, se vedle radiační likvidace buněk
může projevovat i proliferace (repopulace)
nádorových buněk v ložisku, zvláště v pozdnějších
fázích terapie. Dokud je dávkový příkon vyšší než
kritická hodnota ln2/(a.T2r), bude se
počet buněk v nádorovém ložisku snižovat, později při
poklesu radiace může převládnout proliferace nádorových
buněk - srovnej s výše zmíněnou
"zbytečnou" či "odpadní" dávkou (wasted
dose) u permanentní brachyterapie. Je
proto žádoucí aplikovat tak vysokou aktivitu
radiofarmaka, aby vysoký dávkový příkon z akumulované
radioaktivity v nádorové tkáni rychle zlikvidoval pokud možno
všechny klonogenní buňky ještě před převládnutím
buněčné repopulace. V tomto směru je však častou
překážkou radiotoxicita pro ty zdravé tkáně a
orgány, v nichž se radiofarmakum rovněž nechtěně
vychytává...
Eskalace dávky - aplikované
aktivity - je přípustná jen při pečlivé dozimetrické
kontrole a radiačním monitorování
vychytávání radiofarmaka v cílových ložiscích a
nežádoucího vychytávání ve zdravých tkáních a
rizikových kritických orgánech - "Stanovení radiační dávky z vnitřní
kontaminace. Metoda MIRD.".
Z klinického hlediska je nutno zohlednit celkový zdravotní
stav pacienta a případné rizikové faktory (jako jsou poruchy krvetvorvy či funkce ledvin). I když metoda MIRD v celé její komplexnosti zatím
není použitelná při rutinní terapii, měla by se provádět
aspoň celotělová dozimetrie (pomocí měření dávkového příkonu ve vzdálenosti
cca 1-2 m od těla pacienta, viz níže) a
laboratorní hematologická analýza odebíraných krevních
vzorků pro sledování nežádoucí hematologické
toxicity (v závažnějších
případech hematologické toxiocity je třeba přikročit i k
následené autologní transplantaci krevních buněk). O úloze dozimetrie při optimalizaci radionuklidové
terapie je diskutováno níže v odstavci "Plánování,
monitorování a dozimetrie radionuklidové terapie".
"Odpadní"
radioaktivita
Během celého průběhu radioisotopové terapie odchází z
organismu použitá radioaktivní látka, především močovými
cestami. Největší obsah radioaktivity v moči je na začátku
terapie, kdy dochází k exkreci značného množství volné
nenavázané radioaktivní látky. Později, při likvidaci
nádorové tkáně, se uvolňuje původně navázané
radiofarmakum, které již "splnilo svou úlohu".
Poměrně vysoký obsah radioaktivity v moči (v malé míře i v
dalších exkrementech) u pacientů při radionuklidové terapii
je třeba brát v úvahu z hlediska radiační ochrany -
manipulace s radioaktivními odpady (viz §5.6
"Radiační ochrana na pracovištích s
ionizujícím zářením").
Pozn.:
Neplést, prosím, tuto vylučovanou
"odpadní radioaktivitu" s výše zmíněnou
radiobiologicky "zbytečnou" či "odpadní"
dávkou (wasted dose) !
Plánování,
monitorování a dozimetrie radionuklidové terapie
Metody dozimetrického plánování a verifikace, popsané výše
u radioterapie externími svazky (pasáž
"Plánování
radioterapie"), u radionuklidové terapie nejsou použitelné.
Situace se zde podobá spíše chemoterapii či biologické
léčbě (výše popsané v
části "Chemoterapie a biologická léčba"). Radionuklidovou terapii
však nemusíme dělat úplně "naslepo" (empiricky, paušálně), jak je
tomu u farmakologické léčby. Metody detece a
zobrazení emitovaného ionizujícího záření přece
jen nabízejí určité možnosti monitorování,
dozimetrických měření a individuálního
dávkování u cílené terapie otevřenými
radionuklidovými zářiči. Stanovení radiačních dávek je
možné provést měřením biokinetiky -
rychlosti akumulace a následného vylučování
použitého radiofarmaka ve vymezených zájmových
oblastech nádorových lézí a zdravých tkání a
rizikových kritických orgánů. Lze k tomu použít
především kvantitativní scintigrafii na
gamakamerách (planárních, SPECT či PET,
v kombinaci s CT), v jednodušším
případě celotělové měření retence radiofarmaka, dále
měření aktivity odebíraných krevních vzorků.
Pro zevní dozimetrické monitorování
radionuklidové terapie je výhodné, když použitý radionuklid
má, vedle hlavní složky b či a, též nezanedbatelnou složku záření g -
tak je tomu např. u radiojódu 131I, samária 153Sm , lutetia 177Lu nebo aktinia 225Ac. Toto záření g volně (s určitou absorbcí) prochází tkání a jeho zevní detekcí lze stanovit
lokalizaci a v zásadě i aktivitu v tkáních a orgánech. U
čistých radionuklidů b s vyšší energií, jako je např. 90Y, může být k detekci
(gamagrafii) použito brzdného záření,
avšak přesnost lokalizace a stanovení orgánové aktivity je
podstatně horší (u ytria-90 existuje
však možnost využít velmi slabého anihilačního záření
pro PET scintigrafii s lepším rozlišením než je u brzdného
záření - je analyzováno v §1.4, pasáž "Ytrium 90Y").
Při dozimetrickém
monitorování u radionuklidové terapie lze používat v
zásadě tři postupy :
--> Celotělová
dozimetrie
při níž se stanovuje, jakou celkovou - celotělovou -
radiační dávku DWB obdrží pacient v důsledku aplikace určité aktivity
použitého radiofarmaka. A případně jaká je její časová
dynamika. Lze ji v případě potřeby provádět u
diagnostických i terapeutických aplikací. Nejjednodušeji se
provádí pomocí gama-radiometru (GM nebo
scintilačního detektoru, měřiče dávkového příkonu)
umístěného cca 1-2 metry od středu těla pacienta. Novější
způsob je pomocí gamakamery v režimu whole-body
scanning, kde navíc získáme obraz distribuce radiofarmaka v
cílových ložiscích a nežádoucího vychytání ve zdravých
tkáních. Přepočítávací faktor pro převedení
naměřených počtů impulsů "cps" na aktivitu
"MBq" se stanoví buď pomocí fantomového měření s
etalonem použitého radionuklidu, nebo jednodušeji pomocí
první naměřené hodnoty v čase t=0, která odpovídá skutečně
aplikované aktivitě AWB(t=0). Tento koeficient se pak používá pro přepočet
naměřených hodnot na aktivitu v těle pacienta i při
dalších měřeních.
Hodnoty z opakovaných měření v několika dnech
se pak fitují obvykle biexponenciální funkcí,
modelující počáteční rychlejší a později pomalejší
pokles celkové radioaktivity v organismu :
AWB(t) = A0 . ( e-l1 . t + e-l2 . t ) ,
kde A0 = AWB(t=0) je
počáteční aplikovaná aktivita (obr.3.6.11 vlevo). Vznikne
tím křivka okamžité celotělové aktivity AWB(t) pro čas t,
jejíž integrací od 0 do Ą se získá hodnota kumulované celkové aktivity
ASWB = 0ňĄAWB(t) dt v těle pacienta. Absorbovaná celotělová
dávka DWB se pak přímočaře stanoví jako součin této
kumulované aktivity ASWB v těle a střední
energie <E> emitované na 1 rozpad použitého
radionuklidu, v přepočtu na 1 kg (s
příslušnými koeficienty) : DWB[Gy] = ASWB.<E>.6.10-12/MWB, kde MWB je hmotnost
pacienta. S použitím analýzy MIRD se alternativně stanoví
jako součin kumulované aktivity v cílovém objemu a S-faktoru:
DWB[Gy] =
ASWB.SWB. Tento S-faktor
vyjadřuje střední absorbovanou dávku pro jednotku kumulované
aktivity. Pro cílový objem celé tělo u nejčastěji
používaného radionuklidu 131I byl pro S-faktor stanoven přibližný empirický
vzorec: SWB[Gy/(MBq.h)]
= 1,3.10-4 MWB-0,92, kde MWB je hmotnost pacienta v kg.
Stanovení celotělové radiační dávky při radionuklidové
terapii může být užitečné hlavně ve třech směrech :
- Ověření, zda byla úspěšně aplikována správná hodnota
indikované terapeutické aktivity daného radiofarmaka.
Užitečnější však může být použití celotělové
dozimetrie "opačným směrem": Na základě známé
hodnoty naaplikované aktivity AWB(t=0) provést kvantitativní kalibraci
scintigrafie - stanovení přepočítávacího faktoru [cps/MBq]
mezi aktivitou a změřeným počtem impulsl [cps] v obraze.
- Z hlediska radiační ochrany je celotělová dávka základní
veličinou určující radiační zátěž pacienta a míru
rizika stochastických a příp. deterministických účinků.
- U některých druhů terapie (štítné žlázy s 131I) byla stanovena
maximální celotělová dávka (většinou do 2 Gy), kterou je
třeba dodržet.
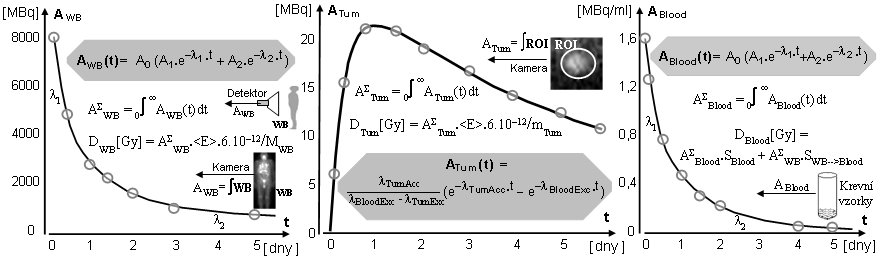
Obr.3.6.11. Dozimetrická měření pro radionuklidovou terapii.
Vlevo: Celotělová aktivita AWB a jí způsobená
celotělová dávka DWB. Uprostřed: Vychytaná
radioaktivita v cílovém ložisku (tumoru - vyznačené ROI) ATum a jí vyvolaná
radiační dávka DTum . Vpravo: Měrná
radioaktivita v krvi ABlood - v odebíraných vzorcích 1ml.
Ilustrativní hodnoty času t[dny] na vodorovné ose
a aktivity A[MBq] na svislé ose odpovídají zhruba situaci při terapii
metastatické ca štítné zlázy radiojódem 131I .
--> Dozimetrie
cilových tkání (tumorových lézí)
a zdravých (kritických - rizikových)
orgánů
slouží ke stanovení absorbované terapeutické
radiační dávky v cílové tkáni DTum (nádorové lézi "Tum." či jiné
patologické tkáni), nebo jakou nežádoucí dávkou
jsou zatíženy zdravé tkáně a rizikoví kritické orgány.
Toto je to nejdůležitější co potřebujeme
zjistit pro úspěšný průběh radionuklidové terapie.
Dozimetrie lézí je vhodná k predikci odezvy na léčbu
a pro stanovení požadované terapeutické aktivity, s
přihlédnutím k omezením plynoucím z radiotoxicity.
Metodický postup je zde však značně náročný a má svá
omezení. U menších a slabě akumulujících lézí většinou
nelze stanovit relevantní výsledky radiační dávky...
Měření se provádí gamakamerou pomocí kvantitativní
scintigrafie (§4.1 "Podstata a druhy
scintigrafie", pasáž "Kvantitativní
scintigrafie"). Kamera
musí být pomocí fantomových měření kalibrována
pro přepočet zobrazovaného počtu impullsů "cps" na
aktivitu "MBq" v lézi. Zjednodušeně lze tuto
kalibraci provést s pomocí celotělové dozimetrie - prvního
naměřeného celotělového obrazu v čase t=0, který
odpovídá skutečně aplikované aktivitě AWB(t=0). Provede se
scintigrafické zobrazení oblasti v níž se nachází
vyšetřovaná léze, na obraze se zakreslí zájmová oblast
(ROI - obr.3.6.11 uprostřed) zobrazené léze a oblasti tkáňovího pozadí,
které se odečítá. Na základě kalibračního koeficientu
jsou pak impulsy z ROI přepočteny na aktivitu. Měří se
opakovaně, v den aplikace a pak v další dny, podle poločasu a
farmakokinetiky použitého radiofarmaka. Hodnoty radioaktivity z
opakovaných scintigrafických měření v několika dnech se pak
fitují obvykle biexponenciální funkcí, modelující
počáteční vychytávání radiofarmaka v lézi a pozdější
pomalejší vylučování - pokles - radioaktivity v lézi (2-kompartmentový model akumulace a vylučování
radiofarmaka) :
ATum(t) = [lTumAcc /(lBloodExc - lTumExc)].AApl .
(e-lTumAcc .
t - e-lBloodExc . t )
,
kde ATum(t)
je aktivita v lézi v čase t, AApl je aplikovaná aktivita, lTumAcc je rychlostní koeficient vychytávání (akumulace)
radiofarmaka v nádorové lézi z krve, lBloodExc je rychlostní koeficient odbourávání radiofarmaka z
krve a lTumExc je rychlostní koeficient exkrece radiofarmaka z
tumorové léze. Z krevního řečiště se radiofarmakum
částečně vychytává v nádorové lézi, odkud se pak
průběžně vyplavuje zpět do krevního oběhu a současně se
opět z krve částečně vychytává v tumorovém ložisku;
většina radiofarmaka se však neustále vylučuje z oběhu,
hlavně močovými cestami. Výsledkem této dynamické
rovnováhy mezi vychytáváním a exkrecí radiofarmaka z
nádorového ložiska je časová závislost aktivity v lézi
charakteristického tvaru podle křivky na obr.3.6.11 uprostřed:
rychlý nárust - oblý vrchol - pomalejší pokles.
Příslušné rychlostní parametry l se získávají z
biexponenciálního prokladu-fitace dat získaných měřením
aktivity ATum v jednotlivých časech t - obr.3.6.11
uprostřed.
Vznikne tím křivka okamžité aktivity ATum(t) v lézi pro čas
t, jejíž integrací od 0 do Ą se získá hodnota
celkové kumulované aktivity v dané lézi ASTum = 0ňĄATum(t) dt. Výsledná absorbovaná
dávka DTum v lézi se stanoví jako součin této kumulované
aktivity ASTum v cílovém objemu
a střední energie <E> emitované na 1 rozpad použitého
radionuklidu (předpokládá se emise
krátkodosahových elektronů beta nabo částic alfa), v přepočtu na jednotku hmotnosti léze (s příslušnými koeficienty) :
DTum[Gy] =
ASTum.<E>.6.10-12/mTum, kde mTum je hmotnost
vyšetřované léze - tumoru (stanovuje se
většinou ze sonograficky zjištěného objemu
násobeního hustotou léze, zpravidla 1g/1ml).
Analogickým způsobem jako u nádorových lézí
lze provádět dozimetrii i jiných, zdravých, tkání a
orgánů, za účelem monitorování jejich nežádoucí
radiační zátěže při radionuklidové terapii.
Varování
! -
zahlcení mrtvé doby gamakamery :
Při použití gamakamery pro celotělovou
dozimetri a zobrazování a dozimetrii cílových tkání je
třeba si dát pozor na příliš velkou intenzitu gama
záření emitovanou z pacienta. Při diagnostickém
měření. (s aplikovanými aktivitami řádu několika desítek
MBq) krystal gamakamery registruje jen max. 105 cps a problém zde
nevzniká. Při vysokých terapeutických aktivitách
mnoha GBq však četnost detekovaných impulsů dosahuje
několika milionů cps (především těsně po aplikaci), což
může vést k zahlcení detektoru kamery a velké mrtvé
době (včetně rizika poškození elektroniky) ! Pro
post-terapeutické scintigrafické zobrazování a dozimetrické
měření na gamakameře je třeba mít předem změřenou závislost
odezvy (měřeného počtu impulsů) na aktivitě v zorném
poli a v případě potřeby provádět u měřených dat korekci
na mrtvou dobu (§2.3, pasáž "Mrtvá doba detektorů" a §4.5, pasáž "Energetické rozlišení a mrtvá doba detektoru
kamery").
--> Dozimetrie
krevních vzorků
při níž měříme aktivitu odebíraných krevních
vzorků za účelem stanovení absorbované radiační dávky v
krvi. Lze tak monitorovat potenciální hematologickou
radiotoxicitu aplikovaného radiofarmaka. Měření se
provádí pomocí scintilačních nebo polovodičových
radiometrů (podrobněji popsaných v §2.7
"Měření radioaktivity vzorků (in vitro)"), u nichž je změřen kalibrační
koeficient pro přepočet mezi změřeným počtem impulsů
a aktivitou vzorku. Důležitým požadavkem je zde
reprodukovatelnost a linearita odezvy radiometru, s příp.
korekcí na mrtvou dobu. Při diagnostické aplikaci je aktivita
krevních vzorků nízká (řádu kBq) a je třeba je měřit ve
studnových scintilačních detektorech.
Pro podrobné mapování se dopoučuje měřit
krevní vzorky (1 ml.) v den aplikace za 10, 60, 120 min, 6 hod.,
pak za 24 hod, 2 dny, 4 dny, 6 dní.... Odečítá se pozadí a
hodnoty se korigují na poločas rozpadu použitého radionuklidu
k času mezi aplikací a odběrem vzorku.
Vzniklými normovanými hodnotami aktivit v
jednotlivých časech se proloží biexponenciální funkce,
modelující počáteční rychlejší a pozdější pomalejší
pokles radioaktivity v krvi :
ABlood(t)
= A0 . ( A1 .e-l1 . t + A2 .e-l2 . t ) ,
kde A0 = ABlood(t=0) je
počáteční měrná aktivita radiofarmaka v krvi (i.v. aplikovaná aktivita, nebo ta část perorálně
aplikované aktivity, která pronikla do krevního oběhu), konstanty A1, A2, l1, l2 jsou konkrétní parametry zastoupení a rychlosti obou
exponenciálních složek, stanovených z fitace - obr.3.6.11
vpravo.
Vzniká tím křivka okamžité měrné aktivity ABlood(t) v krvi pro
čas t, jejíž integrací od 0 do Ą se získá hodnota
celkové kumulované aktivity ASBlood = 0ňĄABlood(t) dt v krvi.
Výsledná střední hodnota absorbované radiační dávky v
krvi DBlood se zjednodušeně stanoví jako součin této
kumulované aktivity ASWB v těle a střední
energie <E> emitované na 1 rozpad použitého
radionuklidu, v přepočtu na 1 kg krve (s
příslušnými koeficienty) : DWB[Gy] = ASWB.<E>.6.10-12/0,001 (při vzorcích 1ml ~ 1g). Při
podrobnšjší analýze podle fomalismu MIRD se hodnota dávky
upřesňuje jako součet příspěvku z vlastní kumulované
aktivity ASBlood v krvi (činí zpravidla nejméně 95%) a
malého příspěvku (<5%) gama zíření od celotělové radioaktivity ASWB : DBlood[Gy] = ASBlood.SBlood + ASWB.SWB-->Blood . Např. pro radiojód 131I byly pro tyto S-faktory v MIRD stanoveny přibližné
hodnoty SBlood = 108 [Gy.ml/(GBq.h)] a SWB-->Blood = 0,019.MWB-2/3 [Gy/(GBq.h)],
kde MWB je
hmotnost pacienta.
Dozimetrie krve může být užitečná jako
součást pre-terapeutické dozimetrie (s aplikací diagnostické aktivity radiofarmaka,
několik MBq), pro optimalizaci velikosti
následně podávané terapeutické aktivity, možnosti její
případné eskalace či rizik. Při vlastní radionuklidové
terapii se dozimetrie krevních vzorků provádí jen zřídka.
Pro posouzení hematologické radiotoxicity je z klinického
hlediska daleko důležitější laboratorní biochemická
analýza krevních vzorků, především zastoupení
krevních elementů - erytrocytů, leukocytů (granulocyty, monocyty, B-lymfocyty, T-lymfocyty), trombocytů. Pokles počtu především erytrocytů v
krevních vzorcích je příznakem hematologické
radiotoxicity při terapii (projeví
se ve vzorcích až po několika týdnech).
Výpočetní poznámka :
Integrace od nuly do
nekonečna
ve vzorci AS = 0ňĄA(t)
dt. pro kumulovanou aktivitu je jen teoretický model. V praxi se
doporučuje místo nekonečna pro horní mez integrace použít
čas cca t = (1,2 - 1,5).T1/2 poločasu rozpadu terapeutického radionuklidu. Pro
vyšší hodnoty času se totiž mohou již projevovat odchylky
od dvoukompartmentového modelu biexponenciální funkce,
modelující počáteční vychytávání radiofarmaka a jeho
pozdější pomalejší vylučování. Projevuje se zde již
úbytek buněk v cílové nádorové lézi.
MIRD a teranostický
přístup k radionuklidové terapii
Tyto dozimetrické údaje pak pomocí metody MIRD (či zjednodušených variant) v
principu umožňují stanovit absorbovanou dávku v cílových
ložiscích a nežádoucí dávku ve zdravých tkáních. A
zpětně tak vypočítat terapeutickou aktivitu
použitého preparátu, kterou bychom měli aplikovat danému
pacientovi - pro dosažení dostatečného optimálního terapeutického
efektu v nádorových lézích, a přitom nepřekročení
tolerančních radiačních dávek v rizikových kritických
tkáních a orgánech.
I při aplikaci stejné aktivity téhož
radiofarmaka se mohou u různých pacientů skutečné radiační
dávky výrazně individuálně lišit, v závislosti na
akumulační schopnosti nádorové tkáně, jakož i na
funkčním stavu ledvin, kostní dřeně, jater, srdce a
dalších orgánů. Pro zajištění optimálního
průběhu a účinku radioisotopové terapie je proto
vhodné sledovat, jakým způsobem se radiofarmakum vychytává
v cílové tkáni (tumoru) a jak z ní postupně mizí. Pro minimalizaci
nežádoucích účinků záření na zdravou tkáň je
rovněž užitečné sledovat koncentraci radiofarmaka v
jednotlivých dalších orgánech a tkáních
(ledvinách, játrech, kostní dřeni, srdci, močovém
měchýři, ve vzorcích krve). Na základě tohoto monitorování
distribuce radiofarmaka je v zásadě možné počítat
(či odhadovat) efektivní radiační dávky -
jak žádoucí v cílových tkáních, tak nežádoucí v jiných
orgánech.
Vlastní radionuklidové terapii předchází
etapa plánování radioterapie, jejímž
hlavním výstupem je stanovení aplikované aktivity
daného radiofarmaka, popř. i časový plán opakovaných
aplikací. Aplikovaná aktivita se nejčastěji stanovuje v
podstatě paušálně, na základě doporučení
vycházejících z experimentů a multicentrických studií v
preklinické fázi zkoušení radiofarmaka. Ke stanovení
radiačních dávek v jednotlivých orgánech z vnitřní
distribuce radioaktivních látek se při těchto studiích
používá komplexní metoda MIRD (Medical
Internal Radiation Dose), zahrnující řadu fyzikálních a
biologických faktorů - viz §5.5, pasáž "Vnitřní kontaminace".
Pro přesnější stanovení aplikované aktivity
u konkrétních pacientů je v zásadě možno provádět monitorování
individuální farmakokinetiky u pacienta (jak bylo zmíněno výše). Toto
monitorování lze provádět v přípravné fázi plánování -
pre-terapeutická aplikace diagnostické aktivity
daného farmaka, značeného stejným nebo jiným *),
vhodnějším, radionuklidem gama - teranostickým
diagnostickým "dvojčetem"
značeným gama-radionuklidem. Následné gamagrafické
zobrazení pak ukáže ("předpoví") biodistribuci
terapeutického preparátu a umožní in vivo dozimetrii.
Pro scintigrafii se používají příslušná diagnostická
radiofarmaka značená g-radionuklidy (viz §4.8 "Radionuklidy a radiofarmaka pro
scintigrafii"). Velmi precizní je koncepce teragnostiky,
spočívající v kombinaci diagnostiky a terapie radiofarmaky s
použitím stejného molekulárního cíle, s označením
identické vektorové biomolekuly diagnostickým (gama či pozitronovým) a
následně terapeutickým (beta, či alfa) radionuklidem. Komplexní teranostický přístup v
nukleární medicíně je diskutován v §4.9, pasáž "Kombinace diagnostiky a terapie -
teranostika".
*) I při značení téže nosičové
látky jiným radionuklidem s jinou chelatační vazbou je třeba
uvážit možné riziko změněných farmakokinetických
vlastností...
Pomocí nastíněných
měření a výpočtů lze v principu (spíše
však jen teoreticky...) stanovit
radiační dávky a biologický efekt radioisotopové terapie.
Avšak vzhledem ke složitosti distribuce radioaktivity a její
dynamiky, včetně neurčitosti řady důležitých parametrů (klíčovou neznámou je konktétní individuální radiosenzitivita),
se jedná jen o značně nepřesný
"kvalifikovaný odhad" (chyba cca
30-50%). V praxi se proto dávkování
terapeutických radiofarmak často stanovuje empiricky,
na základě nahromaděných zkušeností.
Terapie karcinomu štítné žlázy
radiojódem 131I
V úvodu k této kapitole o radioisotopové terapii jsme
zmínili, že pro většinu nádorových procesů zatím nemáme
látky, které by se dostatečně selektivně vychytávaly a
hromadily v nádorové tkáni. Významnou výjimkou - kde "vhodnou
selektivně vychytávanou látku máme"- je karcinom
štítné žlázy, u něhož si thyroidální nádorové
buňky zpravidla zachovávají schopnost vychytávat a
akumulovat jód, stejně jako zdravé buňky štítné
žlázy (tak je tomu především u
nádorových buněk diferencovaného karcinomu štítné
žlázy).
Aplikujeme-li tedy radioaktivní jód 131I
[T1/2=8dnů, Ebmax=606keV, g: 284keV(6%),
364keV(81%), 637keV(7%), 723keV(2%) - fyzikální vlastnosti
§1.4., pasáž "131I";
aplikace perorálně ve formě roztoku jodidu sodného], vychytává se tento radionuklid v nádorových
buňkách štítné žlázy (stejně jako
neaktivní jód, chemické vlastnosti jsou stejné, buňky to
"nepoznají"), a to i ve
vzdálených metastázách. Z krevního oběhu (krevní plasmy) do
thyroidálních buněk jodid sodný NaI proniká iontovým
transportem prostřednictvím Na/I symporteru (což je transmembránový glykoprotein molekulové
hmotnosti 87kDa), v těchto buňkách pak
vstupuje do metabolické syntézy thyroidálního hormonu.
Když jodid pronikne do
cytoplasmy folikuární buňky štítné žlázy, kovalentně se
naváže na přítomný thyrosin ve thyreoglobulinu, což vede k
další syntéze hormonů štítné žlázy. Tato chemická vazba
v thyreoglobulinu zvyšuje dobu po kterou se radiojód zdržuje v
buňce - internalizace. Přes koloidní formu se potom
kombinací dvou molekul vytváří T3 a T4, fúzí s lysosomem se
reakční směs zbaví proteinů a T3 a T4 se uvolní do
mezibuněčného prostoru a vzápětí do krevního oběhu; s
tím dochází i k externalizaci radiojódu.
Během internalizace radiojódu záření beta 131I, které má v
tkáni poměrně krátký dolet (max. 3 mm,
efektivní dolet R90 činí jen cca 0,8mm), likviduje
svými ionizačními účinky nádorovou tkáň
"zevnitř", a tedy selektivně, při
minimální radiační zátěži okolních zdravých tkání. K
radiační zátěži dalších tkání a orgánů však dochází
vlivem částečného nežádoucího vychytávání
radiojodidu v těchto tkáních, jakož i při metabolickém
zpracování a clearanci radiofarmaka (krev, ledviny, močový
měchýř). Podmínkou, aby se radiojód účinně akumuloval v
metastázách karcinomu štítné žlázy, je odstranění
veškeré tkáně vlastní štítné žlázy. Po chirurgickém
odstranění štítné žlázy se v případě potřeby provede radiační
eliminace případné zbytkové
akumulující tkáně aplikací cca 1-2 GBq radiojódu.
Pro vlastní terapii karcinomu štítné
žlázy se pak aplikuje aktivita AApl cca 3-7 GBq
*) radiojódu. V nádorové tkáni akumulujících metastáz
diferencovaného ca štítné žlázy se na jeden gram [g]
vychytá cca (0,01-0,02)%AApl/g, což činí zhruba 0,3-0,8 MBq/g. Počáteční
dávkový příkon Ro v nádorové tkáni z této koncentrace radiojódu pak
je přibližně 40-80 mGy/hod, načež exponenciálně klesá s
efektivním poločasem přibližně 2 dny. Časový průběh
aktivity 131I v nádorové lézi je na obr.3.6.11 uprostřed v
pasáži "Plánování,
monitorování a dozimetrie radionuklidové terapie". Celková kumulativní absorbovaná dávka
v nádorovém ložisku (po uplynutí cca 10dní)
dosahuje asi 30-60 Gy (plyne z výše
uvedené analýzy v pasáži "Radiační
dávka a její distribuce při radionuklidové terapii"). Celotělová
dávka z terapeutické aplikace radiojódu přitom
činí cca 0,04-0,13 Gy/MBq, podle konkrétní fyziologické
situace pacienta (především funkční
stav ledvin). Z této celotělové dávky
lze přibližně odhadnout radiační dávku v kostní dřeni,
způsobující hematologickou toxicitu při
tyreologické radionuklidové terapii.
*) Jako anachronismus se v
literatuře stále ještě uvádějí doporučené hodnoty
terapeutické aktivity 3,7 či 7,4 GBq, vzniklé přímočarým
přepočtem z již dávno opuštěných jednotek aktivity
milicurie [mCi] - hodnot 100 či 200 mCi, zavedených jako hrubý
empirický odhad v 60.-70.letech 20.stol. V poslední době je
již odklon od paušálních terapeutických
aktivit.
Pečlivým monitorováním
dávkové distribuce s pomocí odběru krevních vzorků
(a popř. kvantitativní scintigrafie a metody MIRD, či alespoň
celotělové dozimetrie) lze individuálním dávkováním optimalizovat
terapeutický poměr, především vzhledem k hematologické
radiotoxicitě. Bez nebezpečí nadměrné radiotoxicity
tak lze v mnoha případech podstatně zvýšit
aplikovanou aktivitu (až na několik desítek GBq),
což vede k výraznému zlepšení terapeutického efektu
a snížení rizika repopulace nádorových buněk, recidivy či
nutnosti opakované terapie.
Před vlastní
radionuklidovou terapií karcinomu štítné žlázy se nejprve
provádí chirurgické odstranění štítné
žlázy - totální thyroidektomie (pacient
pak musí trvale užívat thyroxin, hormon štítné žlázy). Následuje aplikace tzv. eliminační dávky
radiojódu (cca 1-2GBq), která zlikviduje případnou funkční
tkáň štítné žlázy, zbylou po chirurgickém výkonu - aby
byla zajištěna biologická dostupnost
radiojódu v metastázách. Pro zjištění metastáz lze
provést scintigrafii po aplikaci diagnostické aktivity 131I (a příp. hormonální stimulaci - vysazení TSH nebo
aplikace thyrogenu). Pak se teprve aplikuje
hlavní terapeutická aktivita radiojódu,
jejíž příslušná část se již může
"nerušeně" vychytat v metastázách a způsobit tam
požadovaný terapeutický efekt. Prostřednictvím záření
gama 364keV lze průběžně radiometricky a scintigraficky monitorovat
průběh terapie - celotělová dozimetrie, vylučování
aktivity z organismu a rozmístění akumulujících metastáz.
Později je též vhodné provádět laboratorní sledování hladiny
thyreoglobulinu, což umožňuje rozpoznat recidivu.
Terapeutické aplikace radiojódu se v případě potřeby (na
základě laboratorních a scintigrafických vyšetření)
provádějí i opakovaně.
Dlouholeté zkušenosti s radionuklidovou terapií
ca štítné žlázy ukazují, že z hlediska kurativní
úspěšnosti je nejlepší hned napoprve aplikovat maximální
možnou aktivitu radiojódu, cca 10-20 GBq (jak
to jen jde z hlediska radiotoxicity), aby
byly jednorázově zlikvidovány všechny nádorové buňky
metastáz, bez repopulace a následné recidivy.
Tato metoda radioisotopové terapie karcinomu
štítné žlázy, prováděná na pracovištích nukleární
medicíny, je patrně vůbec nejúspěšnější
radioterapeutickou metodou nádorového onemocnění, vedoucí k
trvalému vyléčení - úspěšnost se pohybuje kolem 80%!
Bohužel však jen u zcela speciálního a poměrně řídkého
druhu nádorového onemocnění - diferencovaného karcinomu
štítné žlázy.
I u diferencovaného ca štítné žlázy však
bohužel v cca 20% metastatických karcinomů v průběhu času
dochází k dediferenciaci a ztrátě schopnosti
akumulovat jód. Radionuklidová terapie se stává neúčinnou,
radiojód - refrakterní. Systémová terapie
pak může pokračovat méně specifickými anti-angiogenními inhibitory
thyrosinkinázy (jako je sorafenib a lenvatinib). U
pacientů s přetrvávajícími nádorovými lézemi,
především neakumulujími radiojód, je též možno provádět
zevní radioterapii, buď konvenční nebo
stereotaktickou pomocí CyberKnife (výše "Stereotaktická radioterapie - SBRT. Gama - nůž.").
Terapie nenádorových onemocnění
štítné žlázy pomocí radiojódu 131I
Vedle terapie karcinomu štítné žlázy nachází léčba
radiojódem 131I uplatnění i při "méně radikální"
terapii nenádorových onemocnění štítné žlázy. Je to
především hypertyreóza (tyreotoxikóza,
Gravesova-Basodowova nemoc) - patologicky zvýšená činnost
štítné žlázy, při níž je do organismu vylučováno
nadměrné množství hormonu štítné žlázy T3,T4, které
působí škodlivě (toxicky) zejména na srdeční činnost. Zde
se pacientům aplikuje cca 200-600 MBq, ojediněle i více než
1000MBq, 131I (opět perorálně ve formě
roztoku jodidu sodného), který se
vychytává ve štítné žláze a radiačními účinky
záření b eliminuje část buněk štítné
žlázy, čímž se její zvýšená funkce snižuje a dostává
do normálu - eutyreózy. Hodnotu aktivity 131I k aplikaci je zde potřeba poměrně přesně individuálně
stanovit *) pro každého pacienta na základě
akumulace štítné žlázy, clearance a její geometrické
velikosti. Při nižší aplikované aktivitě by byl
terapeutický efekt nedostatečný, při vyšší aktivitě 131I by bylo
eliminováno nadměrné množství buněk a štítná žláza by
se dostala naopak do hypotyreózy - patologického
snížení funkce. Obdobným způsobem se provádí i terapie autonomního
adenomu štítné žlázy, přičemž aplikovaná
aktivita (opět individuálně dávkovaná) je zpravidla vyšší
(až 3GBq) a doba terapie delší (cca 10 dnů).
*)
Individuálně aplikovaná aktivita -
Marinelliho rovnice
Aktivita radiojódu, která má být podána, závisí na druhu
onemocnění, velikosti štítné žlázy, akumulaci jódu ve
štítné žláze a jeho clearanci ve žláze. Pro stanovení individuální
apliklované aktivity Aapl radiojódu,
potřebné k dosažení plánovaného terapeutického účinku -
požadované radiační dávky D[Gy] pro štítnou žlázu, se zde
používá semiempirický tzv. Marinelliho vzorec
(který v r.1948 zavedli L.D.Marinelli,
E.H.Quimby a G.J.Hine) :
Aapl[MBq] = D[Gy] . Mth[g] . 22,5 / (C[%] . Tef[dny]) ,
kde Mth je hmotnost štítné žlázy (či
její cílové části - strumy, adenomu)
odhadnutá z objemu získaného sonografickým vyšetřením, C je procento
akumulace radiojódu ve štítné žláze za 24 hod. od aplikace,
Tef je efektivní poločas poklesu aktivity radiojódu ve
štítné žláze. Koeficient 22,5 v sobě zahrnuje geometrické
vlivy a střední energii 191keV elektronů beta radiojódu.
Požadované cílové radiační dávky D jsou podle typu
onemocnění: mírná hyperthyreóza 70-80 Gy,
Gravesova choroba pro dosažení euthyreózy cca 150Gy,
polynodózní struma 100-150 Gy, autonomní uzly 300-400 Gy.
Pozn.: Radionuklidová
terapie štítné žlázy se ojediněle zkouší i jinými
radioisotopy, např. astatem 211At, který se podobně
jako jód akumuluje ve štítné žláze.
Léčba
hematologických onemocnění radiofosforem 32P
Pro léčbu hematologických maligních
onemocnění se používal radioaktivní fosfor 32P (T1/2=14,3dne,
Ebmax=1,7MeV, i.v.
aplikace cca 200-500MBq ve formě fosfátu),
který se částečně váže v kostní dřeni, kde záření
beta svými radiačními účinky působí v profázi dělení
mateřských buněk červených krvinek a snižuje tím
hematopoézu. Kromě toho se určitá část 32P inkorporuje do
nukleoproteinů mitoticky aktivních buněk, tedy i buněk
nádorových. Vliv 32P při potlačení dělení buněk není jen v účinku
ionizujícího záření, ale podílí se na něm i účinek
biochemický. Radioaktivní 32P, který se vestaví do geneticky důležitých molekul
DNA, RNA, nukleotidů, se při svém radioaktivním rozpadu
změní na síru 32S, čímž se změní i chemická struktura DNA, RNA. To
vede k poruchám či rozpadu těchto genetických látek, s
následnými změnami chromozomovými; výsledkem je smrt buněk
či zpomalení proliferace nádorové tkáně.
Radiofosfor 32P se používal především u polycytemie
(polycythaemia vera - vyznačuje
se nadměrnou produkcí červených krvinek s hyperplazií
hematopoetické tkáně), kde účelem
léčby je předcházet cévním mozkovým příhodám a dalším
nepříznivým příznakům, podmíněným zvýšením celkového
objemu červených krvinek. Radiofosfor 32P se zkoušel podávat i u chronických myeloidních
leukémií, lymfogranulomu, lymfosarkomu, mnohočetného myelomu
- u části pacientů se projevil paliativní účinek. Celkově
je však léčba radiofosforem již prakticky opuštěná;
kromě relativně malého terapeutického efektu (při celkově
vysoké radiační zátěži, především hematologické
radiotoxicitě) je jedním z důvodů i riziko zvýšeného
výskytu akutní leukemie při této terapii.
Radionuklidová terapie nádorů a
metastáz
Otevřené radionuklidy b či a se často používají pro paliativní
radioterapii u pokročilých stádií nádorových
onemocnění (zvláště u metastatického
postižení skeletu, častého např. při karcinomu
prostaty, prsu či plic), jakož i pro kurativní
radioterapii vybraných nádorových onemocnění.
Účinné možnosti tzv. radioimunoterapie jsou
zmíněny níže.
Podmínkou úspěšnosti paliativní terapie
skeletu je přítomnost osteoblastické aktivity
u metastáz - zjišťuje se pozitivním nálezem na scintigrafii
skeletu. Po aplikaci vhodného osteotropního radiofarmaka
značeného b-radionuklidem se toto radiofarmakum poměrně
selektivně vychytává v osteoblasticky reaktivní zóně
obklopující metastatický kostní proces. Lokální absorbce
radiační dávky z b-záření způsobuje lokální inhibici nervových
zakončení a tím požadovaný analgetický účinek.
Bohužel nedochází zpravidla k výraznějšímu zmenšení
velikosti vlastního tumoru (metastázy) - účinek většinou
není kurativní, ale jen paliativní. V minulosti (50.-60.léta) byl pro tento
účel zkoušen výše zmíněný radioaktivní fosfor 32P (cca 500MBq, ve formě fosfátu),
avšak pro vysokou radiační zátěž kostní dřeně se již
pro paliativní terapii metastáz nepoužívá.
Vedle známého radiojódu 131I
je v molekulární radioterapii - paliativní i kurativní
- nyní používáno několik dalších radionuklidů (některé zatím jen experimentálně, jiné již
klinicky) :
Skandium 47Sc (fyzikální
vlastnosti §1.4., pasáž 47Sc)
[T1/2=61,85hod., Ebmax=600keV, g 159keV(68%)]
............
Sekvence 44Sc/47Sc může být teranostickou dvojicí
isotopů pro PET scintigrafii + radionuklidovou terapii........
Měď 67Cu
[T1/2=3,35dne, Ebmax=0,65MeV; g 91keV (7%),
93keV (16%), 185keV (49%)]
....................
Kombinace Cu-64
pro scintigrafii PET a Cu-67 pro terapii beta-zářením mohou
sloužit pro teranostiku v nukleární medicíně.
Stroncium 89Sr (fyzikální
vlastnosti §1.4., pasáž 89Sr)
(T1/2=50,5dne, Ebmax=1,5MeV; aplikace
cca 150MBq, chlorid)
Stroncium má podobný metabolismus jako kalcium a proto je 89Sr intenzívně
ikorporováno do anorganické složky kostní hmoty. V
metastatických kostních lézích je akumulace až 10-krát
větší než ve zdravé kostní tkáni.
Ytrium 90Y (fyzikální
vlastnosti §1.4., pasáž "90Y")
(T1/2=2,7dne, Ebmax=2,28MeV)
Hlavní využití isotopu 90Y, jakožto prakticky čistého b-zářiče, je v
terapeutické nukleární medicíně, kde se využívají vysoce
energetické beta-částice v radioimunoterapii,
paliativní terapii metastáz či radiační
synovektomii. Relativně delší dosah těchto beta
elektronů v tkáni umožňuje rovnoměrné prozáření
větších nádorů, vykazujících často heterogenní
prokrvení a hypoxii. Vzhledem k vysoké energii záření beta
se u 90Y-radiofarmak
výrazně uplatňuje efekt "křížové palby" (obr.3.6.8 vpravo). Nejčastěji
se používá 90Y-ibritumomab tiuxetan pro terapii lymfomů,
viz níže "Radioimunoterapie".
Fyzikální vlastnosti radionuklidu 90-ytrium jsou podrobně
rozebírány v §1.4., pasáž "Y-90".
Slabé pozitronové a
anihilační záření 90Y nemá přímý radiační význam, je naprosto
přezářené intenzívním brzdným zářením. Zkouší se
však možnost využít i tak slabé anihilační záření
511keV pro zobrazení biodistribuce
teraputických radiofarmak značených 90Y pomocí pozitronové emisní tomografie PET
(koincinčním režimem detekce je brzdné
záření silně potlačeno, takže anihilační záření může
být úspěšně detekováno) s vyšším
rozlišením, než jednofotonová scintigrafie (planární,
SPECT) s použitím brzdného záření.
Radiojód 131I ( fyzikální
vlastnosti §1.4., pasáž "131I")
[T1/2=8dnů, Ebmax=606keV, g: 284keV(6%),
364keV(81%), 637keV(7%), 723keV(2%)] - je
nejznámnějším a nejdéle používaným radionuklidem pro
scintigrafickou diagnostiku i radionuklidovou terapii - monoteranostický
radionuklid. Používá se nejen u štítné žlázy "Terapie
štítné žlázy radiojódem 131I", ale i pro značení některých monoklonálních
protilátek v biologicky cílené radionuklidové terapii
nádorových onemocnění.
Samárium 153Sm (fyzikální
vlastnosti §1.4., pasáž "153Sm")
(T1/2=2dny, Ebmax=800keV, g 70keV(5%) a 103 keV(28%); aplikace cca 2GBq, chemická
forma EDTMP - ethylene diamine tetra methylene phosphonate)
Chelátový komplex 153Sm-EDTMP se váže na hydroxyapatit a selektivně se
akumuluje v kostní tkáni, zvláště v oblastech jeho
zvýšeného obratu - v kostních metastázách je cca 5-krát
větší akumulace než ve zdravé kostní tkáni.
Rhenium 186Re (fyzikální
vlastnosti §1.4., pasáž "186Re")
(T1/2=3,8dne, Ebmax=1,07MeV, slabé g 137keV(9%); aplikace cca 1500MBq, chem. forma HEDP -
hydroxy ethyliden diphosphonate)
Tento komplex se rovněž váže na hydroxyapatitové krystalky. Pozn.: Ve stejné chemické formě HEDP se
zkušebně používá i rhenium 188Re
(T1/2=0,7dne, Ebmax=2,12MeV; získává se z generátoru 188W/188Re).
Terbium 149Tb (fyzikální vlastnosti §1.4.,
pasáž "149Tb")
Poločas 4,12hod., smíšený alfa+beta+ zářič. V 76,2%
dochází k elektronovému záchytu a v 7,1%
probíhá b+-radioaktivita (střední Eb+=730keV),
v obou případech na excitované hladiny 149Gd. V 16,7% dochází alfa-radioaktivitě
(Ea=3,97MeV) na základní stav 145Eu. Při deexcitacích vzniklých vzbuzených stavů
dceřinného gadolinia-149 je emitováno velké množství (více
než 300 !) fotonů gama-záření, z nichž
významnou intenzitu mají fotony s energií: 165keV (26%),
352keV (29%), 389keV (18%), 652keV (16%), 817keV (12%), 853keV
(15%). Experimentálně se zkouší jako monoteranostický
radionuklid v radioimunoterapii např. u lymfomu pro
označení rituximabu.
Terbium 161Tb (fyzikální vlastnosti §1.4.,
pasáž "161Tb")
(T1/2=6,9dne, Ebmax=1,07MeV, g 25,6keV
(23%), 49keV (17%), 74,5keV (10%), 88keV (0,2%)). Terbium-161
se zatím experimentálně používá v nukleární medicíně k
biologicky cílené radioisotopové terapii
nádorových onemocnění (§3.6, část
"Radioisotopová
terapie"). Má podobné vlastnosti a terapeutické využití jako
již úspěšně používané lutetium 177Lu , oproti
němuž se očekává poněkud zvýšená terapeutická
účinnost, způsobená větším zastoupením konverzních a
Augerových elektronů / 1rozpad. Zkouší se při terapii
neuroendokrinních nádorů a především pro
kurativní terapii ca prostaty - 161Tb značené monoklonální protilátky,
jako je 161Tb-PSMA617 anti-prostatický specifický
membránový antigen (PSMA - ligand).
Uvažuje se též o teranostické dvojici 165Tb pro
scintigrafickou diagnostiku a 161Tb pro biologicky cílenou radionuklidovou terapii.
Lutetium 177Lu (fyzikální
vlastnosti §1.4., pasáž "177Lu")
(T1/2=6,7dne, Ebmax=593keV, g 113keV (6,2%) a 208keV (10,4%)).
Lutetiem-177 se značí somatostatinové receptory
(resp. jejich analogy), které mají afinitu k neuroendokrinním
gastroenteropankreatickým tumorům. Používají se lutetiem
značené analogy oktreotidu (DOTATATE, DOTA-TOC), jako
je 177Lu-oxodotreotid..........
Velmi úspěšná je 177Lu-J591
a 177Lu -PSMA617
značená monoklonální protilátka - ligand - na specifický
membránový prostatický antigen PSMA,
která v mnoha případech dovede vyléčit i generalizovaný
metastatický hormonálně independentní ca prostaty. Slibný je
též 177Lu-rituximab a 177Lu-tetraxetan-tetulomab pro
léčení CD20- pozitivních lymfomů. Podrobněji je
diskutováno níže v pasáži "Radioimunoterapie".
Aplikace cca 1,5GBq,
Rádium 223Ra
(fyzikální vlastnosti §1.4.,
pasáž "223Ra")
(T1/2=11,4dne,
rozpadová řada 223Ra (11,4 d., a) ® 219Rn
(4 s., a) ®
215Po (1,8 ms., a ) ® 211Pb (36,1 min., b-) ®
211Bi (2,2 min., a ) ® 207Tl (4,8 min., b-) ®
207Pb (stabilní), Ea:
5,7MeV, 6,8MeV, 7,4MeV, 6,6MeV, Ebmax=1,4MeV, Eg: 0,15-1 MeV).
Aplikace cca 5MBq, chem. forma chlorid 223RaCl2 pro paliativní terapii kostních metastáz. Viz však
níže uvedenou kritickou poznámku "223Ra není vhodný terapeutický radionuklid!".
Astat 211At
(T1/2=7,2hod., Ea: 5,8MeV,.....,
). Zkouší se chem. forma 211At-cMAb U36 - značená
chimerická monoklonální protilátka U36 s afinitou k nádorům
z dlaždicových buněk v oblasti hlavy a krku, dále 211At-MABG
- metaastatobenzylguanidin pro terapii neuroblastomů.
Vizmut 212Bi
(T1/2=60min., Ea:
6,1MeV; 8,8MeV, Ebmax2,25MeV, ...
Aktinum 225Ac (fyzikální vlastnosti §1.4., pasáž "225Ac")
se s poločasem 10 dní rozpadá kaskádou 4 alfa
přeměn (v kombinaci s nevýznamnou alfa-beta
větví) na další krátkodobé radionuklidy: 225Ac(10d.; a) ® 221Fr(4,8m.; a) ® 217At(32ms.; a) ® 213Bi(46m.; b-) ® 213Po(4ms.; a) ® 209Pb(3,3h.; b-) ® 209Bi(stab.),
uvolňuje se energie asi 27 MeV. Velmi úspěšná
je terapie metastatického karcinomu prostaty pomocí 225Ac-PSMA617
značené monoklonální protilátky - lighandu - na specifický
membránový prostatický antigen PSMA.
Thorium 227Th
(fyzikální vlastnosti §1.4.,
pasáž "227Th")
(T1/2=18,7dne,
rozpadová řada 227Th (18,7 d., a) ®
223Ra (11,4 d., a) ® 219Rn (4 s., a) ® 215Po
(1,8 ms., a ) ® 211Pb (36,1 min., b-) ®
211Bi (2,2 min., a ) ® 207Tl (4,8 min., b-) ®
207Pb (stabilní), Ea: 6MeV,
5,7MeV, 6,8MeV, 7,4MeV, 6,6MeV, Ebmax=1,4MeV, Eg: 0,15-1 MeV)
....
.............doplnit další..........
Radiofarmaka,
značená radionuklidy které se přeměňují na další
krátkodobější radionuklidy (či celou rozpadovou řadu), se
někdy označují jako "in vivo generátory"
- viz §1.4, pasáž "In vivo generátory v nukleární medicíně". Z výše uvedených to jsou radium 223Ra (které je však problematické,
viz poznámku níže), aktinium 225Ac a thorium 227Th.
-----------------------------------------------------------------------------------------------------------
Na tomto místě bude možná vhodné zopakovat kritickou
poznámku uvedenou v §1.4, pasáži "223Ra" :
223Ra není vhodný
terapeutický radionuklid !
Základní podmínkou použitelnosti daného radionuklidu v
nukleární medicíně je možnost chemického
navázání jeho atomu na vhodnou biochemicky cílenou
molekulu, která zajistí "dopravu" radionuklidu do
cílových tkání a orgánů za účelem diagnostického
zobrazení nebo terapeutického účinku. Toto chemické
navázání může být přímé (u jednoduchých
molekul) nebo prostřednictvím chelatačních činidel
(tak je tomu především u moklonálních protilátek).
Dostatečně pevná vazba, přímá nebo s chelatační látkou,
závisí především na oxidačním čísle
(mocenství) atomů daného prvku.
Prvek radium, a tedy i 223Ra, má oxidační číslo 2 a nejsou pro něj
k dispozici vhodná chelatační činidla. Takže radium není
perspektivní pro vytváření 223Ra-radioimunokonjugátů! Naopak, atomy
radionuklidů thorium 227Th nebo aktinium 225Ac, s oxidačním číslem 4, jsou
schopny tvořit vysoce stabilní komplexy s chelátory a jsou
proto vhodné pro biologicky cílenou
radionuklidovou terapii.
Přes tyto skutečnosti byl s radiem 223Ra vyvinut
terapeutický preparát chlorid 223RaCl2 Alpharadin (fy Nanovector jej vyvinula s
maximální pečlivostí...), později přejmenovaný firmou
Bayer na Xofigo, pro paliativní terapii kostních
metastáz. Firemní reklama hovořila i o kurativním účinku,
což se nepotvrdilo. A paliativní účinek se nakonec ukázal
prakticky stejný jako u mnoho let používaných preparátů s
radionuklidy stronciem 89Sr (Metastron) či samariem 153Sm (s fosfátovým ligandem EDTMP),
které jsou několikanásobně levnější a odzkoušené.
Použití 223Ra pro terapii kostních metastáz u ca prostaty je
nyní již nesmyslné vzhledem k tomu, že existují účinné
monoklonální protilátky anti-PSMA značené 177Lu nebo 225Ac, které jsou
schopny kurativně působit nejen na kostní
metastázy, ale i na nádorová ložiska ve všech ostatních
tkáních a orgánech, i v pokročilém stádiu.
Prosazení radia 223Ra bylo chybné již od samého
začátku - takto jsme to na našem pracovišti reflektovali. Až
toto nahlédne většina kolegů z oboru nukleární medicíny,
bude 223Ra
pravděpodobně definitivně opuštěno...
-----------------------------------------------------------------------------------------------------------
Účinnost terapie výše
uvedenými radiofarmaky lze zlepšit současným podáním
některých cytotoxických látek (např. mytomycin nebo
cisplatina) - cytostatik, které zde působí jako radiosenzibilizátory.
Velikost aplikované aktivity, a tím i terapeutického účinku,
je limitována nežádoucími toxickými
účinky, především hematologickými.
I když paliativní terapie nevede zpravidla k
vyléčení nádorového onemocnění, její význam spočívá v
tom, že u vysokého procenta pacientů podstatně zlepšuje
kvalitu života po dobu mnoha měsíců (při opakované
terapii i několika let). Je určitá naděje, že v budoucnu se
podaří na podobném principu provádět i účinnou kurativní
terapii, např. specifickými protilátkami proti
nádoru s navázaným radionuklidem. Při radioimunoterapii
(viz níže)
monoklonální protilátka "donese" zářič přímo k
nádorovým buňkám, takže radiace je soustředěna
především na nádorovou tkáň, s minimálními radiačními
účinky na normální tkáně. Podobně může být cíleně
dopraveno k nádorovým buňkám chemoterapeutikum -
cytostatická látka.
Radioimunoterapie (RIT)
Slibnou metodou, jak "dopravit" terapeutický
radionuklid ke všem místům nádoru, i do drobnějších
nádorových ložisek rozesetých v těle, je označení vhodné protilátky
k danému typu tumoru zářičem b nebo a a její aplikace do
organismu. Imunitní mechanismus nádorových buněk zajistí,
že takovéto (monoklonální) protilátky jsou schopny si v
podstatě nezávisle "najít" příslušné antigeny a selektivně
se na ně navázat. Do nádorového ložiska je takto vnesen
radioaktivní isotop a nádorová tkáň obdrží příslušnou
dávku záření, která může vyvolat žádoucí terapeutický
efekt. Tento efekt může být účinný i proti refrakterním
nádorovým tkáním, odolným vůči chemoterapii.
Imunoterapeutika jsou schopny napadat i velmi malé nádory (jako jsou rané metastázy),
které nejsou registrovány zobrazovacími technikami; příp. i
cirkulující nádorové buňky daného typu.
Jedná
se o cílenou radioterapii vedenou pouze proti
konkrétním druhům buňek (to ovšem
bohužel jen teoreticky, ve skutečnosti je selektivita jen
relativní, v praxi se optimálních výsledků zatím zdaleka nedosahuje). Radioimunoterapie (RIT) tedy spočívá v cíleném
vychytávání radioaktivně značených nádorově asociovaných
monoklonálních protilátek (mAb), které se pro nádorové
buňky takto stávají cytotoxickými.
Cílená biologická terapie pomocí
(neradioaktivních) monoklonálních protilátek byla stručně
rozebírána výše v části "Chemoterapie",
pasáž "Monoklonální protilátky". Radioimunoterapie kombinuje biologické
a radiolytické mechanismy ničení nádorových buněk.
Radionuklidově značené monoklonální protilátky dokáží
inaktivovat a ničit nádorové buňky dvojím způsobem:
1. Přímou vazbou protilátky na
příslušný antigen s aktivací kaskády nitrobuněčných
signálních drah, které nakonec vedou ke smrti nádorové
buňky.
2. Dominantní je zde však radiobiologické
působení ionizujícího záření z navázaného radionuklidu.
Pokud je použit radionuklid s vysokou energií záření b (jako je 90Y s max. energií 2,3MeV a dosahem v tkáni cca 5mm,
což představuje zhruba 100-200 buněčných průměrů, 131I, nebo 177Lu), dokáže toto záření zničit i ty nádorové
buňky, které nejsou v přímém kontaktu s navázaným
radiofarmakem - které nemají příslušné receptory, nebo kam
protilátka uvnitř nádoru nepronikla v důsledku sníženého
prokrvení. Tyto buňky se dostanou do "křížové
palby" tvrdého záření z radionuklidu, navázaného na
okolní buňky (jak bylo ukázáno na
obr.3.6.8 vpravo nahoře).
Radioimunoterapie lymfomů
Nejčastěji používaným
radioimunoterapeutikem tohoto druhu je ibritumomab
tiuxetan značený 90Y (Zevalin), což je IgG1
monoklonální anti-CD20 protilátka proti non-hodgkinovským
folikulárním lymfomům z B-lymfocytů, na niž
je pomocí chelátoru tituxetanu navázán radionuklid 90Y; aplikuje se cca
1GBq. Pro stejný účel se používá tositumomab
značený 131I (Bexxar); vzhledem k výrazné g-složce záření 131I lze provádět
scintigrafické monitorování.
Pro léčení CD20-
pozitivních lymfomů je dále nadějný 177Lu-rituximab
a anti-CD37 radio-imuno-konjugát 177Lu-tetraxetan-tetulomab
(Tetulomab se nověji nazývá Lilotomab)
*). 177Lu je poměrně
nízkoenergetický beta-zářič (max. energie
497keV - fyzikální vlastnosti §1.4., pasáž "177Lu"),
max. dosah v tkáni cca 2mm - viz výše uvedená tabulka. To
může být výhodné vzhledem k tomu, že nádorové buňky
lymfomu často infiltrují do normálních tkání v difuzní
(rozptýlené) formě. Kratší pronikání
záření 177Lu
(vychytaného v nádorových buňkách) do okolních tkání může vést k příznivějšímu poměru účinku
tumor/zdravá tkáň. Kromě toho 177Lu
emituje záření gama (113keV(3%)
a 208 keV(6%)), které může být použito
pro scintigrafické zobrazení -
monitorování biodistribuce radiofarmaka a dozimetrické
posouzení průběhu terapie. Energie a zastoupení
gama-záření je zde přitom podstatně nižší než u 131I, což je
příznivé z hlediska celotělové radiační zátěže.
*) Anti-CD20 a anti CD37 se zkouší kombinovat.
Terapie lymfomů zpravidla začíná několika cykly anti-CD20
rituximabu, příp. radioaktivně značených monoklonálních
protilátek ibritumomabu, tositumomabu či rituximabu. To však
může vést k selekci nádorových buněk se sníženou expresí
CD20 a tím k menšímu účinku další následné terapie
anti-CD20. Za situace relapsujícího lymfomu po neúspěšné
anti-CD20 terapii se zde však vhodným alternativním
terapeutickým cílem může stát CD37,
exprimovaný transformovanými B-buňkami - může nastoupit
anti-CD37 tetulomab, který se navíc podstatně rychleji
internalizuje uvnitř nádorových buněk.
Ve stadiu laboratorního zkoušení je imunoterapie lymfomů s
použitím alfa-značených monoklonálních
protilátek thoriem 227Th - rituximabu nebo anti CD22.
Karcinom prostaty
Radioisotopová
terapie múže zvítězit nad rakovinou prostaty !
Ca prostaty je jedním z nejčastějších druhu nádorovího
onemocnení u mužu, zejména ve veku vyšším než 50 či 60
let (vyskytuje se však i u mladších ročníků). Pokud je
nádorové onemocnění včas diagnostikováno (např.
biochemicky zvýšenou hladinou PSA) a nerozšířilo se ješte
metastaticky do dalších tkání a orgánů, je klasickým
způsobem chirurgické řešení (prostatektomie), s případnou
adjuvantní radioterapií či chemoterapií. V řadě případů
může být úspěšná i hormonální terapie.
Pokud však již došlo ke vzniku metastáz v jiných tkáních a
orgánech (často ve skeletu), je situace složitější.
Hormonální terapie může fungovat jen dočasně (metastázy se
časem stanou hormonálně refrakterními) a chemoterapie též
není schopna dosáhnout trvalého kurativního efektu; terapie
se stává často již jen paliativní.
Buňky prostaty, včetně nádorových buněk v metastázách,
však mají na svém povrchu – na stěně buňky, membráně
– tzv. prostatický specifický membránový antigen PSMA.
Ten se může stát cílem biologicky specifické terapie pomocí
tzv. monoklonálních protilátek. Bylo vyvinuto několik
takových molekul, na které je možno dále navázat vhodnou
radioaktivní látku – radioisotop neboli radionuklid. Taková
látka, radiofarmakum, se pak cíleně vychytává v nádorových
buňkách metastáz a záření beta či alfa z radionuklidu
účinně tyto buňky likviduje.
V soucasné době je velmi úspěšná beta-radionuklidem
lutetiem-177 177Lu-J591 a 177Lu-PSMA617 značená monoklonální
protilátka - ligand - na specifický membránový
prostatický antigen PSMA, která v mnoha případech dovede
vyléčit i generalizovaný metastatický hormonálně
independentní ca prostaty. Ještě snad o něco účinnější
se jeví alfa-radionuklidem aktiniem-225 značené 225Ac-PSMA617.
Můžeme tedy zrekapitulovat :
Pro terapii metastatického karcinomu prostaty byla
vyvinuta monoklonální protilátka J591 na
specifický membránový prostatický antigen (PSMA), značená lutetiem 177Lu (nebo
ytriem 90Y).
Na tomto základě byl vytvořen ligand 177Lu-PSMA-617 konjugovaný s chelátorem
DOTA. Toto perspektivní radiofarmakum vykazuje vysokou
specificitu nádorového zacílení na prostatické tumory a
zároveň poměrně nízkou hematotoxicitu (určitým
problémem ale může být zvýšená radiační zátšž v
ledvinách; během terapie se doporučuje podávat roztok
aminokyselin obsahující L-lysin a L-arginin). U pokročilé ca prostaty s kostními metastázami zde
vykazuje ještě lepší výsledky s velmi malou hematotoxicitou
použití alfa-radionuklidu aktinia-225 - 225Ac-PSMA-617; krátkodosahové
alfa-záření z kostních metastáz nepronikne ke kostní
dřeni. Pro komplexní radionuklidovou terapii nádorů prostaty,
včetně mikrometastáz a cirkulujících nádorových buněk, se
možná jako perspektivní jeví kombinovaná tandemová
terapie pomocí 177Lu-PSMA-617, které efektem "křížové
palby" elektronů b může být účinné na větší a heterogenní
nádory, a 225Ac-PSMA-617 kde a-částice díky vysoké lokální hustotě ionizace
mohou být účinné i na mikrometastázy a osamocené nádorové
buňky.
Zdá se, že toto
je jediná reálná naděje pro záchranu zdraví i
života pro tisíce pacientů s pokročilým
karcinomem prostaty! Podmínkou ovšem je, aby nádorové léze
vykazovaly dostatecnou expresi PSMA – zjištuje se
scintigraficky na pracovišti nukleární medicíny.
Tato nová terapie by se pokud možno měla aplikovat jako metoda
první volby, a ne až když již všechno selhalo a organismus
je vážně poškozen a oslaben vedlejšími účinky předchozí
neúspěšné terapie.
Neuroendokrinní
nádory
Na povrchu buněk neuroendokrinních nádorů jsou
obvykle ve zvýšené míře exprimovány receptory somatostatinu
(oligopeptid obsahující 14 či 28
aminokyselin). U neuroendokrinních
nádorů se proto provádí terapie pomocí radioaktivně
značených somatostatinových analogů s využitím
cesty peptid-ligand-receptor - PRRNT (Peptide
Receptor RadioNuclide Therapy). Používají se
radioaktivně značené somatostatinové analogy 90Y-DOTATOC ([DOTA0, Thyr3] - octreotide) a 177Lu-DOTATATE ([DOTA0, Tyr3,Trh8] - octreotate);
Tyr3 je modifikovaný octreotid, DOTA (1,4,7,10-kyselina
tetraoctová) je bifunkční chelatační
molekula pro vazbu kovového atomu radionuklidu s biomolekulou
octreotidu. Doporučená aplikovaná aktivita: 90Y-DOTATOC/DOTATATE
2,5-4,5 GBq ve 2 frakcích; 177Lu-DOTATOC/DOTATATE 5,5-7,5 GBq ve 3-5 frakcích.
Intervaly mezi frakcemi 6-12 týdnů. V poslední době se
používá i novější derivát 177Lu-oxodotreotid; doporučené dávkování jsou 4 infuze
po 7 GBq, s časovým odstupem cca 8 týdnů. Z nežádoucích
účinků na rizikové kritické tkáně je třeba sledovat
především hematotoxicitu a nefrotoxicitu (pro
ochranu ledvin během terapie se doporučuje podávat roztok
aminokyselin obsahující L-lysin a L-arginin).
Pro optimalizaci terapie větších i menších
nádorů se někdy doporučuje kombinovaná terapie s 90Y a 177Lu značenými
peptidy: aplikace 2,5-5 GBq 90Y a následně 5,5-7 GBq 177Lu, ve 2-6 cyklech v časových intervalech 6-16 týdnů
(či souběžné podávání "kokteilu" 177Lu a 90Y).
Pro scintigrafickou diagnosiku se k zobrazení
příslušných nádorů i k posouzení vychytávání a predikci
efektu terapie somatostatinovými analogy používají tyto DOTA
preparáty značené 68Ga (PET gamagrafie), nebo octreotid
označený indiem - 111In-pentetreotid (OctreoScan), či 99mTc-octreotid pro
klasickou scintigrafii. Pouze v případě pozitivního
scintigrafického zobrazení zvýšené exprese
somatostatinových receptorů má význam provést PRRNT
radionuklidovou terapii.
Dále se pro terapii neuroendokrinních
nádorů, zvláště neuroblastomu a feochromocytonu, používá 131I-MIBG
(meta-jodobenzylguanidin) nebo 211At-MABG (meta-astatobenzylguanidin).
Zkoušení dalších značených protilátek
Ve stádiu zkoušení je řada dalších přípravků, např. 131I-anti-CD45 (BC8)
při akutní leukemii, 131I-81C6 anti-tenascin proti maligním mozkovým
nádorům, 90Y-anti-CD66 proti akutní leukemii, 153Sm-DTPA-cetuximab, 180Tm-DOPA-cetuximab, 153Sm-bleomycin....atd...(...přijde doplnit).
Zajímavým a snad perspektivním prostředkem
cílené biologické terapie by mohly být tzv. aptamery
(zmíněné výše v části "Chemoterapie a
biologická léčba"), které lze speciálně vytvořit pro selektivní vazbu
na různé druhy biomolekul. Ve stádiu experimentálního
zkoušení je radioaktivní označení "eskortních"
aptamerů, které by mohly cíleně
vnést-dopravit terapeutický radionuklid do daných nádorových
buněk.
Společným problémem radioisotopové
imunoterapie je zatím poměrně nízká specificita
a neúnosně vysoká cena.
Radioimunoterapie se
často provádí v kombinaci s chemoterapeutickou imunoterapií
(neradioaktivními) monoklonálními protilátkami, s vhodným
časovým odstupem.
Např. u lymfomu se před aplikací 90Y-ibritumomab
tiuxetanu podává rituximab (zmíněný výše v
části "Chemoterapie a biologická léčba") v odstupu několika dní a opakovaně několika
hodin před vlastní aplikací. Vedle příspěvku přímého
imunoterapeutického účinku, rituximab odstraní z krve volné
cílové buňky lymfomu, což zvýší dostupnost vazby
radioaktivního 90Y-ibritumomab tiuxetanu v
nádorových ložiscích.
Radioaktivní
mikrosféry - SIRT
Na pomezí mezi permanentní
intersticiální brachyterapií a biologicky cílenou
radionuklidovou terapií je speciální metoda SIRT
(Selective Internal Radiation Therapy). Jedná se o
cílené ozáření jaterních nádorů (primárních nebo
metastáz) zavedením mikrosfér pryskyřice s
navázaným b-radionuklidem (yttriem 90Y,
popř. 177Lu nebo 188Re) do větví arteria
hepatica, odkud se tyto mikrosféry dostanou do jaterních
metastáz, kde se zachytí v jejich kapilárním cévním
řečišti a vnitřně tyto nádory ozařují;
dochází přitom rovněž k redukci krevního zásobení nádoru
- intrahepatální radioembolizace. Do větve arteria
hepatica, zásobující nádor, se pomocí katetru aplikuje
několik milionů mikrosfér, každá průměru cca 35mm, o úhrnné
aktivitě cca 1-2 GBq 90Y. Uvnitř nádoru se pak
dosahuje radiační dávky cca 100-200 Gy, v průběhu asi 10
dní. Tato metoda má převážně paliativní účinek.
Tuto metodu jsme zde zmínili jen pro úplnost.
Používá se velmi zřídka a její význam je
diskutabilní...
Cílení terapie mimo
nádorové buňky
Zajímavou metodou, zatím ve stádiu laboratorního zkoušení,
je cílení terapie nikoli přímo na nádorové buňky, ale do
tkáňového nádorového prostředí - stromatu.
Je diskutováno výše v pasáži "Složitá heterogenní
biologická struktura nádorové tkáně".
Radionuklidová synovektomie
Tato metoda radioisotopové terapie svou povahou
přímo nespadá do biologicky cílené radioterapie (radionuklid
se co cílové tkáně nedostává metabolickou cestou), ale je
to zvláštní případ intrakavitální permanentní
brachyterapie s použitím otevřených radionuklidů.
Radionuklidová synovektomie (zvaná též někdy radiosynoviortéza
- RSO) se používá pro léčbu některých chronických koubních
onemocnění, u nichž dochází k nadměrné tvorbě
nitrokloubní tekutiny (hydropos) v hyperplasticky
zmnožené synoviální výstelce kloubu. Je to především
revmatiodní artritida, recidivující výpotky v kloubu,
recidivující dekompenzovaná artróza, artritis psoriatica a
další. Do dutiny kloubní se vstřikuje vhodný b-radionuklid v
inertní formě koloidu (vodní suspenze
citrátu nebo sulfidu)*), který se prakticky všechen absorbuje
na povrchu synoviální membrány (koloidní
částice jsou fagocytovány povrchově uloženými makrofágy v
synoviální membráně) a svými
radiačními účinky způsobuje fibrotizaci a nekrózu
povrchové vrstvy synoviální membrány. Díky krátkému dosahu
záření b se ozáření omezí pouze na synoviální výstelku,
aniž dojde k poškození chrupavky. Výsledkem této terapie je
omezení nadměrné tvorby nitrokloubní tekutiny, odstranění
otoku a vymizení bolestivosti kloubu - lokální zastavení
zánětlivého procesu, většinou dočasně, někdy i trvale.
*) Z hlediska celkového rozdělení
radioterapeutických metod lze radionuklidovou synovektomii
označit za specfickou metodu permanentní
intrakavitární brachyterapie s použitím
otevřeného radionuklidu, který se vychytá na povrchu
struktury, která má být radiačně inhibována (synoviální
výstelka).
Pro dosažení optimální radiační dávky při
různých tloušťkách synoviální membrány u různých
kloubů je vhodné aplikovat radionuklidy s různou
energií záření b a tím různou penetrací - doletem
záření (čím větší kloub, tím vyšší energie b), o aktivitě
podle velikosti kloubu. Pro terapii kolenního
kloubu se používá ytrium 90Y
(T1/2=2,7dne, Ebmax=2,28MeV; aplikace
cca 200MBq ve formě citrátu; fyzikální vlastnosti §1.4.,
pasáž "90Y"). Pro loket, rameno, zápěstí, kotník se používá rheium
186Re (T1/2=3,7dne, Ebmax=1,08MeV, slabé g 137keV(9%); aplikace cca 50-200MBq ve formě sulfidu;
fyzikální vlastnosti §1.4., pasáž "186Re"). Pro malé klouby rukou a nohou pak erbium 169Er
(T1/2=9,4dne, Ebmax=352keV; aplikace
cca 20-80MBq ve formě citrátu). Pro
teraii kolenního a ramenního kloubu se někdy používá i holmium
166Ho (T1/2=27hodin, Ebmax=1,8MeV, slabé g 48-58keV(9%) a 81keV(6%); aplikace cca 400MBq ve formě
Fe-hydroxi-makroagregátů nebo boro-makroagregátů). Dříve používané koloidní zlato 198Au
(T1/2=2,7dne, Ebmax=961keV, g 412keV(96%) a
676keV(1%); aplikace cca 100MBq) mělo
nevýhodné fyzikální vlastnosti (velmi
silnou složku g, způsobující nežádoucí radiační zátěž i mimo
cílovou oblast) a je nyní již
opuštěné.
3.7.
Technologické využití záření
Radiační technologie jsou procesy výroby a
modifikace materiálů, založené na fyzikálních a chemických
změnách vyvolaných ozářením ionizujícím zářením. Při
vhodné aplikaci lze ionizující záření využít k vyvolání
žádoucích změn v ozařovaném materiálu.
Radiační chemie
Důležitou oblastí využití radiačních technologií je radiační
chemie, která vyžívá chemických reakcí vyvolaných
nebo iniciovaných ionizujícím zářením. Radiačně
vytvořené ionty a radikály jsou chemicky
velmi reaktivní, takže ozáření může v
látkách "nastartovat" celou řadu chemických reakcí
*). Některé z těchto reakcí mají řetězový charakter -
relativně ne příliš velká dávka záření iniciuje reakci,
která pak již probíhá samovolně a přináší výrazný
efekt. Příkladem takových řetězových reakcí je radiační
polymerace. Výhodou takto radiačně připravených
polymerů je mimo jiné to, že výsledný materiál není
znečistěn chemickými katalyzátory či iniciátory (které by
bylo nutno použít při klasických technologiích).
*) Radiačně stimulované chemické reakce
za spolupůsobení kosmického záření
sehrály pravděpodobně velmi důležitou úlohu při syntéze
molekul složitějších chemických látek, které posléze
umožnily vznik a vývoj života - viz "Kosmické záření", část "Biologický
význam kosmického záření".
K těmto reakcím docházelo jak na Zemi, tak především ve
vesmíru na částečkách mezihvězdného prachu, odkud se
vzniklé látky mohly před více než 3 miliardami let dostat na
Zemi při dopadu meteoritů z rozpadlých komet.
Radiační sterilizace
Vysokými dávkami záření lze konzervovat
a sterilizovat materiály a předměty - zahubit
mikroorganismy (bakterie, spory, viry) na povrchu i uvnitř.
Ozářením těchto materiálů, uzavřených v příslušných
obalech, lze tak zabránit biologickému rozkladu potravin či
připravit sterilní materiály (např. obvazové) pro
medicínské použití. K radiační sterilizaci se většinou
používá záření g ze silných radionuklidových ozařovačů
s 60Co
nebo 137Cs,
ozařuje se dávkou min 25kGy a vyšší. Celý proces je nedestruktivní,
může probíhat uvnitř obalu výrobku, lze jej použít i na
teplotně labilní látky či unikátní předměty (konzervace
exponátů v muzeu).
Iontová implantace
Další radiačně-technologickou metodou
je iontová implantace: Ionty vhodných atomů,
urychlené na energice v rozmezí několika keV až MeV (podle
hloubky implantace), se vstřelují do ozařovaných materiálů
za účelem modifikace povrchových vlastností
či dopování povrchů vhodnými příměsemi,
především u kovů a polovodičů. Hlavní oblastí použití
jsou součástky pro slaboproudou elektroniku.
Radioisotopy ve výbojkách
Elektrické výbojky jsou
hermeticky uzavřené (zatavené) skleněné trubice nebo baňky (z tepelně odolného skla, většinou křemičitého), opatřené kovovými elektrodami, s vhodnou plynovou
náplní *). Přivedením dostatečně vysokého
napětí (stovky voltů) na elektrody vzniká v plynové náplni elektrický
výboj, při němž je vyzařováno světlo
(či UV záření) o vlnové délce - barvě -
závislé na chemickém (prvkovém) složení plynové náplně.
*) Mohou to být i páry rtuti či sodíku,
příp. halogenidů kovů (sloučeniny kovů s jódem nebo
brómem), uvolněné zahřátím při výboji.
Pokud
v plynové náplni nejsou přítomné volné náboje - elektrony
a ionty, je pro nastartování výboje potřebné poměrně
vysoké zápalné napětí, aby došlo k
ionizaci nárazem. Ve rtuťových a sodíkových výbojkách se
používá pomocná zapalovací elektroda, umístěná
těsně vedle některé z hlavních elektrod, na kterou se přes
rezistor připojuje napájecí napětí (malá
vzdálenost elektrod způsobí drobný pomocný výboj, který se
posléze rozšíří na celý objem výbojky). V některých výbojkách, jako jsou zářivky,
se pro zapálení výboje používá termoemise elektronů
z wolframových drátků, do kterých se po zapnutí výbojky na
krátkou dobu přivede žhavicí proud pomocí startéru
(což je malá doutnavka s bimetalovými
elektrodami, které se při zahřátí doutnavým výbojem
nakrátko spojí). Další možností je elektronické
zapálení výboje přivedením krátkého impulsu vysokého
napětí (cca 3kV) na elektrody.

Různé způsoby zapálení elektrického výboje ve výbojkách.
Vlevo: Klasické zapálení výboje pomocnou zapalovací
elektrodou, elektronickým impulsem vysokého napětí, nebo
termoemisí elektronů ze žhaveného drátku. Vpravo:
Usnadnění zapálení výboje pomocí ionizace z radioaktivity -
příměsí plynného radionuklidu do náplně, nebo příměsi
radionuklidu do materiálu elektrod.
Pro snadnější zapálení elektrického
výboje, při nižším zápalném napětí, lze též využít
předběžnou ionizaci plynové náplně pomocí
ionizujícího záření z radioaktivity. Lze
toho dosáhnout dvěma způsoby:
1. Přimíchat do plynové náplně vhodný plynný
radionuklid, který při beta radioaktivitě emituje
elektrony vyvolávající slabou ionizaci plynové náplně.
Používá se zde krypton 85Kr (§1.4,
pasáž "Krypton 85Kr") v množství cca 1 kBq.
Pozn.: Do
doutnavek některých startérů zářivek se přidává tritium
3H (asi 1
kBq).
2. Do povrchové vrstvy wolframových elektrod implantovat
radionuklid, který při své radioaktivitě do prostoru
výbojky emituje beta či alfa záření, způsobující ionizaci
plynné náplně. Používají se "thoriované"
elektrody s implantovaným thoriem-232 (§1.4, pasáž "Thorium 232Th") ve formě oxidu.
Pozn.: Hlavním
důvodem je zde však zlepšení metalurgických vlastností
materiálu elektrod......
Radiační
šlechtění rostlin
Specifickou radiační technologii,
založenou na stochastických účincích
záření na živou tkáň, představuje radiační
šlechtění rostlin. Jedná se o urychlení
procesu přírodních mutací (pomocí nichž po tisíciletí vznikaly nové odrůdy) za pomoci biologických účinků ionizujícího
záření. Semena nebo rostliny se ozařují různými dávkami
ionizujícího záření a sledují se radiačně
indukované genetické změny. Napodobují se tím
přírodní procesy spontánních mutací. Záření generuje
náhodné genetické změny, které jsou sice často negativní,
ale vyskytují se i prospěšné. Z různých mutantů se pak
vybírají takoví, jejichž vlastnosti jsou žádoucí pro
další pěstování, šlechtění a rozvíjení nových
pozitivních vlastností v následujících generacích.
Pokud je nový znak ověřený a stabilní, vzniká nová
odrůda - varieta. Při mutačním šlechtění
je nutno vybrat z tisíců nových rostlin tu, která má
požadovanou výslednou mutaci.
Ozařování se provádí buď jednorázově
vyššími dávkami (jednotky Gy), nebo se rostliny ozařují postupně
po několik měsíců nižšími dávkami (dávkovými
příkony řádu mGy/min.). Při této
druhé metodě jsou změny menší, rostliny si reparačními
mechanismy umí opravit některé výrazné poruchy DNA; daří
se získávat širší spektrum mutací při menším radiačním
poškození buněk.
Po mutačním ozařování nastupuje klasické
"šlechtitelské umění" - vybrat z
velkého množství nových rostlin ty s žádanou pozitivní
výslednou mutací a dále je kultivovat a množit. Většina
biologů se domnívá, že na rozdíl od "genetického
inřenýrství" technika radiačního šlechtění
přináší nižší rizika pro lidské zdraví
a přírodní prostředí.
...........přijde
doplnit..............
Vojtěch Ullmann























































